敌百虫对多刺裸腹溞生长和繁殖能力的影响
杜丽君 马丹旦 井维鑫 王 兰 王 茜
(山西大学生命科学学院, 太原 030006)
敌百虫对多刺裸腹溞生长和繁殖能力的影响
杜丽君 马丹旦 井维鑫 王 兰 王 茜
(山西大学生命科学学院, 太原 030006)
在水产养殖业中, 鱼类很容易受到寄生虫的侵扰[1],使用化学药物来降低鱼类寄生虫感染是减少经济损失的重要手段。敌百虫(Trichlorfon), [O, O-二甲基- (2, 2, 2-三氯-1-羟基乙基)膦酸酯]属有机磷脂类化合物, 具有高效、低毒及低残留的特点[2], 是目前最常用的有机磷杀虫剂之一[3]。大量研究结果表明, 敌百虫可以显著抑制乙酰胆碱酯酶活性[4]、诱导产生氧化损伤[5]、降低机体免疫力[6]等。此外, 发现处理池塘中鱼类寄生虫的最佳敌百虫用量为0.1—1.0 mg/L[7]。然而, 在实际使用时往往施加过量的敌百虫到水体中, 且常常反复使用, 这就使得敌百虫在广度和深度上都对水生态系统构成了潜在的威胁, 而且对一些非靶标物种产生严重的影响[8]。
目前, 关于敌百虫的研究, 国内外一般多以小鼠、鱼、虾、蟹等为研究对象[9—12], 而对枝角类的研究仅有少量报道[13,14]。枝角类(又 称 溞类)由于其生长迅速, 繁殖力强, 营养价值高等特点, 常作为许多水产经济动物的活体饵料[15]。如果敌百虫影响了其生长和繁殖, 毒物就可能会通过食物链间接影响到捕食者和被捕食者。鉴于此, 本实验选取常作为鱼类活体饵料、且对环境较敏感[16]的多刺裸腹 溞(Moina macrocopa)为实验材料, 通过研究敌百虫对其生理指标: 心率、体长、寿命、繁殖能力(世代时间、产 溞次数、总产 溞数)、生命表以及内禀增长率的影响, 分析敌百虫对枝角类的毒性作用机制, 丰富枝角类毒理学研究内容, 为水环境质量监测提供理论依据。
1 材料与方法
1.1 受试生物
多刺裸腹 溞采自山西省太原市北张村二里河, 种类鉴定后, 于(25 ±1)℃水温、自然光照下培养, 经三代以上孤雌生殖, 其敏感度达到了中华人民共和国国家标准《水质、物质对溞 类(大 型溞 )急性毒性测定方法》(GB/T13266-91)[17]。
1.2 实验试剂
敌百虫购自太原市农资批发市场, 由南通江山农业化工股份有限公司生产, 有效成分含量达90%。
1.3 实验方法
半致死浓度LC50的确定 选取生长状况良好的幼溞(<12h), 分别接种到含有不同浓度(1、5、10、50、100、500、1000 μg/L)敌百虫溶液的烧杯(250 mL)中, 每个烧杯10只, 设6组平行, 分别于24h、48h 观察每组幼 溞的死亡数(以心脏停止跳动为死亡标准), 利用概率单位法求得24h、48h LC50。实验过程中光照强度为500—600 lx, 光照时间12h︰12h (光照︰黑暗)(下同)。试验期间不喂食。
心率和体长的测定 根据敌百虫对多刺裸腹溞48h LC50的1/2、1/4、1/8、1/16和1/32设定5个浓度组(1、2、4、8、16 μg/L)和对照组进行毒性实验。选取生长良好的幼 溞(<12h), 分别接种到盛有不同浓度敌百虫溶液的烧杯(250 mL)中, 每个烧杯 10只, 设三组平行。于24h、48h 测定幼 溞在20s内的心跳数即心率, 每只水 溞的心率重复测定3次。
水 溞的生长以体长相对增长率(LRi)为指标, 于显微镜下用测微尺测定, 按以下公式计算

式中Li为24、48 h的体长(mm), L0为初始体长(mm), i为实验时间[18]。
寿命及繁殖能力的测定 实验的前一天晚上, 选取处于繁殖期的多刺裸腹 溞置于250 mL烧杯中单独培养,次日选取龄长<12h 的幼 溞 进行实验。将幼 溞分别接种到不同浓度敌百虫溶液(0、1、2、4、8、16 μg/L)的试管(10 mL)中, 每管一只, 10个平行, 重复三次。置于人工气候箱中培养, 温度为(25±1)℃ , 每天定时观察生存及繁殖情况, 统计寿命、世代时间、总产 溞数以及产 溞次数, 并计算内禀增长率(rm)。实验期间每两天更换一次染毒液(内含密度为1.5×106个/mL的酵母), 直至所有母体死亡为止。此外, 对各指标的EC10进行计算, 并比较其敏感性。
内禀增长率 rm的计算 rm根据公式∑ lxmxe-rx= 1在Excel中采用逐步逼近法[19]进行计算, 式中lx为特定年龄存活率, mx为特定年龄繁殖率。
1.4 数据处理
利用 Excel 2007 对数据进行统计分析, 实验结果用平均值±标准差(Mean±SD)表示。并利用 SPSS 16.0进行差异性和显著性分析, 采用单因素方差分析(One-Way ANOVA), 并应用Dunnett 法将染毒组与对照组进行比较, P<0.05为显著性差异, P<0.01为极显著性差异。
2 结果
2.1 敌百虫对多刺裸腹溞的急性毒性
实验观察发现, 多刺裸腹 溞的死亡率随毒物浓度的增大以及时间的延长呈增大趋势, 具有明显的剂量-效应关系。利用概率单位法计算出敌百虫对多刺裸腹 溞24h、48h LC50分别为77.84、31.70 μg/L (表1)

表1 敌百虫对多刺裸腹溞24h、48h的 LC50Tab. 1 LC50of trichlorfon for Moina macrocopa in 24 and 48 hours
2.2 敌百虫对多刺裸腹溞心率和体长的影响
由图 1可知, 在 24h, 随着敌百虫浓度的升高, 多刺裸腹 溞的心率呈现先加快后减慢的趋势。在2 μg/L浓度处理组, 心率极显著升高(P<0.01); 在16 μg/L处理组, 心率极显著降低(P<0.01)。处理48h后, 随敌百虫浓度的升高, 心率呈逐渐降低的趋势, 且均低于对照组。在1 μg/L处理组, 心率显著降低(P<0.05); 在2、8、16 μg/L浓度处理后, 心率受到明显抑制, 且呈现极显著性差异(P<0.01)。
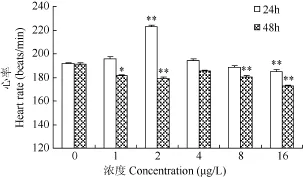
图1 敌百虫对多刺裸腹 溞心率的影响Fig. 1 Effects of trichlorfon on heart rate of M. macrocopa*P<0.05,**P<0.01; 下同 the same applies bellow
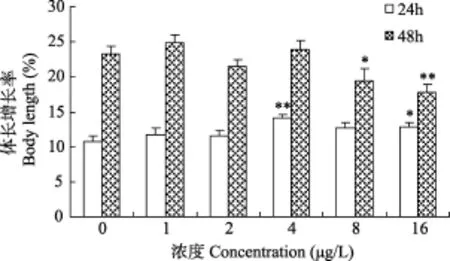
图2 敌百虫对多刺裸腹 溞体长的影响Fig. 2 Effects of trichlorfon on body length of M. macrocopa
由图2看出, 在24、48h, 随着敌百虫浓度的升高, 多刺裸腹 溞的体长增长率呈低浓度促进高浓度抑制的变化规律。在24h, 所有处理组均高于对照组, 4 μg/L时体长增长率最大, 较对照组差异极显著(P<0.01); 之后, 体长增长率逐渐下降, 在16 μg/L时, 显著降低(P<0.05)。在48h, 8 μg/L处理组, 增长率显著降低(P<0.05); 16 μg/L时, 增长率明显受到抑制(P<0.01)。
2.3 不同浓度敌百虫对多刺裸腹溞生命表的影响
观察表 2可知, 随年龄的增长和敌百虫浓度的升高,多刺裸腹 溞的存活率和繁殖率均发生明显的变化。在同一年龄不同浓度, 存活率基本上呈先升后降的趋势。在低浓度组 1、2 μg/L时, 存活率明显升高; 之后, 逐渐趋于对照组; 但在16 μg/L时, 又明显降低。繁殖率在中低浓度组(1—4 μg/L), 变化不大; 但在高浓度组 8、16 μg/L时,明显低于对照组。
2.4 敌百虫对多刺裸腹溞繁殖参数和内禀增长率的影响
观察表3发现, 敌百虫对多刺裸腹 溞的世代时间、总产 溞数、产 溞次数、寿命和内禀增长率rm均有显著的影响(P<0.05)。敌百虫可以显著延长世代时间(P<0.05), 降低母 溞的总产 溞数和产 溞次数(P<0.05), 且在最高浓度组16 μg/L时均出现极显著性差异(P<0.01)。随着敌百虫浓度的升高, 多 刺裸腹 溞的寿命和内禀增长率均呈现先升高后降低的趋势, 在 2 μg/L处理组, 寿命上升至最大值(P<0.01); 在 1 μg/L处理组, 内禀增长率达到最大值(P<0.01); 然而在浓度为 16 μg/L时, 寿命和内禀增长率极显著性降低(P<0.01)。此外, 还发现世代时间的 EC10(1.21 μg/L)最小, 总产 溞数 EC10(3.53 μg/L)和 产 溞次数EC10( 3.81 μg/L)相似, 而寿命的EC10(5.11 μg/L)最大。
3 讨论
3.1 敌百虫对多刺裸腹溞的急性毒性
半致死浓度已被广泛用于评价各种污染物对水生生物的毒性大小, 通过敌百虫对多刺裸腹 溞的急性毒性实验, 测得其对多刺裸腹 溞的24h、48h LC50分别为77.84、31.70 μg/L。其安全浓度为 1.58 μg/L [安全浓度=48h LC50×0.3/(24h LC50/48h LC50)2][20], 而水体中敌百虫最佳用量为0.1—1.0 mg/L, 明显高于其安全浓度。因此, 在多刺裸腹 溞的培养中应预防敌百虫的污染, 且建议 溞类养殖水体中敌百虫的浓度应<1.58 μg/L。
3.2 敌百虫对多刺裸腹溞生长的影响

表2 不同浓度敌百虫作用下多刺裸腹溞的生命表Tab. 2 Life tables of M. macrocopa at different trichlorfon concentrations (n=30)
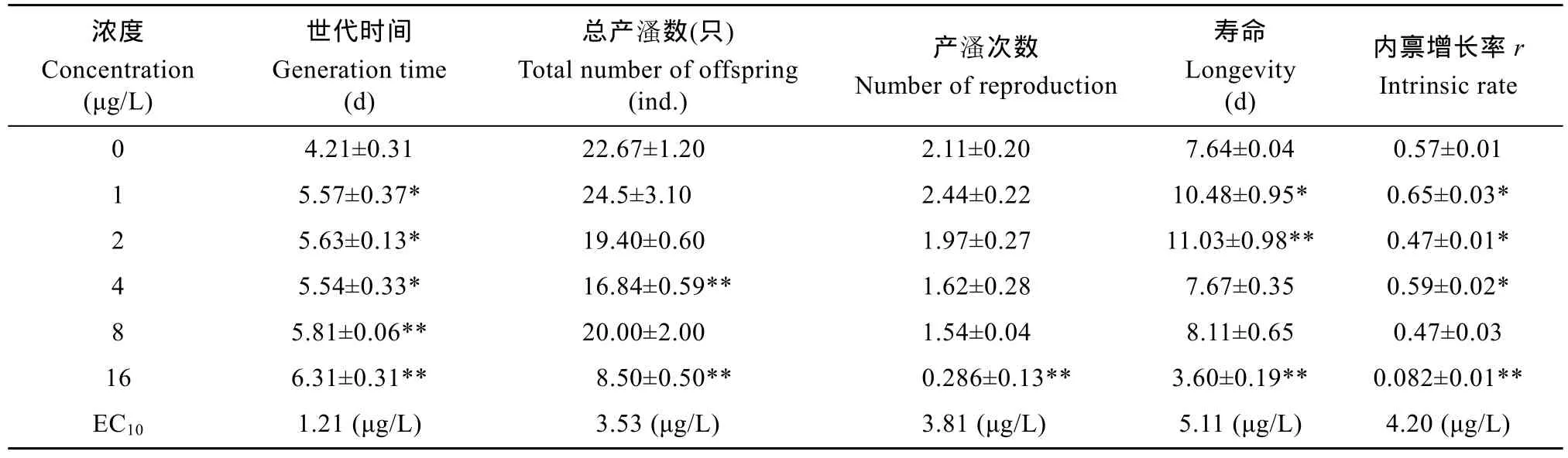
表3 敌百虫对多刺裸腹溞繁殖参数和内禀增长率的影响Tab. 3 Effects of trichlorfon on reproductive parameters and intrinsic rate of M. macrocopa (n=30)
生理指标, 如心率、生长状况、体长、繁殖、干重等,常作为生物体生长和受损情况的一项重要监测指标。枝角类循环系统不发达, 一般只有心脏而无血管, 血液只在体腔内以及组织间流动[21]。已有大量研究表明, 枝角类心率的变化明显受到外界环境的影响, 如低氧、低温胁迫可导致水 溞心率降低[22,23], 外界化学物质也会引起水 溞心率的变化[24,25]。 敌百虫作用于多刺裸腹 溞, 体长、心率基本上表现出先升后降的变化趋势。这与王茜等的研究结果,低浓度(2%)的 工业污水使多刺裸腹 溞心率、体长加快, 而高浓度(16%)工业污水则对生物体造成损伤, 抑制其生长, 使心率、体长减慢相一致[26], 是一种“毒物兴奋效应”[27,28]。即低浓度的毒物对多刺裸腹 溞具有促进作用, 会使新陈代谢加快, 心率、生长加快, 这是多刺裸腹 溞为抵抗外界毒害进行的自身调控; 而高浓度的毒物使多刺裸腹 溞机体出现不可逆的损伤, 生理功能紊乱, 表现为抑制作用, 即心率降低, 生长减慢, 甚至死亡。心率和体长的变化受时间的影响效果也较明显, 短时间处理(24h), 促进效果较明显, 如处理组的体长增长率均高于对照组; 而长时间处理(48h), 抑制效果较明显, 如处理组心率均低于对照组。其原因可能是由于毒物在生物体内逐渐积累, 导致毒性变大, 损伤加重。
3.3 敌百虫对多刺裸腹溞繁殖能力的影响
在敌百虫胁迫下, 随毒物浓度的增加多刺裸腹 溞世代时间延长、总产 溞数和产 溞次数均下降。这是因为生物体的能量主要是用于生长、繁殖以及维持基础代谢, 但毒物胁迫后生物体为降低和消除外来物质产生的不利影响,会作出一系列的应激反应, 导致基础代谢消耗的能量增加, 因此, 用于生长和繁殖的能量便减少[29]。在低浓度(1 μg/L)的敌百虫胁迫后, 多刺裸腹 溞便生长发育迟缓,导致世代时间的显著延长(P<0.05), 并且繁殖能力也逐渐降低, 在中高浓度组(4、16 μg/L)总 产 溞 数和产 溞次数极显著降低(P<0.01)[30]。然而, 裸腹 溞的寿命却随敌百虫浓度的增加呈先升后降的趋势, 这也属于“毒物兴奋效应”。由此可见, 低浓度的敌百虫启动机体的修复机制, 增强抵抗能力, 延长其寿命, 但这是以牺牲繁殖能力为代价的; 而高浓度的敌百虫导致生物体生理功能紊乱, 生长和繁殖均受到明显抑制。
内禀增长率(rm)是指在特定条件下, 种群的最大瞬时增长率。已有大量文献报道, rm可以灵敏的反应外界环境的细微变化, 是种群对环境质量变化的一个敏感指标。路鸿燕等[18]研究发现, 原油、柴油、汽油以及煤油对蒙古裸腹 溞慢性毒性实验中rm是敏感指标。刘宁等[31]研究显示, Pb2+作用于多刺裸腹 溞后, rm产生明显的变化。Chu, et al.[15]研究发现具有雌激素活性、低浓度(0.005、0.01 mg/L)的甲氧普林对多刺裸腹 溞的内禀增长率具有促进作用;但当浓度升高到0.05 mg/L及以上时, 裸腹 溞的生长、寿命、繁殖能力均被抑制, 内禀增长率显著降低。与其一致的是, 本研究发现, 敌百虫对多刺裸腹 溞的 rm也具有明显的影响, 1 μg/L的敌百虫诱导rm明显升高, 而随着浓度的升高rm逐渐趋于对照组, 但升高至最高浓度16 μg/L时, rm极显著性下降(P<0.01)。这表明一些毒物在低浓度可以引起多刺裸腹 溞种群数量的瞬时增长, 而高浓度则会使种群数量急剧下降, 由此导致的食物链的连锁反应对人类的生产、生活和自然界的生态平衡都会产生巨大的影响,因此应当引起足够的重视。
4 结论
(1) 敌百虫对多刺裸腹 溞的生长具有明显的影响,表现为低浓度促进高浓度抑制的变化规律, 且心率的敏感性比相对生长率强。(2) 多 刺裸腹 溞的繁殖参数和内禀增长率对敌百虫的敏感性各不同, 不同指标间的敏感性顺序为: 世代时间> 总产 溞数> 产 溞次数>内禀增长率>寿命。其中, 世代时间的敏感性最强, EC10为1.21 μg/L; 总产 溞数与产 溞次数的敏感性相似。
[1] Grave K, Engelstad M, Soli N E. Utilization of dichlorvos and trichlorfon in salmonid farming in Norway during 1981—1988 [J]. Acta Veterinaria Scandinavica, 1991, 32(1): 1—7
[2] Meng Q L, Chen S L. How to effectively and reasonably use trichlorfon in fishery production [J]. Tianjin Fisheries, 2008, 1: 30—31 [孟庆玲, 陈士良. 渔业生产中如何合理有效使用敌百虫. 天津水产, 2008, 1: 30—31]
[3] He H W. Present situation and developing trend of organophosphorus pesticide industry [J]. World Pesticides, 2008, 30(6): 29—34 [贺红武. 有机磷农药产业的现状与发展趋势. 世界农药, 2008, 30(6): 29—34]
[4] Guimaraes A T B, Silva de Assis H C, Boefer W. The effect of trichlorfon on acetylcholinesterase activity and histopathology of cultivated fish Oreochromis niloticus [J]. Ecotoxicology and Environmental Safety, 2007, 68: 57—62
[5] Bai G F, Zeng X B. Effect of trichlorfon on the activities of three antioxidant enzymes of earthworm [J]. Journal of Jilin Agricultural Sciences, 2013, 3(1): 22—26 [白桂芬, 曾小波.敌百虫对蚯蚓体内3种抗氧化酶活性的影响. 吉林农业科学, 2013, 3(1): 22—26]
[6] Chang C C, Lee P P, Liu C H, et al. Trichlorfon, an organophosphprus insecticide, depresses the immune responses and resistance to Lactococcus garvieae of the giant freshwater prawn Macrobrachium rosenbergii [J]. Fish & Shellfish Immunology, 2006, 20: 574—585
[7] Herwig N. Handbook of Drugs and Chemicals used in Treatment of Fish Diseases, a Manual of Fish Pharmacology and Material Medica [M]. Thomas Publishers, Springfield, IL, USA. 1979
[8] Chang C C, Rahmawaty A, Chang Z W. Molecular and immunological responses of the giant freshwater prawn, Macrobrachium rosenbergii, to the organophosphorus insecticide, trichlorfon [J]. Aquatic Toxicology, 2013, 130—131: 18—26
[9] Chang C C, Lee P P, Hsu J P, et al. Survival, and biochemical,physiological, and histopathological responses of the giant freshwater prawn, Macrobrachium rosenbergii, to short-term trichlorfon exposure [J]. Aquaculture, 2006, 253: 653—666
[10] Tian Y, Zhou S, Gao Y, et al. Effects of repeated maternal oral exposure to low levels of trichlorfon on development and cytogenetic toxicity in 3-day mouse embryos [J]. Food and Chemical Toxicology, 2011, 49: 2655—2659
[11] Sinha A K, Vanparys C, Boeck G D, et al. Expression characteristics of potential biomarker genes in Tra catfish, Pangasianodon hypophthalmus, exposed to trichlorfon [J]. Comparative Biochemistry and Physiology, Part D, 2010, 5: 207—216
[12] Zhu Y F, Hong W S. Toxic effects of trichlorfon on perch Lateolabrax maculates [J]. Chinese Journal of Ecology, 2011, 30(7): 1484—1490 [朱友芳, 洪万树. 敌百虫对中国花鲈的毒性效应. 生态学杂志, 2011, 30(7): 1484—1490]
[13] Xie Q M, Li X Y. Acute toxicities of two organphosphorous pesticides to water fleas Moina mongolica [J]. Fisheries Science, 2007, 26(3): 164—166 [谢钦铭, 李向阳. 敌百虫和久效磷农药对蒙古裸腹溞 的急性毒性研究. 水产科学, 2007, 26(3): 164—166]
[14] Wang N, Liu L L, Sun K F, et al. Analysis of structureactivity relationship and toxicity of organophosphorus pesticide to plankton [J]. Ecology and Environmental Sciences, 2012, 21(1): 118—123 [王娜, 刘莉莉, 孙凯峰, 等. 有机磷农药的构效关系及其对浮游生物的毒性效应. 生态环境学报, 2012, 21(1): 118—123]
[15] Wang D L, Xu S L, Peng S W. Principal parameters of population growth and seawater acclimation of Moian macrocopa straus at different salinity and food conditions [J]. Acta Hydrobiologica Sinica, 2000, 24(1): 56—62 [王丹丽, 徐善良,彭仕伟. 多刺裸腹 溞在不同盐度下的种群增长参数及其驯化. 水生生物学报, 2000, 24(1): 56—62]
[16] Engert A, Chakrabarti S, Saul N, et al. Interaction of temperature and an environmental stressor: Moina macrocopa responds with increased body size, increased lifespan, and increased offspring numbers slightly above its temperature optimum [J]. Chemosphere, 2013, 90: 2136—2141
[17] State Environmental Protection Administration. Water Quality-Determination of the Acute Toxicity of Substance to Daphnia (Daphnia magna straus). Beijing. 1991 [国家环境保护总局. 水质、物质对 溞类(大 型 溞)急性毒性测定方法(GB/T13266-91). 北京: 国家环境保护局. 1991]
[18] Lu H Y, He Z H. Toxicity of crude oil and refined oils from Daqing to Moina mongolica Dady [J]. Journal of Dalian Fisheries University, 2000, 15(3): 169—174 [路鸿燕, 何志辉. 大庆原油及成品油对蒙古裸腹溞 的毒性. 大连水产学院学报, 2000, 15(3): 169—174]
[19] Hu H Y. A easy calculation for exact value of the intrinsic rate of increase [J]. Anhui Agricultural Science Bulletin, 2010, 16(3): 173—174 [胡好远. 种群内禀增长率精确值的简便求法. 安徽农学通报, 2010, 16(3): 173—174]
[20] Zhang Y Y, Mu Z B, Fang D W. Acute toxicity of common disinfectants to juvenile of lenok Brachymystax Lenok [J]. Chinese Journal of Fisheries, 2007, 20(2): 63—66 [张玉勇,牟振波, 房殿武. 几种常用消毒剂对细鳞鱼鱼种急性毒性试验. 水产学杂志, 2007, 20(2): 63—66]
[21] Jiang X Z, Du N S. Fauna Sinica-Freshwater Cladocera [M]. Beijing: Science Press. 1979 [蒋燮治, 堵南山. 中国动物志-淡水枝角类. 北京: 科学出版社. 1979]
[22] Paul R J, Colmorgen M, Pirow R, et al. Systemic and metabolic responses in Daphnia magna to anoxia [J]. Comparative Biochemistry and Physiology, Part A, 1998, 120(3): 519—530
[23] Lamkemeyer T, Zeis B, Paul R J. Temperature acclimation influences temperature-related behaviour as well as oxygentransport physiology and biochemistry in the water flea Daphnia magna [J]. Canadian Journal of Zoology, 2003, 81(2): 237—249
[24] Yang G, Zhang X Q, Qian Z N, et al. Research on chronic toxicity to MET to Daphnia magna [J]. Modern Agrochemicals, 2003, 2(3): 22—25 [杨赓, 张晓强, 钱忠宁, 等. 多效唑对大型溞 的慢性毒性研究. 现代农药, 2003, 2(3): 22—25]
[25] Wu C J. Daphnia and its heart rate experiment [J]. Biology Teaching, 2003, 28(17): 26—27 [吴成军. 水 溞及其心率实验. 生物学教学, 2003, 28(17): 26—27]
[26] Wang Q, Zhang C J, Liu Z F, et al. Effects of industrial wastewater on heart rate, body length and antioxidases of Moina macrocopa [J]. Chinese Journal of Ecology, 2009, 28(2): 300—303 [王茜, 张辰佳, 刘占峰, 等. 工业污水对多刺裸腹溞 心率、体长和抗氧化酶系的影响. 生态学杂志, 2009, 28(2): 300—303]
[27] Peng F, Wang Q, Wang L. Effect of deltamethrin on acute toxicity and detoxification metabolism in water flea, Moina macrocopa [J]. Acta Hydrobiologica Sinica, 2013, 37(3): 530—534 [彭方, 王茜, 王兰. 溴氰菊酯对多刺裸腹 溞急性毒性及解毒代谢的影响. 水生生物学报, 2013, 37(3): 530—534]
[28] Schulz T J, Zarse K, Voigt A, et al. Glucose restriction extends Caenorhabditis elegans life span by inducing mitochondrial respiration and increasing oxidative stress [J]. Cell Metabolism, 2007, 6(4): 280—293
[29] Sancho E, Villarroel M J, Andreu E, et al. Disturbances in energy metabolism of Daphnia magna after exposure to tebuconazole [J]. Chemosphere, 2009, 74: 1171—1178
[30] Chu K H, Wong C K, Chiu K C. Effect of the insect growth regulator (S)-methoprene on survival and reproduction of the freshwater cladoceran Moina Macrocopa [J]. Environmental Pollution, 1997, 96(2): 173—178
[31] Liu N, Xi Y L, Shen P, et al. Effects of lead concentration and algal density on life table demography of Moina macrocopa [J]. Acta Ecologica Sinica, 2010, 30(18): 4866—4874 [刘宁, 席贻龙, 沈鹏, 等. Pb2+浓度和藻类食物密度对多刺裸腹 溞生命表统计学参数的影响. 生态学报, 2010, 30(18): 4866—4874]
EFFECTS OF TRICHLORFON ON GROWTH AND REPRODUCTION OF THE FRESHWATER CLADOCERAN MOINA MACROCOPA
DU Li-Jun, MA Dan-Dan, JING Wei-Xin, WANG Lan and WANG Qian
(School of Life Science, Shanxi University, Taiyuan 030006, China)
多刺裸腹 溞; 心率; 体长; 繁殖能力; 内禀增长率; 敌百虫
Moina macrocopa; Heart rate; Body length; Reproductive ability; Intrinsic rate; Trichlorfon
X171.5
A
1000-3207(2014)04-0786-05
10.7541/2014.109
2013-10-14;
2014-02-18
山西省青年自然科学基金项目(No. 20051035)资助
杜丽君(1988—), 女, 山西临汾人; 硕士研究生; 主要研究方向为动物环境毒理学。E-mail: dulijunsxdx@163.com
王茜(1978—), 女, 主要研究方向为环境毒理学。E-mail: wangqian@sxu.edu.cn

