凤仙花不同部位乙醇提取物多酚、黄酮含量测定及抗氧化活性研究
姜洪芳, 石宝俊,程 晶,张凤倩,朱 熹,施国新*,张卫明*
(1.南京师范大学, 江苏 南京 210046;2.南京野生植物综合利用研究院, 江苏 南京 210042;3.南京农业大学,江苏 南京 210095)
凤仙花(ImpatiensbalsaminaL.)为凤仙花科(Balsaminaceae)凤仙花属(Impatiens)一年生草本植物。凤仙花属共有植物900余种,全球均有分布,其中凤仙花(ImpatiensbalsaminaL.)作为观赏植物国内外均有种植,也是该属植物的常见品种,其花、茎、叶、种子在民间有悠久的药用历史,被广泛用于各种中药配方中,例如抗感染、关节炎、镇痛、抗炎、抗过敏、抗肿瘤、肌肉拉伤及产后产生的疼痛[1-2]。已经从凤仙花中分离鉴别了多种成分,如黄酮、多酚、花青素、皂苷、醌类。一些化合物的镇痛和抗过敏活性,特别是多酚及醌类已经进行了广泛研究[3-6],而以植物化学为基础的凤仙花提取物的其他传统应用相对研究较少。凤仙花的传统用法为,用水煮沸直接饮用治疗细菌及真菌感染,或者是直接制成糊剂用于治疗皮肤及指甲的局部感染。国内胡喜兰等利用不同溶剂对凤仙花的红色花瓣进行活性成分提取,采用试剂盒法对其进行抗氧化活性测定,结果显示凤仙花的各种不同提取物均具有一定的抗氧化能力[7]。现代研究表明,抗氧化剂具有延缓衰老,降低多种疾病产生,增强人体免疫力等多种功能,研究开发安全高效的天然抗氧化剂已经成为当今研究热点之一,而凤仙花各部位又具有不同功效,因此对于凤仙花不同部位的抗氧化活性具有进一步探索的必要。
本文用55%的乙醇分别回流提取凤仙花的茎、叶、花中的活性物质,然后测定各部位的多酚及黄酮含量,采用常用的几种体外抗氧化体系,测定各提取物对DPPH、羟自由基、超氧阴离子自由基的清除能力和还原力等抗氧化活性指标。结果表明,凤仙花各部位的多酚含量由高到低依次为凤仙花的叶、花、茎。各种提取物均有不同程度的抗氧化活性,且抗氧化活性与提取物浓度存在量效关系,其中叶提取物清除DPPH自由基、羟自由基、超氧阴离子自由基活性以及还原力均最高,本研究为凤仙花作为低毒高效的天然抗氧化剂应用提供了依据。
1 实验部分
1.1 仪器、试剂与材料
T6紫外可见分光光度计(北京普析通用仪器有限公司)、恒温水浴锅、分析天平(METTLER)、离心沉淀机(上海手术器材厂)、旋转蒸发仪(上海亚荣仪器厂)。
没食子酸、芦丁均购于中国生物制品检定研究院,批号110831-201303、100080-201202。
抗坏血酸(即Vc),三氯化铝、福林酚(Folin-Ciocalteu)试剂、无水碳酸钠、DPPH(1,1-二苯基-2-三硝基苯肼)、过氧化氢、邻苯三酚(焦性没食子酸)、三羟甲基氨基甲烷(Tris)、盐酸、三氯乙酸、磷酸二氢钠 、磷酸氢二钠、三氯化铁、水杨酸、硫酸亚铁、铁氰化钾为市售分析纯。
凤仙花的花、茎、叶、均于2013年7月采自南京市郊区,晾干,经鉴定其基原为ImpatiensbalsaminaL.。
1.2 实验方法
1.2.1 提取物的制备
分别称取50 g凤仙花的花、茎、叶,研磨碾碎后分别加入55%乙醇750 mL,回流提取2 h,过滤,滤渣加入55%乙醇600 mL混匀,再次回流提取2 h,过滤,合并两次滤液,70 ℃减压蒸干,备用。
1.2.2 多酚、总黄酮含量测定[8-9]
1.2.2.1 多酚标准曲线的绘制
精密称定0.1001 g没食子酸,用蒸馏水溶解定容至100 mL,得1.001 mg/mL没食子酸标准溶液。分别移取0、0.05、0.10、0.15、0.20、0.25、0.30 mL到50 mL容量瓶中,加入25 mL蒸馏水,加入2.00 mL Folin-Ciocalteu试剂摇匀,静置4~5 min,加入10%Na2CO3溶液4.00 mL,用蒸馏水定容至50 mL,置于25 ℃的恒温水浴锅中显色2 h,于最大吸收波长765 nm处测定各个标准溶液吸光度,以没食子酸浓度为横坐标,吸光度为纵坐标,绘制标准曲线,求线性回归方程。
1.2.2.2 总黄酮标准曲线的绘制
精密称定0.042 01 g芦丁,用甲醇溶解定容至10 mL,得4.201 mg/mL芦丁标准溶液。分别移取0.05、0.06、0.07、0.08、0.09、0.10 mL到10 mL具塞试管中,加入1%AlCl3溶液5.00 mL,混匀,室温静置30 min,于415 nm处测定吸光度值,以芦丁浓度为横坐标,吸光度为纵坐标,绘制标准曲线,求线性回归方程。
1.2.2.3 凤仙花不同部位多酚、总黄酮测定
准确称取凤仙花的花、茎、叶提取物各0.1000 g,溶于100 mL 65%乙醇中,得1.000 mg/mL样品液,准确吸取0.10 mL提取液按1.2.2.1、1.2.2.2进行显色反应,按照回归方程计算测定液中多酚、总黄酮浓度,并计算出提取物中多酚、总黄酮的含量。
1.2.3 凤仙花各部位提取物抗氧化活性比较
准确称取凤仙花的花、茎、叶提取物和对照品Vc各0.100 0 g,溶于100 mL 65%乙醇中,得1.000 mg/mL母液,并分别稀释,配制成0.10、0.25、0.50、0.75、1.00 mg/mL的提取物及对照品溶液,供抗氧化活性测定用。
1.2.3.1 对DPPH自由基清除活性的测定[10]
(1)0.5 mmol/L DPPH甲醇溶液
准确称取DPPH固体粉末0.049 5 g,在烧杯中用少量甲醇溶解,定容至250 mL容量瓶中,配制成0.5 mmol/L DPPH甲醇溶液。
(2)样品溶液的测定
分别移取不同浓度的样品及对照品溶液2.00 mL,加入0.5 mmol/L DPPH甲醇溶液2.00 mL,混匀15 s后,放置30 min,以2 .00 mL不同浓度样品或对照品溶液加入2.00 mL甲醇为参比,于517 nm测吸光度,记为A1,每个试样作3次平行测定,取其均值,同时移取2.00 mL 65%乙醇加入2.00 mL 0.5 mmol/L DPPH甲醇溶液,混匀15 s后,放置30 min,以2.00 mL 65%乙醇加入2.00 mL甲醇为参比,于517 nm测吸光度,记为A0,并根据下述公式计算清除率。
1.2.3.2 对羟自由基清除活性的测定
采用改良的Smirnoff水杨酸法[11],即利用H2O2与Fe2+反应产生羟自由基,即:H2O2+Fe2+→·OH+H2O+Fe3+,在体系内加入水杨酸捕捉并产生有色物质,该物质在510 nm处有最大吸收。
(1)10 mmol/L硫酸亚铁溶液的配制
精密称取0.3475 g硫酸亚铁,溶于250 mL蒸馏水中,即得10 mmol/L硫酸亚铁溶液。
(2)10 mmol/L水杨酸乙醇溶液的配制
精密称取0.417 5 g水杨酸,溶于250 mL乙醇中,即得10 mmol/L水杨酸乙醇溶液。
(3)2.5 mmol/L H2O2溶液的配制
精密量取0.13 mL H2O2溶液(体积分数为30%),加蒸馏水稀释,并定容至500 mL,即得2.5 mmol/L H2O2溶液。
(4)样品溶液的测定
分别准确量取10 mmol/L硫酸亚铁溶液、10 mmol/L水杨酸乙醇溶液和不同浓度的样品溶液各1.00 mL,置于具塞试管中混匀,分别加入2.5 mmol/L H2O2溶液2.00 mL,37 ℃水浴30 min后,分别在510 nm处测定吸光度值。每个试样作3次平行测定,取其均值为A1,另外参照上述操作分别测定相应的吸光度值A0和A2,按下式计算羟自由基清除率:
其中:A0为反应体系中不含样品,但含邻苯三酚的吸光度值;A1为反应体系中既含样品,又含邻苯三酚的吸光度值;A2为反应体系中含有样品,但不含邻苯三酚的吸光度值。
1.2.3.3 对超氧阴离子自由基清除活性的测定
采用邻苯三酚自氧化法测定样品对超氧阴离子自由基的清除能力[12]。
(1)0.05 mol/L Tris-HCl缓冲液(pH=8.2)的配制
精密称取1.211 g 三羟甲基氨基甲烷(Tris),溶于蒸馏水中定容至100 mL;量取50.00 mL上述溶液与0.1 mol/L盐酸22.90 mL混匀后,加水稀释至100 mL,所得缓冲液pH值为8.2。
(2)盐酸溶液的配制
精密量取0.8 mL的浓盐酸,加蒸馏水稀释至100 mL,即得0.1 mol/L盐酸溶液;精密量取0.85 mL浓盐酸,加水稀释至1 000 mL,即得10 mmol/L盐酸溶液。
(3)25 mmol/L邻苯三酚溶液的配制
精密称取0.315 0 g邻苯三酚,用10 mmol/L盐酸溶解,定容至100 mL,即得25 mmol/L邻苯三酚溶液。
(4)样品溶液的测定
精密量取0.05 mmol/L Tris-HCl缓冲液4.50 mL,25 ℃水浴20 min,分别加入1.00 mL不同浓度的各样品溶液和25 mmol/L邻苯三酚溶液0.40 mL,混匀,于25 ℃水浴中反应5 min,加入10 mmol/L盐酸溶液1.00 mL终止反应,于325 nm处测定吸光度。每个试样作三次平行测定,取其均值为A1。另外参照上述操作分别测定相应的吸光度值A0和A2,按下式计算超氧阴离子清除率:
其中:A0为反应体系中不含样品,但含邻苯三酚的吸光度值;A1为反应体系中既含样品,又含邻苯三酚的吸光度值;A2为反应体系中含有样品,但不含邻苯三酚的吸光度值。
1.2.3.4 凤仙花还原力的测定
参考Oyaizu和Amarowicz等的方法,稍作改进[13]。
(1)pH6.6磷酸缓冲液的配制
分别精密称取磷酸二氢钠、磷酸氢二钠和氯化钠1.740 0 g、2.700 0 g、1.700 0 g,溶于400 mL蒸馏水中,即得pH6.6磷酸缓冲液。
(2)1%铁氰化钾溶液的配制
精密称取1.000 0 g铁氰化钾,溶于100 mL蒸馏水中,即得1%铁氰化钾溶液。
(3)10%三氯乙酸溶液的配制
精密称取10.000 0 g三氯乙酸,溶于100 mL蒸馏水中,即得10%三氯乙酸溶液。
(4)0.1%三氯化铁溶液的配制
精密称取0.170 0 g六水合氯化铁,溶于100 mL蒸馏水中,即得0.1%三氯化铁溶液。
(5)样品溶液的测定
精密量取不同浓度的样品溶液2.50 mL于试管中,依次加入2.50 mL磷酸缓冲液(pH6.6)和1%铁氰化钾溶液2.50 mL,于50 ℃水浴保温20 min,快速冷却,再加入10%三氯乙酸2.50 mL,以3 000 r/min离心10 min,取上清液2.50 mL,依次加入2.00 mL蒸馏水,0.1%的三氯化铁溶液0.50 mL,充分混匀,静置10 min后,于700 nm处测吸光度值,吸光值越大表示还原力越强(以蒸馏水作对比)。每个试样作3次平行测定,取其平均值。
2 结果与讨论
2.1 凤仙花各部位乙醇提取物的提取率、多酚及总黄酮含量
从表1中可以看出,凤仙花不同部位的乙醇提取物的得率存在差异,其中凤仙花的花提取物得率为33.20%,凤仙花的茎提取物得率为22.40%,凤仙花的叶提取物的得率为28.33%。通过应用多酚线性回归方程:y=0.108 5x-0.027 9(R2=0.995 5)及总黄酮线性回归方程:y=6.517x-1.159 6(R2=0.999 2),计算出凤仙花不同部位醇提取物中的多酚含量(以没食子酸计)及总黄酮含量(以芦丁计),见表1。
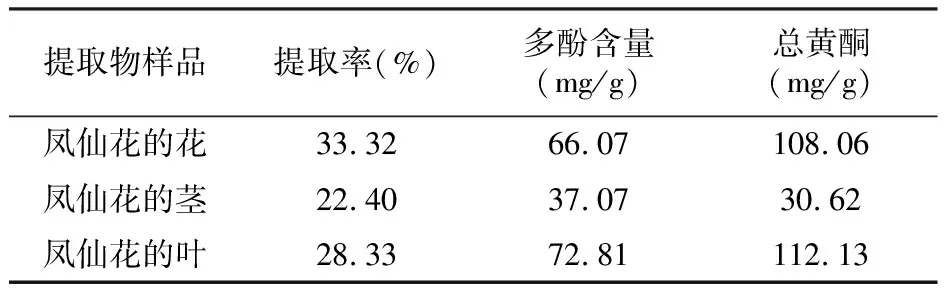
表1 凤仙花不同部位乙醇提取率和多酚、总黄酮含量
2.2 凤仙花各部位提取物抗氧化活性比较
2.2.1 对DPPH自由基清除活性的测定结果
DPPH法从1958年被提出后,就被广泛地用于各种生物试样和食品的抗氧化能力测定。DPPH自由基以氮为中心,其结构十分稳定,主要是由于起共振作用的3个苯环的空间障碍,使氮原子上的单电子不能够发挥电子成对作用。DPPH检测法是根据DPPH自由基于517 nm处有一强吸收峰,其醇溶液呈紫色的特性。当自由基清除剂存在时,通过使DPPH分子中1个稳定自由基与抗氧化剂提供的1个电子配对结合使DPPH的特征紫色消失,褪色的程度和自由基清除剂的电子数量存在定量关系,因此可用分光光度计进行快速定量分析从而用于抗氧化剂清除自由基能力的评价。与其他体外抗氧化法相比,清除DPPH自由基法更加快速、简单、灵敏,因而被广泛应用。
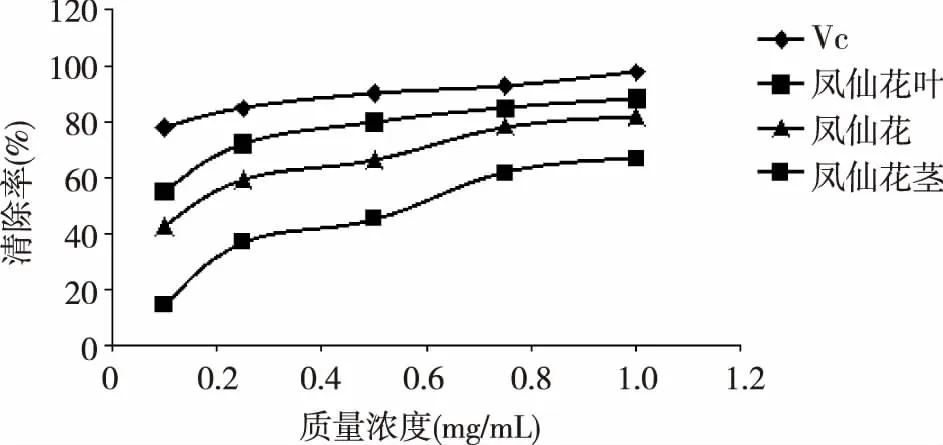
图1 凤仙花不同部位提取物对DPPH清除活性
凤仙花各部位乙醇提取物对DPPH清除率的分析如图1所示,在此实验中,以Vc为对照,在试验浓度范围内,随着浓度的升高,Vc及各样品对DPPH自由基的清除率都呈现增长的趋势,且各样品对DPPH自由基清除率在浓度较低时上升较快,在浓度较高时上升较慢。各试验样品对DPPH清除能力大小从高到低分别为:Vc >凤仙花的叶提取物>凤仙花的花提取物>凤仙花的茎提取物。当浓度达到1.00 mg/mL时,Vc对DPPH自由基的清除率高达98.03%,凤仙花的叶提取物对DPPH自由基也具有较好的清除能力,清除率为88.53%。
2.2.2 对超氧阴离子自由基清除活性的测定结果
人体内大部分氧分子代谢生成水,但有约5%的氧分子受单一电子还原,从而成为超氧阴离子,超氧阴离子不仅是阴离子同时也是自由基,性质十分活泼,具有很强的氧化性和还原性。超氧阴离子是氧自由基生成中的第一个自由基,是生物体生理反应常见的中间产物,作为活性氧的一种,可能引起细胞结构功能的破坏,从而导致组织损伤、衰老,诱发炎症和肿瘤。
邻苯三酚自氧化法是测定超氧阴离子自由基清除活性的常用方法,其主要机理为,邻苯三酚在碱性条件下发生自氧化从而释放超氧阴离子自由基,并生成有色中间物质,该物质在325 nm左右有特征吸收,当有抑制剂存在时,可以减少此中间物质的积累,因此可通过比色法检测该物质的吸光度值来计算待测物质对超氧阴离子的清除能力。
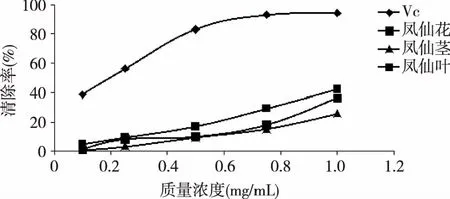
图2 凤仙花不同部位提取物对超氧阴离子自由基的清除活性
以Vc为对照,测定凤仙花各部位提取物清除超氧阴离子的能力,结果如图2所示。从图中可以看出,在试验所测定浓度范围内,各样品对超氧阴离子自由基的清除率都随着浓度的升高而升高。各试验样品对超氧阴离子清除能力大小从高到低分别为:Vc>凤仙花的叶提取物>凤仙花的花提取物>凤仙花的茎提取物。其中Vc的上升趋势较快,并且在浓度达到0.75 mg/mL时,Vc对超氧阴离子自由基的清除率已经达到95%;凤仙花各部位提取物对超氧阴离子自由基的清除率虽然有所升高,但趋势较为缓慢,在1.00 mg/mL的浓度下,其抑制率不到40%,因此凤仙花对超氧阴离子自由基具有一定的清除作用,但是较弱。
2.2.3 凤仙花对羟自由基清除活性的测定
人体在生命活动氧化代谢过程中会产生各种各样的自由基,而羟自由基是其中化学性质最活泼、对机体危害最大的自由基。它能够和多肽、蛋白、脂类、DNA,特别是鸟嘌呤核苷等发生反应,使得不饱和脂肪酸氧化,生成脂质过氧化物,导致膜结构遭到破坏,从而使机体受到损伤与破坏,加快机体的衰老,引起脑缺血、帕金森氏症、风湿性关节炎、呼吸窘迫综合症、心血管疾病和癌症等疾病[1]。本试验采用水杨酸法测定样品对羟自由基的清除能力,水杨酸是最常用的捕获剂,其羟基化产物是2,3-二羟基苯甲酸以及2,5-二羟基苯甲酸。过氧化氢和硫酸亚铁溶液中的二价铁离子发生Fenton反应产生羟自由基,用水杨酸捕捉高活性的羟自由基可产生有色物质,且该有色物质在510 nm处有最大吸收,若向反应体系里加入抗氧化剂,可以和水杨酸形成竞争从而减少有色物质生成。因此本试验通过分光光度计对有色物质的吸光度进行测定达到间接测定自由基的目的,进而反应氧化应激水平。
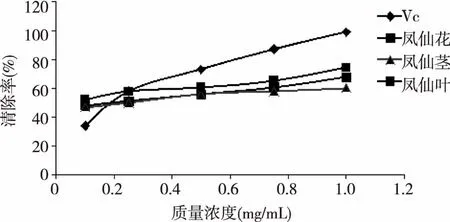
图3 凤仙花不同部位提取物对羟自由基的清除活性
从图3可以看出,在试验浓度范围内,随着浓度的增大,Vc对羟自由基的清除率上升较快,凤仙花各部位提取物对羟自由基的清除率有缓慢的升高。当浓度在0.1 mg/mL左右时,各提取物的清除能力均高于Vc;当浓度达到0.25 mg/mL时,凤仙花的叶提取物对羟自由基的清除率分别达到57.84%,基本与Vc(清除率为58.14%)相同;随着浓度继续升高,试验样品对羟自由基清除能力大小从高到低分别为:Vc>凤仙花的叶提取物>凤仙花的花提取物>凤仙花的茎提取物;当浓度达到1 mg/mL时,凤仙花的叶提取物对羟自由基清除率分别达到74.57%,具有较强的清除作用。
2.2.4 还原力测定
一种物质的还原能力可以在一定程度上反应它潜在的抗氧化活性,通过给自由基提供电子而自身得到一个质子,使自由基失活。通常来说,物质的还原力越强,就表示其抗氧化活性越强。还原力测定的实质就是检测待测样品能否成为好的电子供应者。本试验以普鲁士蓝的生成作为检测指标,待测样品将Fe3+/铁氰化物还原为Fe2+/铁氰化物,反应体系溶液变为不同程度的蓝色,其在700 nm处有特征光吸收,吸光度大小反应待测样品的抗氧化活性。
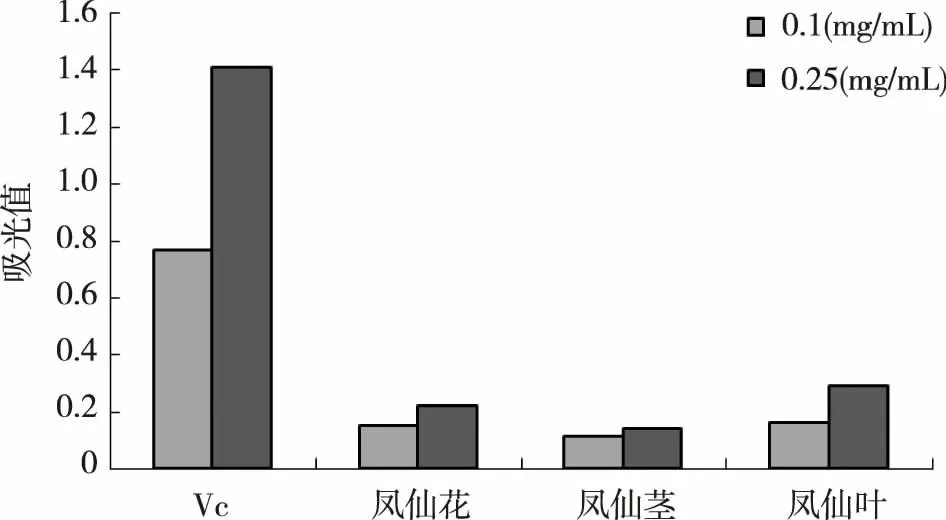
图4 凤仙花不同部位提取物还原力测定
由图4可以看出,在试验浓度范围内,试验样品还原力大小由高到低分别为:Vc >凤仙花的叶提取物>凤仙花的花提取物>凤仙花的茎提取物。Vc还原力随着浓度的增加而明显增大,在浓度为0.25 mg/mL时,其还原能力达到1.4;凤仙花各部位提取物的还原力与浓度存在量效关系,但还原能力一般,在浓度为1 mg/mL时,凤仙花的花、茎、叶提取物的还原力分别为0.536、0.315、0.787。
3 结 论
3.1 凤仙花的花、茎、叶三个部位均采用55%乙醇回流提取获得提取物,但提取率有所差异,其中凤仙花的花得率最高为33.32%,其次为凤仙花的叶,凤仙花茎的得率最低为22.40%;凤仙花各部位醇提取物中多酚的含量也有差异,凤仙花的叶的多酚含量最高为72.81 mg/g,其次为凤仙花的花66.07 mg/g,而凤仙花茎的多酚含量最低为37.07 mg/g,总黄酮的含量在花、茎、叶三个部位中为112.13~30.62 mg/g。
3.2 目前,没有一种普遍通用的方法就能较为准确地定量测定某样品的抗氧化能力,因此在评价某样品抗氧化活性时,通常采用几种不同的检测方法。本文采用了DPPH自由基清除能力测定、羟自由基清除能力测定、超氧阴离子清除能力测定和还原能力测定,以Vc为对照,结果表明,凤仙花各部位提取物均有不同程度的抗氧化活性,且抗氧化能力与浓度呈量效关系;综合各个检测方法,凤仙花的叶相比花和茎,具有较强的自由基清除活性和还原力,但仍低于对照组的Vc,且都有剂量依赖性,其次是凤仙花的花,而凤仙花的茎抗氧化活性最低。
3.3 样品的抗氧化活性与多酚、总黄酮含量之间存在一定的相关性。虽然未对其相关性作定量测定,但实验结果表明,总的来说凤仙花各部位的抗氧化活性与多酚、总黄酮含量有较为密切的关系,多酚及总黄酮含量越高的部位,其抗氧化活性也越强。
3.4 凤仙花提取物中成分复杂,但其中的多酚可能是主要抗氧化成分之一。通过本实验可知,凤仙花的各部位特别是凤仙花的叶,具有较好的综合抗氧化能力,可以作为新型天然抗氧化剂的原料来开发利用。
参考文献:
[1] 江苏新医学院.中药大辞典:上册[M].上海:上海科学技术出版社,1984:278-346.
[2] 鞠培俊,孔德云,李晓波.凤仙花化学成分及药理作用研究进展[J].沈阳药科大学学报,2007,24(5):320-324.
[3] Sakunphueak A, Panichayupakaranant P.Comparison of antimicrobial activities of naphthoquinones fromImpatiensbalsamina[J].Nat Prod Res, 2012, 26, 1119-1124.
[4] Oku H, Ishiguro K.Cyclooxygenase-2 inhibitory 1, 4-naphthoquinones from Impatiens balsamina L.[J].Biol Pharm Bull, 2002, 25, 658-660.
[5] Reanmongkol W, Subhadhirasakul S, Panichayupakaranant P, et al.Anti-allergic and anti-oxidative activities of some compounds from Thai medicinal plants [J].Pharm Biol,2003, 41,592-598.
[6] 胡喜兰,朱慧,刘存瑞,等.凤仙花的化学成分研究(分离鉴定了豆甾醇及山奈酚苷)[J].中成药,2003,25(10):833-834.
[7] 胡喜兰,韩照祥,刘玉芬,等.凤仙花提取物的抗氧化活性研究[J].食品科学,2007,28(2):48-50.
[8] Singleton V L,Rossi J R.Colorimetry of total phenolics with phosphomolybdicphosphotungstic acid[J].Am J Enol Vitic, 1965, 16, 144-158.
[9] Meda A, Lamien C E, Romito M, et al.Determination of the total phenolic, flavonoid and proline contents in Burkina Fasan honey, as well as their radical scavenging activity[J].Food Chem, 2005, 91, 571-577.
[10] 韦献雅,殷丽琴,钟成,等.DPPH 法评价抗氧化活性研究进展[J].食品科学,2014,35(9):317-322.
[11] Halliwell B, Gutteridge J M C, Aruoma O I.The deoxyribose method: A simple “test-tube” assay for determination of rate constants for reactions of hydroxyl radicals.Anal[J].Biochem, 1987,165, 215-219.
[12] 张晓璐,徐凯宏.山楂叶总黄酮清除DPPH和超氧阴离子自由基的研究[J].林业科技,2008,33(5):51-54.
[13] 李颖畅,孟宪军.蓝莓叶黄酮提取物抗氧化活性的研究[J].营养学报,2008,30(1):427-429.

