肉桂不同植物部位精油成分分析及抑菌活性研究
朱羽尧,钱 骅,张琪瑶,黄晓德,陈 斌,赵伯涛
(南京野生植物综合利用研究院, 江苏 南京 210042)
肉桂(Cinnamomumcassia),为樟科樟属植物,是重要的药用和食用材料,主要分布于我国广西、广东等地。肉桂主要含有肉桂油、油树脂、多糖、黄烷醇及其多聚体、倍单萜及其糖苷、二萜及其糖苷、无机离子等多种生理活性物质[1]。其中,肉桂油是指从干燥肉桂皮中提取得到的挥发油,为黄色澄清液体,其中主要成分为肉桂醛,另有苯甲醛、肉桂醇、邻甲氧基肉桂醛、香豆素等[2-4]。大量研究表明, 肉桂精油具有较强的抗菌活性, 不但可以有效抑制沙门氏菌、金黄色葡萄球菌等多种病原性微生物,而且对食品储藏过程中的霉腐微生物的生长起到抑制作用,从而达到防腐保鲜的目的[5-6]。目前,以肉桂、丁香等植物精油为基础而开发的天然绿色食品防腐保鲜剂得到了广泛关注,大力开发此类植物源防腐保鲜剂是控制化学防腐剂或抗生素滥用,解决食品安全问题的重要手段[7-8]。
目前对肉桂精油抑菌活性方面的研究多以桂皮为主要研究对象,对于其枝、叶、果等其他部位的研究相对较少,使得肉桂整体的资源利用度不高[9]。因此,本研究对肉桂不同植物部位所含精油进行提取,并采用气质联用(GC-MS)测定各部位精油的化学组成。并在此基础上,从抑菌圈、最低抑菌浓度和最低杀菌浓度这几方面对各部位精油的抑菌效果进行评价,为了解肉桂各部位精油的成分差异及抑菌活性强弱提供依据,从而为肉桂资源的可持续利用提供科学途径。
1 材料与方法
1.1 材料
桂皮、桂枝、桂叶、果实、花萼均于2014年3月采自广西省桂林市中国科学院广西植物研究所,经韦昆华副研究员鉴定为Cinnamomumcassia。采后晾晒24 h,装袋,4 ℃备用。
大肠杆菌(Escherichiacoli)、金黄色葡萄球菌(Staphylococcusaureus)由中国药科大学张剑教授提供。
1.2 仪器与试剂
Agilent 7820A气相色谱串联5975质谱检测仪,Agilent公司;DW-2型调温电热套,通州市张芝山镇决心化工电器厂;UTP-313千分之一电子天平,上海花潮电器有限公司;752紫外可见分光光度计,上海菁华科技仪器有限公司 752;BH2型显微镜,OLYMPUS公司;HZQ-F160振荡培养箱,太仓市华美生化仪器厂;LDZX-50KBS立式压力蒸汽灭菌器,上海申安医疗器械厂;紫外无菌操作台,苏州净化设备厂;圆底烧瓶、量筒等玻璃仪器。
高纯氦气(99.999%),南京上元工业气体厂;二甲苯,南京化学试剂有限公司;二甲基亚砜,中国医药公司北京公司;营养肉汤培养基,国药集团化学试剂有限公司;营养琼脂培养基,国药集团化学试剂有限公司。
1.3 方法
1.3.1 水分含量的测定
根据GB/T12729.6-2008(香辛料和调味品 水分含量的测定)中相关规定,采用二甲苯蒸馏法对各实验样品中的水分含量进行测定。水分含量的计算公式如下:
其中:W(%)—试样的水分含量,以质量分数表示(%);m—试样质量,g;V—接收器中水的体积,mL;ρ—水的密度,1 g/mL。
1.3.2 肉桂各部位精油的提取
根据GB/T 30385-2013(香辛料和调味品挥发油含量测定)中相关规定,采用水蒸气蒸馏法提取肉桂各部位的精油。分别称取一定量干燥桂皮、桂枝、桂叶、果实、花萼置于1 000 mL圆底烧瓶中,加入400 mL蒸馏水,在精油提取装置中水相液面滴加1 mL二甲苯,恒温蒸馏4 h后收集提取所得挥发油并保存,计算肉桂油得率并将各精油样品进行GC-MS分析。
其中:V0—测得的二甲苯体积,mL;V1—测得的二甲苯和挥发油的总体积,mL;M—试样质量,g;W(%)—试样水分百分含量。
1.3.3 GC-MS检测肉桂各部位精油化学成分组成
取1 μL精油直接进行GC/MS 分析,色谱、质谱条件[4]如下:
色谱柱:HP-5MS(30 m ×0.25 mm ×0.125 μm),载气为高纯氦气(99.999%)。进样口温度:250 ℃;程序升温:初始温度50 ℃,先以5 ℃/min升至200 ℃后,保持1 min,再以10 ℃/min升至260 ℃,保持1 min。各组分的相对含量采用峰面积归一化法进行定量。
电子轰击(EI)离子源;电子能量70 eV;接口温度:280 ℃,离子源温度230 ℃,四极杆温度150 ℃,质量扫描范围:33~600 m/z。获得的质谱数据通过NIST 11质谱图库进行检索。
1.3.4 抑菌圈测定
本实验采用滤纸片法[8]测定肉桂不同部位精油的抑菌圈。取6 mm圆形滤纸片若干,置于洁净干燥的培养皿内,干热灭菌后分别浸泡与各精油中。将配制好的107~108cfu/mL菌悬液震荡均匀,用无菌移液枪吸取0.15 mL于平板表面,并涂布均匀,制成含菌平板。将浸泡过精油的滤纸片贴在含菌平板中央,每组各做3个平行样,置于恒温培养箱中37 ℃下培养24 h。观察抑菌情况,并测量抑菌圈直径评价其抑菌效果。
1.3.5 最低抑菌浓度(MIC)和最低杀菌浓度(MBC)测定[10]
配置精油浓度1.6%,二甲基亚砜(DMSO)浓度为2.0%的营养肉汤培养基。取无菌试管9支,并采用空白营养肉汤培养基倍比稀释,制备含精油浓度分别为1.6%,0.8%,0.4%,0.2%,0.1%,0.05%,0.025%和0.0125%的营养肉汤培养基,同时以含2.0% DMSO的营养肉汤培养基作为空白对照。各检测试管中加入200 μL 微生物浓度为106~107 cfu/mL的对数期菌液,并置于37 ℃恒温培养箱中振荡培养。培养24 h后取出观察,未见明显微生物生长的最低精油浓度浓度即为该精油的MIC。确定了MIC后,将各试管中含精油的菌液采用空白培养基稀释100倍,放入培养箱于37 °C培养48 h,未能观察到微生物生长的最低精油浓度即为MBC。每组实验重复3次。
2 结果与讨论
2.1 肉桂不同部位中精油含量
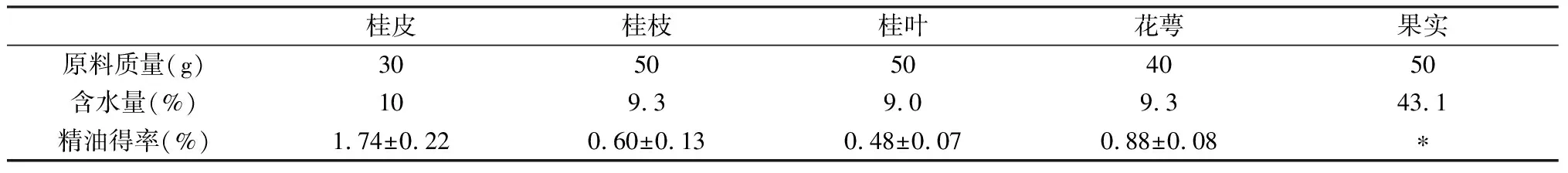
表1 肉桂不同部位精油的得率
由表1可知,肉桂的不同植物部位中,桂皮的精油含量(1.74%±0.22%),远高于其他部位。花萼其次,其精油含量为0.88%±0.08%,桂枝和桂叶相对较低,而果实中几乎不含精油。
2.2 肉桂不同部位精油化学成分组成分析
桂皮、桂枝、桂叶、花萼精油的总离子流图见图1~4。通过NIST 2011标准化合物质谱库进行匹配,并结合化合物的保留时间,对挥发油中的化学成分进行鉴定,并采用面积归一法计算其相对含量,结果见表2。
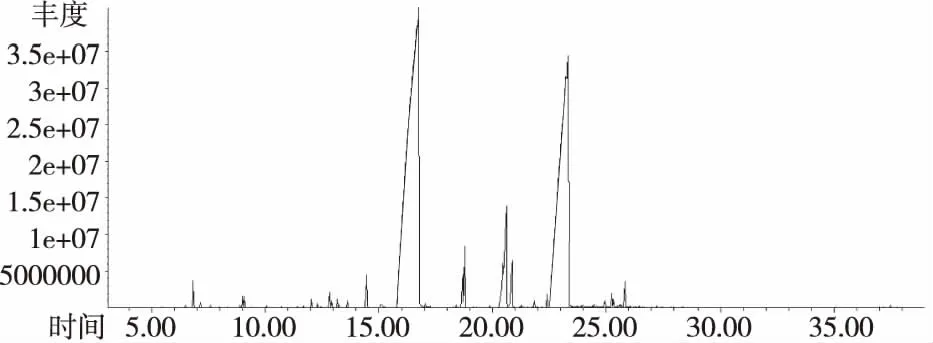
图1 桂皮精油的总离子流量图
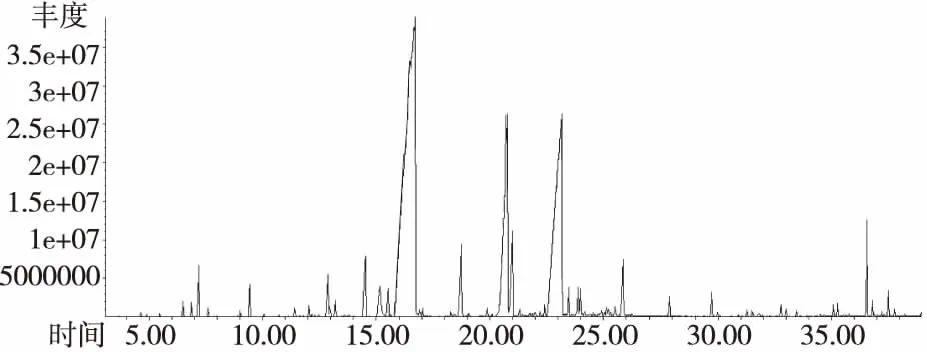
图2 桂叶精油的总离子流量图
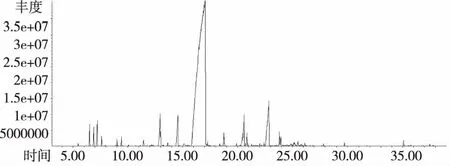
图3 桂枝精油的总离子流量图
图4 花萼精油的总离子流量图
由表2可知,从桂皮中共检测出了23个组分,鉴定了匹配度在80%以上的17种化合物,占总相对含量的96.47%,主要成分是反式肉桂醛(53.71%)、邻甲氧基肉桂醛(36.66%)占总相对含量的91.61%。从桂叶中检测出了31个组分,鉴定了匹配度在80%以上的25种化合物,占总相对含量的95.09%,主要成分是反式肉桂醛(51.85%)、邻甲氧基肉桂醛(22.69%)、1-苯基-2-硝基丙烯(10.24%),占总相对含量的86.40%。从桂枝中检测出了29个组分,鉴定了匹配度在80%以上的23种化合物,占总相对含量的98.22%,主要成分是反式肉桂醛(80.05%)、邻甲氧基肉桂醛(6.08%)、肉桂醛(2.13%),占总相对含量的88.26%。从桂叶中检测出了32个组分,鉴定了匹配度在80%以上的25种化合物,占总相对含量的99.43%,主要成分是反式肉桂醛(87.68%)、邻甲氧基肉桂醛(2.67%)、肉桂醛(2.35%),占总相对含量的92.7%。
从化学成分组成可以看出,桂皮与桂叶的化学组成与桂枝和花萼有明显区别,主要体现在其中邻甲氧基肉桂醛的含量。萼片中邻甲氧基肉桂醛的含量仅为2.67%,而在桂皮中含量为36.66%,超过前者10倍以上。桂叶中1-苯基-2-硝基丙烯的含量为10.24%,远高于其他三种部位。此外,通过结合精油得率以及肉桂醛的相对含量可以发现,四种植物部位中肉桂醛绝对含量分别为0.93%(桂皮)> 0.77%(花萼)> 0.48%(桂枝)> 0.25%(桂叶)。虽然桂皮中反式肉桂醛的绝对含量最高,但若以制备高品质反式肉桂醛的肉桂精油为目的,桂皮并不是最佳选择材料。首先其中邻甲氧基肉桂醛含量偏高,将影响产品的品质;其次,桂皮的采收对资源的可持续利用带来的负面影响远高于桂枝等材料部位;此外从产量的角度来看,桂皮的产量也远低于桂枝。因此,综合产品质量以及资源的可持续利用角度的分析,桂枝是大规模生产高品质肉桂精油的最佳材料。
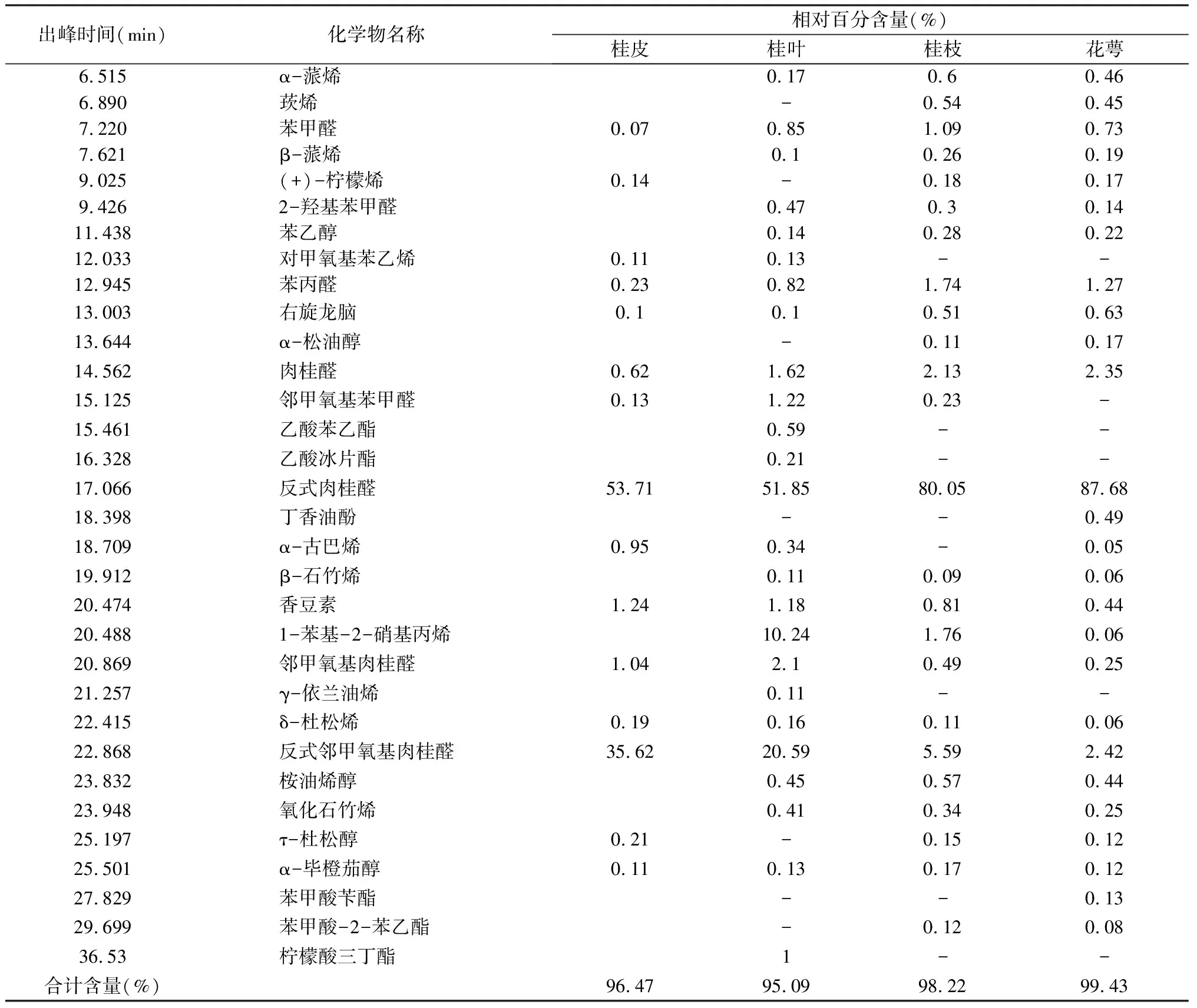
表2 肉桂各部位精油化学成分组成
2.3 抑菌圈法检测肉桂各部位精油对大肠杆菌和金黄色葡萄球菌抑菌效果

表3 肉桂各部位精油对大肠杆菌抑菌圈直径(mm)
精油抑菌圈实验结果的判定标准是:抑菌圈直径>20 mm 为极度敏感、15~20 mm 为高度敏感,10~15 mm 时为中度敏感,7~9 mm 时为低度敏感,<7 mm为不敏感[10]。
抑菌圈实验结果如表3所示,并参照以上标准进行评价后发现,肉桂各部位精油精油对大肠杆菌、金黄色葡萄球菌的抑菌圈直径均大于20 mm,属于极度敏感。大肠杆菌对桂皮、桂枝以及花萼精油极其敏感,抑菌圈直径均为30 mm左右。以金黄色葡萄球菌为研究对象发现,桂枝与花萼所提取的精油抑制效果最好,抑菌圈直径分别达到33.7 mm±1.2 mm和32.3 mm±1.5 mm。而桂皮精油的抑菌圈直径为26.3 mm±0.6 mm,虽然同样显示出显著抑菌活性,但相对于桂枝精油而言其抑菌效果仅为78.1%。
图5 桂枝精油对大肠杆菌(1)和金黄色葡萄球菌(2)的抑菌圈
2.4 肉桂精油对大肠杆菌和金黄色葡萄球菌的最低抑菌浓度(MIC)和最低杀菌浓度(MBC)
肉桂各植物部位精油均能在较低浓度范围内对大肠杆菌和金黄色葡萄球菌起到良好的抑制作用。桂皮、桂枝和花萼对于大肠杆菌的MIC为0.05%,花萼中提取的精油拥有最低的MBC为0.05%。对金黄色葡萄球菌而言,桂枝及花萼中提取所得精油的MIC和MBC均为0.025%,低于桂皮和桂叶。
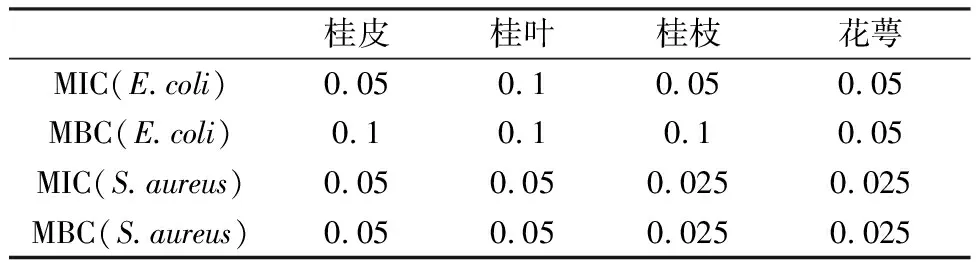
表4 肉桂各部位精油对E.coli和S.aureus的MIC和MBC(%)
结合反映肉桂精油抑菌效果的抑菌圈、MIC和MBC实验结果与各部位精油化学成分组成共同分析可以发现,抑菌效果的强弱与精油中肉桂醛的含量具有相关性。在肉桂醛含量上,桂皮和桂叶中明显低于桂枝和花萼;而相应的桂皮和桂叶的抑菌圈大小、MIC和MBC均弱于桂枝和花萼。
3 结 论
本研究对肉桂的桂皮、桂枝、桂叶、花萼以及果实这几个部位中精油的含量及化学组成进行检测分析,并进一步通过抑菌圈、MIC和MBC实验对各部位精油抑制大肠杆菌和金黄色葡萄球菌生长活性进行评价。结果表明,五种植物部位中,除果实外均富含精油,其中以桂皮中精油含量最高为1.74%。值得注意的是,各部位精油的化学组成存在显著差别。桂枝和花萼提取所得精油中,反式肉桂醛的含量达80%以上,而桂皮和桂叶中仅为50%左右。抑菌结果表明,这些成分组成上的差异与相应精油的抑菌活性存在直接相关性。反式肉桂醛含量较高的桂枝和花萼提取所得精油体现出的抑菌效果明显优于桂皮和桂叶提取所得精油。由此可见,反式肉桂醛是肉桂精油中发挥最主要抑菌活性的成分,其含量的高低与精油的抑菌效果直接相关。因此,若以生产制备高含量反式肉桂醛的肉桂精油为目的,相比之下桂枝由于其所含精油中反式肉桂醛含量高,并且综合考虑充足材料来源和资源的可持续利用,将成为最佳生产原料。
参考文献:
[1] 赵秀玲.肉桂生理活性成分的研究进展[J].中国调味品,2013,3(38): 5-13.
[2] 尹亮亮,刘子琛,李慧,等.不同产地肉桂及桂枝中有效成分量的分析[J].中草药,2007,38(7): 1094-1097.
[3] 唐裕芳,张妙玲,黄白飞.肉桂油的提取及其抑菌活性研究[J].天然产物研究与开发,2006,28(3): 432-434.
[4] 顾仁勇,傅伟昌,李佑稷,等.肉桂精油抑菌及抗氧化作用的研究[J].食品研究与开发,2008,29(10): 29-32.
[5] 赵 丹,孙 旸,陈 光.肉桂精油的抑菌作用[J].吉林农业大学学报,2013,35(4): 402-405.
[6] 李春美,杜靖,谢笔钧.柚皮提取物的抑菌作用[J].食品与发酵工业,2004,30(1): 38-41.
[7] 戴向荣,蒋立科,罗曼.肉桂醛抑制黄曲霉机理初探[J].食品科学,2008,1(29): 36-40.
[8] Hili P, Evans C S, Veness R G.Antimicrobial action of essential oils:the effect of dimethylsulphoxide on the activity of cinnamon oil [J].Letters in Applied Microbiology,1997,24 (4): 269-275.
[9] 刘红星,林森,黄初升,等.肉桂三个不同部位提取肉桂油的化学成分比较分析[J].中国调味品,2011,4(36):102-110.
[10] Diao Wenrui, Hu Qingping, Feng Saisai, et al.Chemical composition and antibacterial activity of the essential oil from green huajiao (Zanthoxylumschinifolium) against selected foodborne pathogens [J].Agric Food Chem, 2013, 61:6044-6049.

