红果参叶中总黄酮的提取工艺初步探讨
陈 雅,李 贵,吴帅玲,张永康,陈功锡,*
(1.吉首大学 生物资源与环境科学学院;2.植物资源保护与利用湖南省高校重点实验室,湖南 吉首 416000)
红果参系桔梗科(Campanulaceae)金钱豹属(Campanumoea)长叶轮钟草[Campanumoealancifolia(Roxb.) Merr.]的俗称,为湘西苗族传统药用植物,同时由于其叶常绿、花果美丽,又深受人们喜爱,因此可以做观赏植物。该植物为多年生,直立或蔓性草本,茎高可达3 m,肉质根胡萝卜状。《中华本草》记载其有“治疗劳倦气虚乏力、跌打损伤、肠绞痛”等效用。长期以来,湘西苗族人民以其肉质根代替人参作为大病初愈后的滋补品,常称其为“南方人参”。其果实称为“蜘蛛果”、“肉算盘”[1-2],美味可口,营养丰富,男女老少均喜食用。在春夏生长旺季及冬季,老百姓常采其嫩叶作为蔬菜炒食,不仅风味独特、美味可口,还有一定的保健功效。
黄酮类化合物在植物中广泛存在,并具有多种多样的生物活性。有研究表明黄酮类化合物具有防治神经性病变、延缓衰老[3]、加强DNA的保护[4]、治疗冠心病、抗癌和抗HIV病毒等功效[5]。同时在食品工业上,许多以黄酮类化合物为功能因子的保健食品被开发,如孙建华[6]研制的黄酮绿豆饮料,庞霞[7]研制的富含荷叶黄酮的黄酒,乌毡帽酒业有限公司[8]研制的含有竹叶黄酮的清爽型黄酒等。含有黄酮类物质的药物,保健品越来越受到人们的青睐,其社会需求量大,市场前景广阔,因此从植物中寻找黄酮资源越来越受到人们的重视。红果参全株是宝,果实中含有的化学成分主要有糖类、生物碱、黄酮类、酚类、蒽醌、甾体、三萜类、有机酸等[2],经实验初步测定红果参叶中含有黄酮,探究红果参叶总黄酮提取工艺,可为红果参的开发利用奠定理论基础,有助于其综合开发利用。
关于黄酮的提取方法多种多样,如热水提取法、酶解法、超滤法、超临界CO2萃取法等[9],各种提取方法各有特点。本实验采用乙醇超声法提取红果参叶中的总黄酮,相对传统的醇提取法而言,缩短了提取时间,提高了实验效率。
1 材料与方法
1.1 材料、仪器与试剂
1.1.1 材料
红果参叶于2011年12月采自湖南省海拔230 m的湘西吉首大学红果参试验基地。采样时,随机摘取红果参的幼叶。采后将叶子迅速洗净、凉干,于60 ℃下烘24 h、粉碎,装袋,密封贮存,备用。
1.1.2 仪器
UV-2550型紫外-可见分光光度仪,日本岛津公司;SHB-3循环水多用真空泵,西安禾普生物仪器有限公司;F2102型微型植物粉碎机,天津市泰斯特仪器有限责任公司;FA2104N型万分之一电子天平,上海精密科学仪器有限公司;DCTZ-2000型三频多用途恒温超声提取机,北京弘祥隆生物技术有限公司。
1.1.3 试剂
芦丁标准品,中国医药集团上海化学试剂公司;NaNO2、NaOH、Al(NO3)3、C2H5OH,所用试剂均为分析纯。
1.2 方法
1.2.1 芦丁标准溶液的配制
准确称取芦丁标准品10.6 mg,用体积分数30%的乙醇溶解,并完全移入50mL容量瓶中,用30%乙醇定容[10],配置成212 mg/L的芦丁溶液。
1.2.2 标准曲线的绘制
取7支试管依次加入质量分数为212 mg/L芦丁溶液0,1,2,3,4,5,6,7 mL,加蒸馏水补充至10 mL,往各试管中加入质量分数5%的NaNO21.5 mL,摇匀,放置6 min后加入质量分数10%的Al(NO3)31.5 mL,6 min后再加入质量分数4%的NaOH溶液20 mL,混匀,20 min后以第一管为空白参比,采用比色法在510 nm波长下测定吸光度[10]。以吸光度为横坐标,芦丁质量浓度为纵坐标,绘制标准曲线。
1.2.3 溶剂法提取及含量测定
精确称取1 g干样,在一定条件下用乙醇浸提超声后抽滤,滤液用30%的乙醇定容到50 mL容量瓶中;准确移取4.00 mL于50 mL容量瓶中,用水再次定容。准确移取5.00 mL于锥形瓶中加水5.00 mL,按照1.2.2中所述的方法测定样品中总黄酮提取得率(质量分数)。
黄酮提取得率计算公式:
1.2.4 提取条件优化
1.2.4.1 乙醇浓度的选择
称取干样,在固液比为1∶20,超声提取温度为35 ℃,功率为700 W,超声时间为10 min的条件下,分别用50%、60%、70%、80%、90%的乙醇进行试验,重复提取3次,计算得率。
1.2.4.2 料液比的选择
称取干样,料液比分别为1∶5、1∶10、1∶15、1∶20、1∶30(g/mL),于60%的乙醇溶液,在超声提取温度为35 ℃,功率为700 W条件下超声10 min,进行试验,重复提取3次,计算得率。
1.2.4.3 提取时间的选择
称取干样,在料液比1∶10、乙醇浓度为60%,在超声提取温度为35 ℃,功率为700 W的条件下分别超声5、10、15、20、30 min,进行试验,重复提取3次,计算得率。
1.3 多因素正交实验
为寻求最佳工艺提取条件组合,在单因素考察的基础上,选择乙醇浓度(A)、提取时间(B)、料液比(C)、三个因素为考察因素,每个因素选择3个水平,以总黄酮提取得率为指标,采用了L9(34)正交实验表安排实验,并确立因素水平表,见表1。
2 结果与分析
2.1 芦丁标准曲线
测得芦丁质量浓度Y(μg/mL)及对应的吸光度X,见图1所示。其标准曲线的回归方程为:Y=89.745X-0.019 6;相关系数R2=0.999 9,线性关系良好,可用作红果参叶中总黄酮提取得率的测定。

图1 芦丁标准曲线
2.2 提取条件与得率的关系
2.2.1 乙醇浓度对提取得率的影响
由图2可知,红果参叶中总黄酮在提取时出现两个乙醇浓度峰值,分别为80% 乙醇(5.37%)和50% 乙醇(5.26%);当乙醇浓度为90%时,黄酮提取得率最低为4.52%;其次为60%、70%,黄酮提取得率依次为4.98%、5.01%;实验结果表明:用80%乙醇提取,黄酮得率可达到最大;另外,50%乙醇作为提取溶剂可有效节约试剂。因此,超声提取的最适乙醇浓度为80%。
2.2.2 提取时间对黄酮提取得率的影响
由图3可知,随超声波处理时间的延长,总黄酮提取率先上升,而后又下降,造成这种现象的原因是在长时间超声作用下,提取率逐渐接近极限,提取物中杂质也随之增加,黄酮提取得率反而降低,由上表分析可知提取时间为10 min、15 min、20 min时黄酮的提取率较高,分别为4.88%、4.90%、4.93%其中提取时间20 min时黄酮提取得率最高。
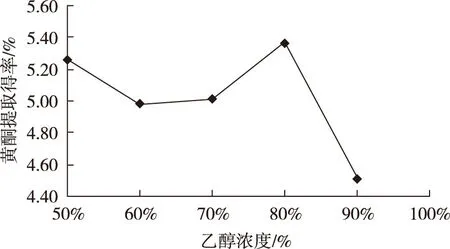
图2 乙醇浓度对提取率的影响

图3 提取时间对提取率的影响
2.2.3 料液比对提取得率的影响
不同的料液比会对目标成分的提取率产生影响,在一定范围内溶剂量越多越利于目标物浸出,但是过高的溶剂原料比会导致提取得率下降。本实验中在1∶10 到1∶20 的范围内提取得率随料液比增大而增大,在1∶20 到1∶25 的范围内提取得率随料液比增大而减小,在料液比1∶25之后提取得率又开始增大,在料液比为1∶30时黄酮提取得率达到最高值为5.48%,但从总体来看随料液比的增大,总黄酮提取得率增加。

图4 料液比对提取率的影响
2.3 正交实验结果
根据1.3的实验方案开展正交试验设计,所得结果如表2所示。

表2 正交实验设计及结果
在正交实验中,黄酮的提取得率由公式计算而来。通过分析得出红果参叶中黄酮类化合物最佳提取条件为85%的乙醇浓度、提取时间10 min、料液比1∶30。从表2可知:黄酮提取率的影响按大小次序排列分别为RC>RA>RB,即料液比>乙醇浓度>提取时间,初步确定从红果参叶中提取黄酮类物质的较佳方案为:A3B2C3,即最佳提取条件为85%的乙醇浓度、提取时间10 min、料液比1∶30。
2.4 验证性试验
按最佳提取条件85%的乙醇浓度、提取时间10 min、料液比1∶30进行验证试验,设计3组平行试验,取平均值,得最佳工艺下黄酮提取率为4.76%。
3 结 论
该实验初步探究了红果参叶中总黄酮的最佳提取工艺,确定了各因素对红果参叶中总黄酮提取率的影响顺序为C(料液比)>A(乙醇浓度)>B(提取时间) ;最佳提取工艺条件为 85%的乙醇、10 min的提取时间、1∶30的料液比。在此条件下,黄酮类化合物提取率可达4.76%。
从以上初步探究的结果来看,红果参叶中总黄酮含量较高,但是其分离纯化工艺、生理活性等探究工作有待进一步开展。为使红果参叶中的黄酮提取实现工业化生产,可进一步探索红果参叶中总黄酮提取参数,优化生产工艺,为其工业化生产奠定基础。
与桔梗科其他两种最重要的药用植物相比较,党参[11](根)的黄酮提取得率为2.5%,桔梗[12](根部)的黄酮提取得率为2.87%,二者黄酮提取得率都低于红果参的叶。此外,檀香叶[13]中总黄酮提取得率可达3.24%,黄皮[14]叶中的可达3.62%,紫苏[15]叶中的可达4.03%,银杏[16]中的可达5.14%,红果参叶中总黄酮的含量较紫苏、黄皮、檀香叶中的高,稍低于银杏叶。可见,红果参叶中的黄酮含量丰富,可能具有更高的开发利用价值。
参考文献:
[1] 李贵,张永康,陈功锡,等.湘西民族药用植物红果参果实营养成分初步分析[C]∥第十届全国药用植物及植物药学术研讨会论文摘要集,2011:113.
[2] 李贵,张永康,李辉,等.湘西民族药用植物红果参果实化学成分初步分析[C]∥第十届全国药用植物及植物药学术研讨会论文摘要集,2011:114.
[3] Jeremy P E S.Flavonoids and brain health: multiple effects underpinned by common echanisms[J]. Genes Nutr,2009(4):243-250.
[4] Jennifer D D.Flavone: The Molecular and Mechanistic Study of How a Simple Flavonoid Protects DNA from Oxidative Damage[J].East Tennessee State University, Department of Biochemistry and Molecular Biology,December 2003.
[5] 方从兵,宛晓春,江昌俊.黄酮类化合物生物合成的研究进展(综述)[J].安徽农业大学学报,2005(4):498-504.
[6] 孙建华.绿豆黄酮的碱法提取及黄酮绿豆饮料的制备方法[P].中国专利:CN101999667A,2011-04-06.
[7] 庞霞.一种含荷叶黄酮的特型黄酒的酿制方法[P].中国专利:CN201110164309.0,2011-6-20.
[8] 乌毡帽酒业有限公司.一种含有竹叶黄酮的清爽型黄酒的酿制方法及黄酒[P].中国专利:CN201110028369.X,2011-1-26.
[9] 龙海荣.菱角壳黄酮的提取、分离及抗氧化活性研究[D].广西:广西大学,2009:5-7,22.
[10] 李鹏,陶亮亮,丁敬敏,等.竹叶总黄酮提取工艺研究[J].食品工程,2011(5):151.
[11] 薛长晖.微波法提取党参黄酮的最佳提取工艺研究[J].粮油加工,2008(11):124-126.
[12] 唐生永,陈晓平.桔梗总黄酮的提取及纯化工艺研究[J].农产品加工(学刊),2010(3):20-22.
[13] 余文新,庄满贤,林励,等.正交设计优选檀香叶总黄酮提取工艺[J].食品工业科技,2012(8):284-286.
[14] 周燕芳.超声波法提取黄皮叶中黄酮工艺的优化[J].湖北农业科学,2012(7):1433-1435.
[15] 荣维燕,郭斌.超声波辅助提取紫苏叶总黄酮的工艺研究[J].安徽农业科学,2009(34):17070-17071.
[16] 倪林,叶明,杨必伟.微波-高压提取银杏叶黄酮工艺条件优化[J].安徽农业科学,2012(10):199-205.

