沙门氏菌快速检测显色培养基的研制
李 超,陈晓珑,李 莹,张晓峰,李文杰
(郑州大学 公共卫生学院,河南 郑州 450001)
0 引言
沙门氏菌(Salmonella)是主要的食源性致病菌之一,其引起的食物中毒病例位居首位[1].目前的检测方法由传统检测法发展到免疫组学、分子生物学和电化学等方法[2],但因上述方法操作繁琐且检验成本高,难于推广来满足食品生产销售过程中沙门氏菌的快速检测,因此快速显色培养基检测成为近年来的研究热点.其原理是利用微生物特异性酶的特点,通过对应的酶显色底物对目标微生物进行筛选鉴定[3].酶显色底物是由特异性酶识别基团以及相应的显色基团两部分组成,显色基团的主要成分是苯酚衍生物[4].本研究选择5溴-6 氯-3 吲哚-β-D 半乳糖苷(M-gal)作为沙门氏菌的显色底物[5],以普通营养培养基为底板,通过正交优化试验,确定沙门氏菌快速检测显色培养基(Rapid detection of Salmonella Chromogenic Medium,RSCM)配方.对照沙门氏菌国标检测法,分析RSCM 的出菌率、特异性和检出时间,综合评价RSCM 的检测性能,以期研制出一种应用于生产与销售等日常检测环节,易操作,检测结果迅速、准确,同时还具有较好的普及推广性的沙门氏菌快速检测培养基,为快速检测食品中沙门氏菌提供一定的科学理论基础.
1 材料和方法
1.1 菌株
以伤寒沙门氏菌(CMCC(B)50071)为试验菌株;以鲍氏志贺菌(CMCC(B)51336)、志贺菌I 型(CMCC(B)51105)、志贺菌II 型(CMCC(B)51582)、宋内志贺菌(CMCC(B)51592)、福氏志贺菌(CMCC(B)51573)、大肠杆菌(CMCC(B)44103)和大肠杆菌(ATCC25922)为对照菌株.以上菌株均由郑州大学基础医学院鉴定保存.
1.2 主要试剂和仪器
蛋白胨粉、酵母膏粉和L-胱氨酸:国药集团化学试剂有限公司;月桂基硫酸钠、5-溴-6-氯-3-吲哚-β-D 半乳糖苷:美国Genview 公司;亚硫酸铋(BS)琼脂、木糖赖氨酸脱氧胆盐(XLD)琼脂、四硫磺酸钠煌绿增菌液(TTB)和亚硒酸盐胱氨酸增菌液(SC):广东环凯微生物科技有限公司;氯化钠、磷酸氢二钠、磷酸二氢钾和无水碳酸钠:天津市凯通化工技术有限公司.
HVE-50 高压灭菌锅:日本HIRAYAMA 公司;AL204 电子分析天平:梅特勒托利仪器上海有限公司;GNP-9080 隔水式恒温培养箱和S-25 精密pH计:上海精宏实验设备有限公司;SW-CJ 超净工作台:苏州安泰空气技术有限公司.
1.3 RSCM 的制备
1.3.1 RSCM 基础培养基配方的正交优化
RSCM 基础培养基配方包括蛋白胨、酵母膏粉、氯化钠、月桂基硫酸钠、碳酸钠和L-胱氨酸[6].参照单因素试验结果,以其用量为因素,加入误差项后应用MINITAB15.1 进行7 因素3 水平正交试验[7],平行测定3 次,因素及水平见表1.

表1 因素与水平 g·L-1
1.3.2 RSCM 显色底物的剂量确定
以表1 筛选出的配方为基础,分别添加不同浓度的显色底物M-gal 并以伤寒沙门氏菌为对象进行单因素分析确定最佳剂量.
1.3.3 RSCM 的制备
使用分析天平准确称取各配方,加入去离子水,加热煮沸至溶解,冷却至60 ℃左右时注入无菌塑料平板内,彻底冷却凝固后形成RSCM.
1.4 RSCM 出菌率的测定
将活化后的伤寒沙门氏菌用无菌生理盐水进行10 倍梯度稀释,吸取各梯度菌液0.l mL 分别涂布于营养琼脂、RSCM 和国标BS、XLD 培养基平板上,每个平板重复3 次.于(36±1)℃分离培养18~24 h 后进行菌落计数并分别计算上述3 个培养基的出菌率[8],使用F 检验对出菌率结果进行分析.
1.5 RSCM 特异性的测定
用营养肉汤分别将伤寒沙门氏菌和7 种对照菌株于37 ℃培养24 h,然后分别接种在RSCM上,于(36±1)℃培养12~24 h 后观察各菌株在RSCM 上的生长状况.同时,以国标方法做特异性检验,以参照比对.
1.6 RSCM 检出时间的测定
分别将伤寒沙门氏菌和由试验菌株和7 种对照菌株形成的混合菌株涂布于RSCM、XLD 和BS培养基平板上,分别于6、12、18、24 和48 h 对3 个平板上的沙门氏菌进行菌落计数,确定检出时间.
1.7 数据处理
采用MINITAB15.1 对正交试验进行设计与分析,采用SPSS12.0 对试验结果进行统计学分析,统计量采用F 检验,检验水准为α=0.05.
2 结果与分析
2.1 RSCM 基础培养基试验
2.1.1 RSCM 基础培养基成分正交试验
基础培养基中各因素对菌落数的影响见表2.由表2 可知,6 种成分对菌落数的影响顺序为:月桂基硫酸钠>酵母膏粉>蛋白胨>碳酸钠>L-胱氨酸>氯化钠.最优方案为D2B2A2E2F3C2,即月桂基硫酸钠0.2 g/L,酵母膏粉3 g/L,蛋白胨25 g/L,碳酸钠0.02 g/L,L-胱氨酸0.04 g/L,氯化钠5 g/L.
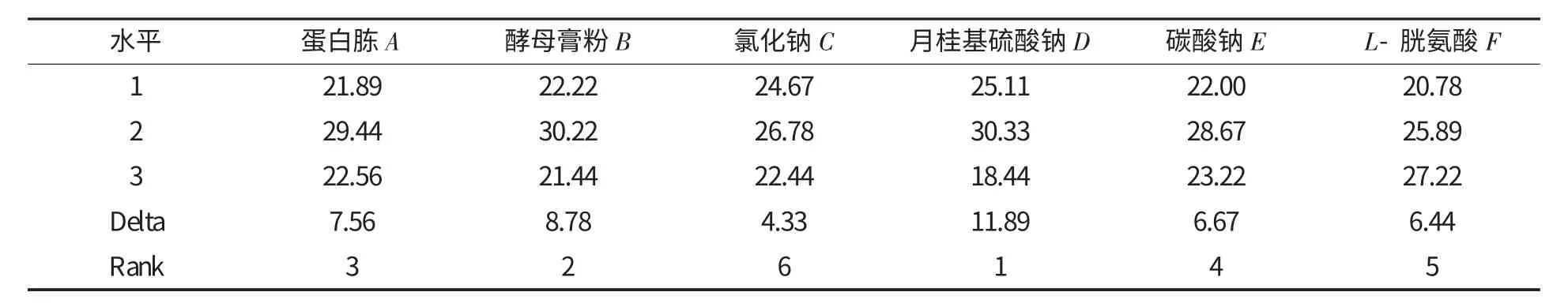
表2 基础培养基中各因素对菌落数的影响
2.1.2 RSCM 显色底物剂量的确定(表3)
由表3 可见,M-gal 各浓度间的菌落计数差异无统计学意义(F=0.169,P>0.05).但M-gal 浓度的改变对沙门氏菌的显色状况影响较大,并且随着时间的延长,显色效果稳定.当M-gal 浓度不低于0.60 g/L 时,RSCM 的显色效果较佳.从经济成本方面考虑,将RSCM 中的显色底物最终浓度设定为0.60 g/L.
表3 M-gal 浓度对菌落数的影响(lgCFU) (±s)

表3 M-gal 浓度对菌落数的影响(lgCFU) (±s)
注:各组间菌落计数对比,P>0.05,差异无统计学意义.
2.2 RSCM 的出菌率(表4)
由表4 可见,沙门氏菌在RSCM 以及国标方法中的XLD 和BS 培养基平板中的出菌率分别为90.7%、89.1%和87.6%.经F 检验,沙门氏菌在以上3 个平板上的菌落数差异无统计学意义(F=0.757,P>0.05).
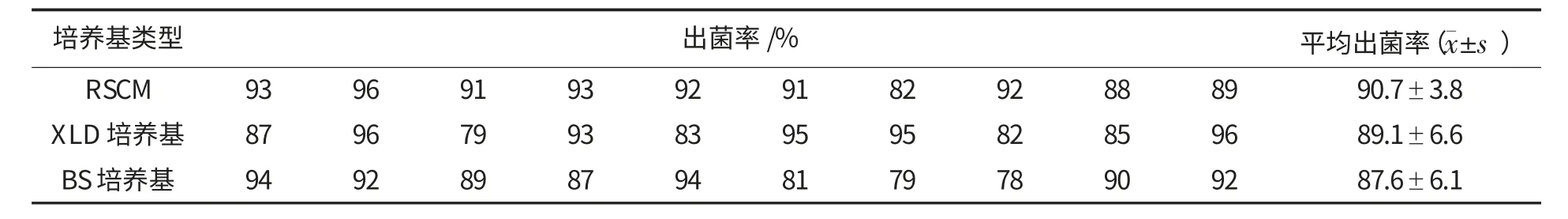
表4 沙门氏菌在不同培养基上的出菌率
2.3 RSCM 的特异性(表5)
由表5 可看出,对照菌株在RSCM 上不显色或无菌落出现,伤寒沙门氏菌在RSCM 和XLD、BS 培养基平板中的结果完全一致.
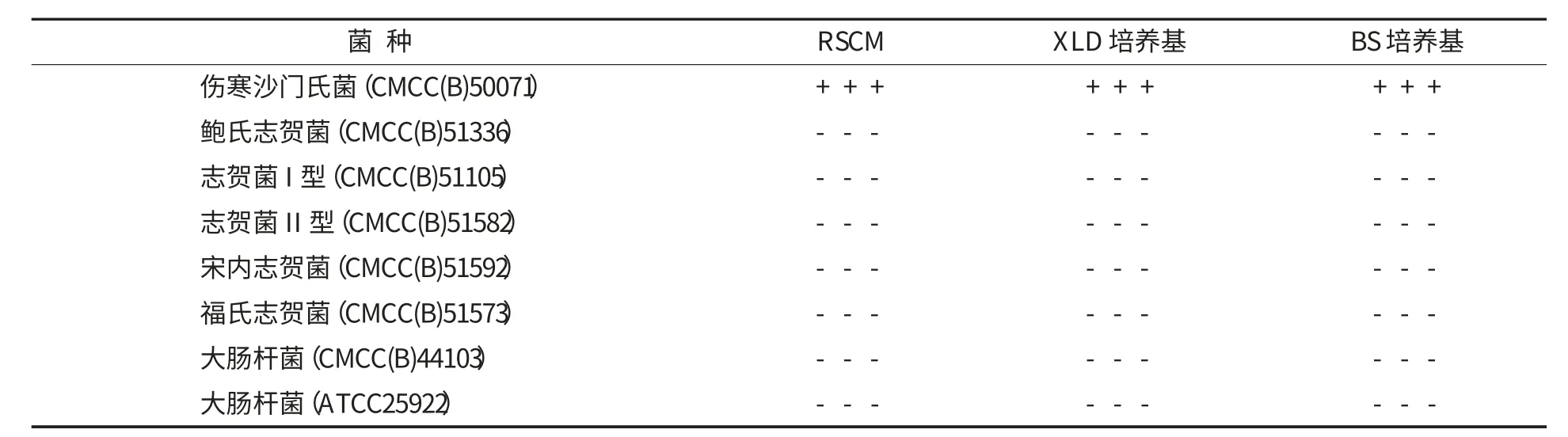
表5 RSCM 特异性检测结果
2.4 RSCM 的检出时间
分别观察伤寒沙门氏菌和混合菌株在RSCM、XLD 和BS 培养基平板上分别培养6、12、18、24、48 h 的生长状况,结果如表6 所示.RSCM 在12 h检测出的菌落数与XLD 培养基平板24 h 检测出的菌落数和BS 培养基平板48 h 检测出的菌落数差异无统计学意义(F=2.707,P>0.05;F=0.981,P>0.05).
表6 RSCM 与国标法培养基平板不同时间对沙门氏菌的检测结果 (±s)
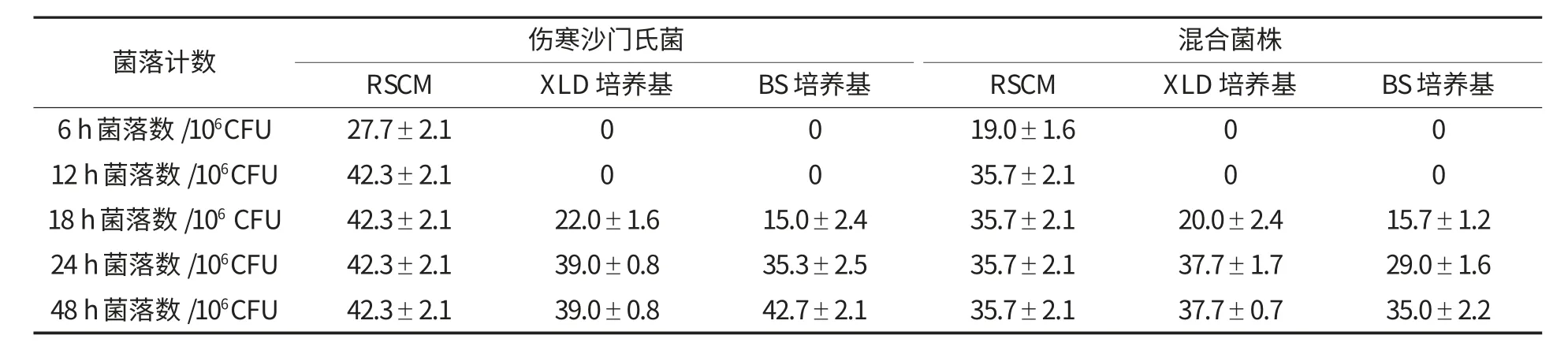
表6 RSCM 与国标法培养基平板不同时间对沙门氏菌的检测结果 (±s)
3 结论
利用营养琼脂培养基作为底板,添加6 种基础配方,并采用一种全新的酶显色底物M-gal,制备了RSCM 来检测沙门氏菌.该方法沿用显色培养基的原理,制作过程简单、操作简便.其中,Mgal 对于沙门氏菌的生长无任何作用,但其浓度对显色效果有很大影响.由于添加了M-gal,RSCM可根据菌落颜色鉴别沙门氏菌,结果易于观察,在(36±1)℃培养12 h 即可显色,且效果稳定.此外,通过对比RSCM 与国标法的出菌率、特异性和检出时间,发现RSCM 的各成分和浓度完全符合沙门氏菌生长的需要,能够提供充足的养分,并且检测结果可靠.因此,RSCM 在检测沙门氏菌方面具有良好性能,特别在检测时间方面具有很大优势,可满足快速检测的要求,可向卫生检验检疫部门、食品生产厂家以及各大销售厂商进行普及推广.
[1]Braden C R.Salmonella enterica serotype Enteritidis and eggs:a national epidemic in the United States[J].Clin Infect Dis,2006,43(4):512-517.
[2]孙园园,赵鹏,刘骏,等.沙门氏菌检测方法研究进展[J].中国畜牧兽医,2011,38(1):218-221.
[3]王福厚,霍贵成,王德国,等.食品中沙门氏菌检测方法的研究进展[J].中国乳品工业,2009,37(10):73-76.
[4]卢勉飞,吴清平,刘云林,等.特异性酶反应在食源性致病菌检测中的应用[J].中国卫生检验杂志,2005(3):354-356.
[5]Manafi M.New developments in chromogenic and fluorogenic culture media[J].Int J Food Microbiol,2000,60(2-3):205-218.
[6]叶宇鑫.沙门氏菌分子生物学快速检测方法研究[D].广州:华南理工大学,2011.
[7]冯鑫.Minitab 在正交设计优选中药提取工艺中的应用[J].安徽中医学院学报,2007(6):49-51.
[8]Hoi L,Dalsgaard I,Dalsgaard A.Improved isolation of Vibrio vulnificus from seawater and sediment with cellobiose -colistin agar [J].Appl Environ Microbiol,1998,64(5):1721-1724.

