1950MHz GSM-Talk信号对睾丸支持细胞增殖和分泌功能的影响
杜 乐 周 艳 林艳云 柏强善 张 彬 安广洲 苗 霞 丁桂荣 郭国祯(中国人民解放军第四军医大学军事预防医学院放射医学教研室 西安 7003)
2(中国人民解放军第四军医大学学员旅 西安 710032)
随着无线通讯事业的飞速发展和移动电话在全世界范围内的普及,射频辐射对人类健康的影响已经成为生物电磁学和环境医学研究的热点问题[1-3]。研究表明,睾丸是电磁辐射的敏感靶器官之一。一定参数的射频辐射可以引起睾丸结构和功能的损伤,造成性功能和生育能力下降[4]。
支持细胞(Sertoli 细胞)是位于生精上皮的壁细胞,该细胞位于管壁基底膜并延伸至曲细精管管腔,沿着支持细胞胞体,精原细胞发育至成熟精子的所有形态、生理变化过程都在此发生。作为与生精细胞接触的惟一体细胞,支持细胞在生精过程中发挥至关重要的调控作用[5]。其主要作用是在精子生成过程中,Sertoli细胞为精子发生提供物理支撑和稳定的微环境,并为精细胞提供营养和发育所需的细胞因子[6]。研究表明,支持细胞能分泌多种细胞因子,其中研究较多的是干细胞因子(SCF)和胶质细胞系来源的神经生长因子(GDNF)。据报道,SCF和GDNF能够促进精原干细胞的增殖与分化[7-11]。
本研究以建系的小鼠睾丸支持细胞(TM4)为实验对象,对其进行连续5 d的1950 MHz GSM信号辐照,探讨该条件下射频辐射对TM4细胞增殖和分泌功能的影响,为明确射频辐射对人类生殖健康的影响提供理论和实验依据。
1 材料与方法
1.1 材料
HERAcell 240i 细胞培养箱(Thermo),DMEM/F12 1:1(Thermo),胎牛血清(杭州四季青),T25细胞培养瓶(Nunc),96 孔细胞培养板(Nest),电热恒温水浴箱(上海医疗器械厂),CCK-8(碧云天),Model680 酶标仪(Bio-Rad),BrdU试剂盒(merk),兔抗小鼠Ki67抗体(Abcam),山羊抗兔荧光二抗(博士德),荧光倒置显微镜(Leica),ELISA试剂盒(Bio-Swamp),美国Bection Dickinson公司流式细胞仪(BD FACSAria),光学显微镜(Olympus),台式低温高速离心机(Zentrifugen),超净工作台(苏州净化设备公司)。
1.2 TM4细胞培养及传代
TM4细胞由第四军医大学病理生理学教研室的张远强教授惠赠。细胞于37 ℃、5% CO2孵箱中培养,培养液为DMEM/F12 1:1(含10%胎牛血清、100 μg·mL−1青霉素、100 μg·mL−1链霉素、2.50 mmol·L−1谷氨酰胺和15 mmol·L−1HEPES),每2 d换液一次。当细胞密度为80%−90%时,用胰酶消化传代。
1.3 射频电磁场辐照系统
辐照系统(sXc-1950 MHz)购自瑞士IT’IS公司,主要包括4部分:一个射频辐射发生器,一个专制的功能发生器,一个狭窄的带状放大器和两个矩形的波导腔。每个波导腔可放置6个细胞培养皿(直径35 mm),一个波导腔产生射频电磁场,用于细胞辐照;另一个波导腔不产生射频电磁场,用于细胞假辐照。通过计算机随机选择辐照组和假辐照组,并对整个细胞暴露系统进行比吸收率(0−4.0 W·kg−1)定量和全反馈控制。该系统以1950 MHz频率稳定运转。整个辐照过程中,细胞处于(37±0.1) ℃、5%CO2的环境中。辐照组和假辐照组温度差控制在0.1 ℃以内。
1.4 辐照程序
将TM4细胞制备成1.5×103个·mL−1的细胞悬液,接种于35 mm培养皿,每皿接种3 mL。细胞接种后24 h,更换新鲜培养液,并将其随机分为2组,分别置于辐照装置的两个小室中:一个小室产生GSM信号,用于细胞辐照;另一个小室不产生GSM信号,用于假辐照。辐照参数为:GSM-Talk信号,1950 MHz连续波,比吸收率为3 W·kg−1,辐照时间为5 d。
1.5 CCK-8检测细胞增殖情况
TM4细胞辐照结束后,细胞用 0.25%胰酶消化为单细胞悬液,离心(800 r·min−1, 5 min),收集细胞沉淀,用含10%血清的DMEM/F12 1:1 培养液重悬,制成单细胞悬液后进行细胞计数,将细胞密度调整至1×104个·mL−1。用移液器吸取100 μL稀释后的细胞悬液接种到96 孔板上,每组8个复孔,总共接种5块96孔板,分别检测细胞辐照后1−5 d的增殖情况。将接种后的96孔板置于37 ℃、5%CO2孵箱中,于培养24 h后,取一块96孔板,每孔加入10 μL CCK-8溶液,低速震荡10 min,37 ℃孵育4 h后,在酶标仪上,选择450 nm波长,测定各孔吸光度值(OD值)。后面4 d的加试剂时间,试剂量,测定方法同第1 d。计算每组OD值,算术平均数绘制折线图。
1.6 BrdU检测细胞增殖情况
按照BrdU试剂盒说明进行操作。根据CCK-8检测结果,选取辐照后1 d和3 d的细胞(辐照组和假辐照组)进一步检测细胞辐照后增殖情况,在辐照后1 d,每组取两个皿,0.25%胰酶消化为单细胞悬液,离心(800 r·min−1, 5 min),收集细胞沉淀,用含10%血清的DMEM/F12 1:1 培养液重悬,制成单细胞悬液后进行细胞计数,将细胞密度调整至1×105个·mL−1,每组接种100 μL于96孔板中,每组设3个样品复孔,1个空白对照和1个背景孔。空白对照孔只加100 μL培养液(不加细胞悬液),背景孔只加100 μL细胞悬液(不加BrdU标记物)。在每个样品孔中加20 μL BrdU工作贮存液。在孵箱中温育2−24 h。去除孔中内容物:将96孔板颠倒并用纸巾轻轻将残液除去。在每孔中加200 µL固定液。室温下温育30 min。去除孔中内容物:将96孔板颠倒,在纸巾上扣击板将残液除去。然后将板置于4 ℃条件下1周。用抗体稀释液将100×抗BrdU抗体稀释100倍,在每孔中加100 μL稀释后的溶液,室温下温育1 h。在每孔中加满1×洗剂液洗3次。在纸巾上轻轻去除残液。在每孔加 100 µL共轭稀释液,室温下温育30 min。洗剂同前。在所有板孔中加满dH2O,将96孔板颠倒,在纸巾上扣击板将残液除去。在每孔中加100 µL底物溶液,室温避光温育15 min。在每孔中加100 µL终止液,加样顺序同加底物顺序。用分光光度计在双波长450−540 nm(或450−595 nm)下测定每孔的吸光度(OD值)。每组OD值=样品孔的平均OD值−空白孔OD值−背景孔OD值。
1.7 免疫荧光检测细胞增殖标志物表达情况
辐照后,将细胞接种于12孔板内的无菌盖玻片上,接种量为800个细胞/孔,在辐照后第3 d,此时每孔的细胞量大约为50%−60%,用多聚甲醛室温固定30 min;PBS洗3次,每次5 min;0.15%TritonX-100室温透化10−15 min;PBS洗3次,每次5 min ;5%山羊血清室温封闭15−20 min;PBS洗3次,每次5 min ;加一抗:兔抗小鼠Ki67(用PBS稀释Ki67,稀释比为1: 50),放入湿玻璃皿中4 ℃孵育过夜。取出湿玻璃皿至常温复温0.5 h,PBS洗3次,每次5 min;常温、避光条件下孵育二抗:山羊抗兔488(用PBS稀释二抗,稀释比为1:500)1 h;PBS洗3次,每次5 min;常温避光条件下孵育DAPI(用PBS稀释DAPI,稀释比为1:20) 5 min;PBS洗2次,每次5 min;在荧光显微镜下观察和拍摄图片。
1.8 ELISA检测TM4细胞分泌因子表达情况
辐照结束后,收取1−5 d的细胞上清,检测TM4细胞辐照后1−5 d分泌SCF(或GDNF)的浓度。标准品的稀释:准备小试管6只,依次编好号码,先在各小试管中加入标准品稀释液100 µL,然后取原浓度标准品100 µL加入一只已编好号的试管中,充分混匀;再在该试管中取100 µL加入第二支试管中,充分混匀;再在该试管中取100 µL加入第三只试管中,充分混匀;再在该试管中取100 µL加入第四只试管中,充分混匀;再在该试管中取100 µL加入第五只试管中,充分混匀;然后在该试管中取100 µL,弃掉。第六只试管作为0号标准品。稀释后各管浓度分别为2400、1200、600、300、150 和0 pg·mL−1。在酶标包被板上设标准品孔,依次加入不同浓度标准品50 µL(每个浓度做2个复孔)。加样:分别设空白孔(空白对照孔不加样品、酶标试剂及生物素标记的抗SCF(或GDNF)抗体,其余各步操作相同)、待测样品孔。在酶标包被板上待测样品孔中先加样品40 µL,然后再加生物素标记的抗SCF(或GDNF)抗体10 µL。加样:将样品加于酶标板孔底部,尽量不触及孔壁,轻轻晃动混匀。温育:用封板膜封板后置37 ℃温育30 min。配液:将30倍浓缩洗涤液用蒸馏水30倍稀释后备用。洗涤:小心揭掉封板膜,弃去液体,甩干,每孔加满洗涤液,静置30 s后弃去,如此重复5次,拍干。加酶:每孔加入酶标试剂50 µL,空白孔除外。温育:操作同前。洗涤:操作同前。显色:每孔先加入显色剂A 50 µL,再加入显色剂B 50 µL,轻轻震荡混匀,37 ℃避光显色15 min。终止:每孔加终止液50 µL,终止反应(此时蓝色立转黄色)。测定:以空白孔调零,在450 nm波长处,依序测量各孔的吸光度(OD值)。 测定应在加终止液后15 min以内进行。根据标准曲线方程计算TM4细胞(样品孔)分泌SCF(或GDNF)的浓度。
1.9 统计学分析
实验数据采用SPSS17.0软件包分析,样本描述用±s表示,两组间样本均数比较采用独立样本t检验,p<0.05或p<0.01时认为差异有统计学意义。
2 结果
2.1 CCK-8检测GSM-Talk信号连续辐照5d对TM4细胞增殖的影响
与假辐照组相比,GSM-Talk信号连续辐照细胞5 d后, TM4细胞增殖在辐照后2−5 d受到明显抑制,具体见图1。
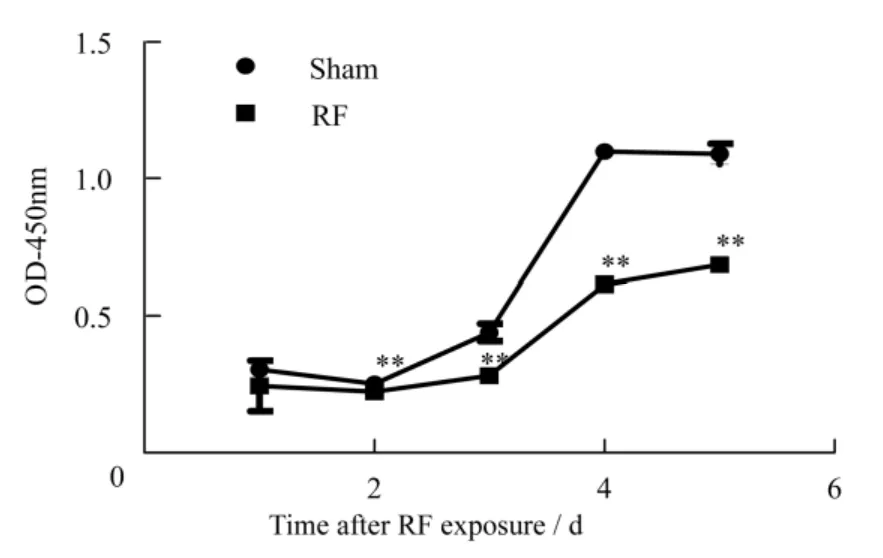
图1 辐照后不同时间TM4细胞增殖情况**, p<0.01, 与假辐照组相比Fig.1 TM4 cell proliferation at different time points after radiation(**, p<0.01, vs.control group)
2.2 BrdU检测GSM-Talk信号连续辐照5d对TM4细胞增殖的影响
BrdU检测结果表明,TM4细胞连续暴露于GSM-Talk信号5 d后,细胞增殖受到抑制,辐照后3 d两组比较有统计学差异(p<0.05),见图2。
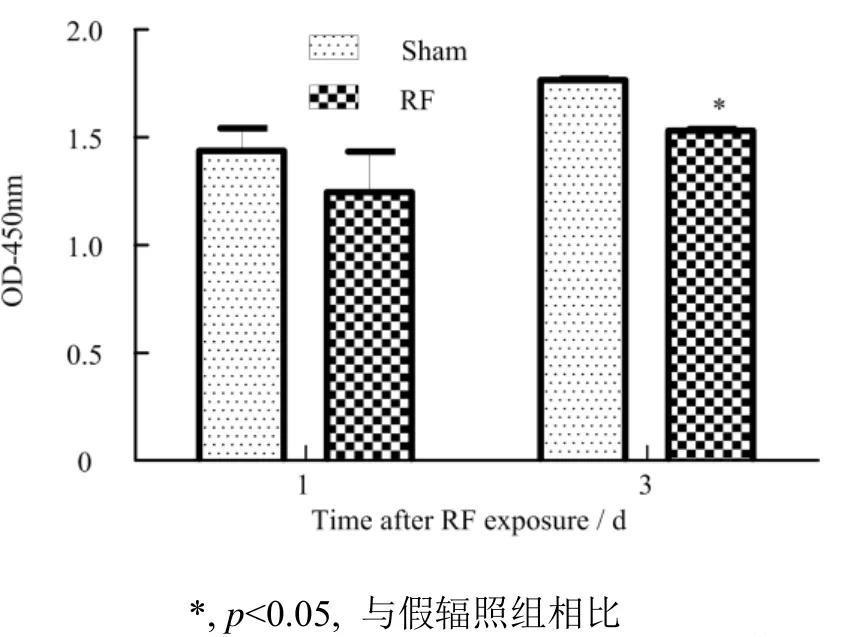
图2 辐照后第1 天和第3 天TM4细胞增殖情况Fig.2 TM4 cell proliferation at 1 d and 3 d after radiation
2.3 GSM-Talk信号连续辐照5d对TM4细胞增殖标志物Ki67表达的影响
射频辐照后第3 d,免疫荧光结果显示,辐照组TM4细胞增殖标志物Ki67的表达较对照组减弱,见图3和图4。
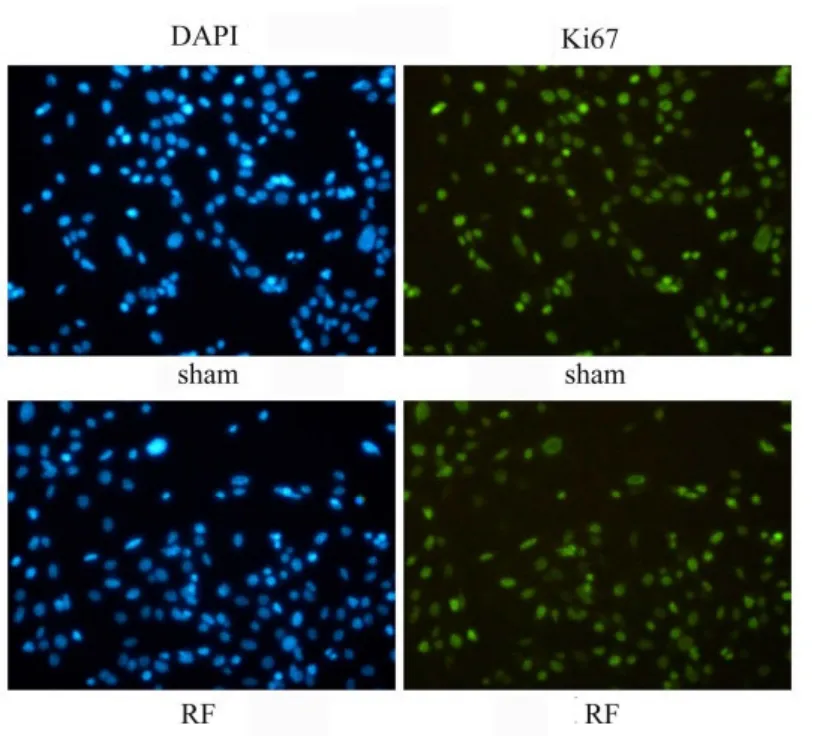
图3 辐照后第3 d TM4细胞Ki67免疫荧光染色结果 (×200)Fig.3 Ki67 immunofluorescence staining results at 3 d after TM4 cell radiation (×200)
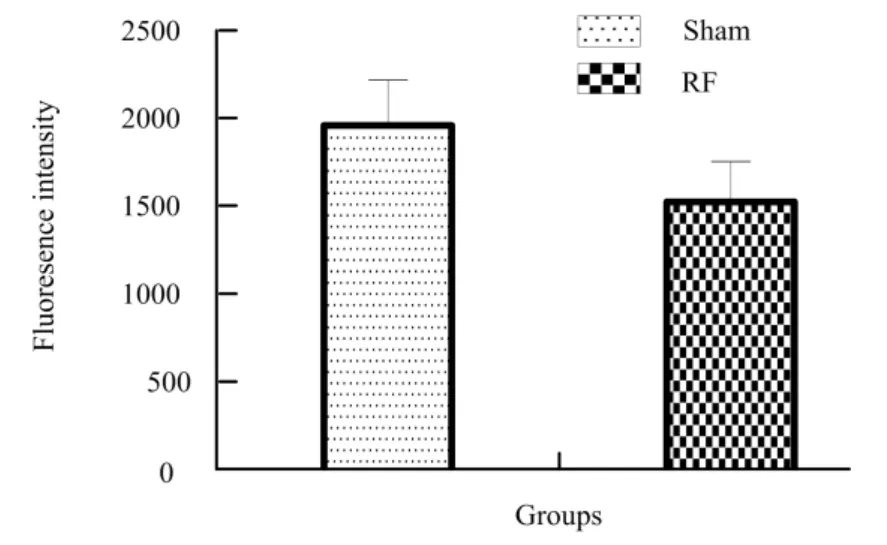
图4 辐照后第3 天TM4细胞Ki67荧光强度结果Fig.4 Ki67 fluorescence intensity results at 3 d after TM4 cell radiation
2.4 GSM-Talk信号连续辐照5d后TM4细胞上清中细胞因子水平变化
TM4细胞辐照后2−5 d,细胞上清中SCF浓度明显低于假辐照组,有统计学差异(p<0.05),辐照后第1 d和第3 d,辐照组细胞上清中GDNF的浓度明显高于假辐照组,有统计学差异(p<0.05),见图5和图6, 提示该条件下的射频辐射可影响TM4细胞的分泌功能。
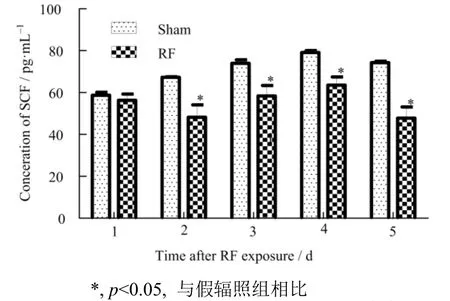
图5 辐照后不同时间TM4细胞上清中SCF浓度变化Fig.5 The concentration of SCF in TM4 cell supernatant at different time points after radiation
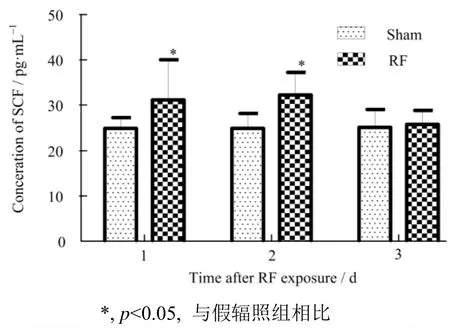
图6 辐照后不同时间TM4细胞上清中GDNF浓度变化Fig.6 The concentration of GDNF in TM4 cell supernatant at different time points after radiation
3 讨论
睾丸支持细胞是生精上皮的支持结构,贯穿生精上皮的全层。研究表明,支持细胞在精子发生中发挥着重要作用。据报道,一定参数的射频电磁辐射能够影响睾丸支持细胞的增殖和细胞结构等。高晓芳等[12]将体外培养的睾丸支持细胞暴露于功率密度分别为0、30和100 mW·cm−2的微波辐射中各5 min,结果显示,辐照后支持细胞生长出现抑制,表现为G0-G1期细胞数量增加,G2-M和S期细胞数量减少,凋亡和死亡细胞增加,细胞内Ca2+浓度增加。作者认为细胞内Ca2+浓度的增加是微波诱导支持细胞损伤的机制之一。吴惠等[13]为探讨不同波段电磁辐射对大鼠睾丸支持细胞损伤效应的异同,将原代培养的Sertoli细胞经场强 6×104V·m−1的电磁脉冲(Electromagnetic pulse, EMP),平均功率密度为100 mW·cm−2的S-波段高功率微波(S-band high power microwave, S-HPM)和X-波段高功率微波辐射( X-band high power microwave, X-HPM),结果显示,3种波段电磁辐射后,Sertoli细胞的晚期凋亡和坏死率增加;细胞代谢活性降低,且超宽谱波段的EMP致Sertoli细胞的损伤最明显。我们的实验结果显示,1950 MHz GSM-Talk信号连续辐照TM4细胞5 d后, TM4细胞增殖受到明显抑制,CCK-8、BrdU和Ki67免疫荧光检测结果均证实了这一现象,该结果与高晓芳等的报道结果一致。此外,还有学者研究了射频辐射对睾丸组织超微结构的影响。Serkan Çelik等[14]将雄性Wistar-Kyoto大鼠暴露于SAR为1.58 W·kg−1的手机辐射中3个月后,透射显微镜下观察睾丸的超微结构,发现辐照组睾丸支持细胞胞浆有空泡和高电子密度结构形成以及大量脂滴存在,提示手机辐射可能引起支持细胞超微结构的改变。吴惠等[13]研究表明三种不同波段的电磁辐射可致原代培养的大鼠睾丸支持细胞胞浆颗粒增多且空泡变性;超微结构主要为线粒体肿胀、空化,内质网扩张。本科室前期研究表明[15]2450 MHz微波局部照射BALB/c小鼠睾丸后,各级生精细胞出现以浊肿为主的病理学改变,支持细胞病变的特异表现为萎缩变性,出现细胞体积明显缩小,如突起回缩,由直立位变为横卧位,或成为紧靠基膜的薄层部分,染色加深。
研究表明,射频辐射除对睾丸支持细胞的增殖和细胞结构造成影响外,还可导致细胞(包括睾丸支持细胞)分泌功能的改变[16-18]。支持细胞是唯一与生精细胞接触的体细胞,在精子发生过程中,支持细胞可分泌多种细胞因子,调节精原干细胞自我更新和分化,精母细胞减数分裂以及圆形精子细胞转化为精子[19]。其中研究较多的细胞因子是SCF和GDNF。SCF又称c-kit配体,肥大细胞生长因子(MGF)。研究表明,SCF能够促进小鼠精原细胞分化为圆形精子细胞[20],而且可诱导小鼠A1-A4型精原细胞的增殖和分化[21]。GDNF是转化生长因子β超家族的一个相关成员。它的信号转导受体复合物包括酪氨酸激酶 Ret 受体和 GDNF 家族受体α1。据报道,GDNF可促进未分化型精原细胞(包括精原干细胞)的增殖[22-23]。本实验,我们对射频辐照后支持细胞上清中的SCF和GDNF水平进行了检测,结果显示,1950 MHz GSM-Talk信号连续辐照5 d后的第2 d到第5 d,细胞上清中SCF浓度明显降低,辐照后第1 d和第3 d,细胞上清中GDNF浓度显著增加。除探讨电磁辐射引起Sertoli细胞形态结构,增殖和分泌功能改变外,电磁辐射致Sertoli细胞的损伤会对精子发生产生何种影响呢?研究表明[24],Sertoli细胞经γ射线照射后,细胞因子IL6的表达增强。Wu等[16]将睾丸支持细胞进行微波辐照后,发现其分泌因子:肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)和白细胞介素-6(IL-6)增加,这些上调的分泌因子能够诱导生殖细胞的凋亡和生殖细胞膜的脂质过氧化。作者推测,射频辐照后SCF和GDNF这两种细胞因子水平的改变也将对精子的正常发生产生影响。
截止目前,关于射频辐射对睾丸支持细胞分泌因子GDNF、SCF表达的影响研究尚未见报道,仅检索到一些关于电离辐射对睾丸支持细胞分泌功能影响的研究文献。Mauduit等[25]报道,成年雄性小鼠接受X线(4 Gy)照射72 h后,支持细胞中SCF的表达未见明显改变。Albuquerque等[26]将成年雄性小鼠用6 Gy γ60Co射线照射,发现辐照后支持细胞数量、结构及分泌SCF和GDNF的能力没有改变。提示,不同性质的物理因子对睾丸支持细胞分泌功能的影响也存在差异。其主要原因可能与各研究机构之间使用的射频辐射源的种类,实验条件及实验动物的不同有关。
本研究首次报道了1950 MHz GSM-Talk信号对睾丸支持细胞增殖及分泌功能的影响,结果提示,1950 MHz GSM-Talk信号连续辐照5 d可抑制TM4细胞的增殖并影响其分泌功能。睾丸支持细胞对精子正常发生起着至关重要的作用,射频辐射致睾丸支持细胞的效应可能影响精子的正常发生,最终导致生殖功能异常。本研究为正确评估手机射频辐射对生殖健康的影响及卫生防护提供了理论和实验依据。关于射频辐射影响支持细胞增殖及分泌功能的分子机制,有待进一步研究。
1 Merhi Z O.Challenging cell phone impact on reproduction: a review [J].Journal of Assisted Reproduction and Genetics, 2012, 29(4): 293-297.
2 孟谦谦, 童建.射频辐射对健康影响的流行病学调查[J].辐射防护通讯, 2007, 27(5): 15-19.MENG Qianqian, TONG Jian.Epidemiologic investigation on the health effects of radiofrequency radiation [J].Radiation Protection Bulletin, 2007, 27(5):15-19.
3 谢亮, 姜槐, 许正平.移动电话射频辐射的生物学效应和暴露限值 [J].中华劳动卫生职业病杂志, 2007,25(4): 247-249.XIE Liang, JIANG Huai, XU Zhengping.The biological effects and exposure limits of Mobile phone radiofrequency radiation [J].The Chinese labor health occupational disease, 2007, 25(4): 247-249.
4 Kesari K K, Kumar S, Nirala J,et al.Biophysical evaluation of radiofrequency electromagnetic field effects on male reproductive pattern [J].Cell Biochemistry and Biophysics, 2013, 65(2): 85-96.
5 Kaur G, Thompson L A, Dufour J M.Sertoli cells-Immunological sentinels of spermatogenesis [J].Seminars in Cell and Developmental Biology, 2014, 30:36-44.
6 Lee N P, Cheng C Y.Adaptors, junction dynamics, and spermatogenesis [J].Biology of Reproduction, 2004,71(2): 392-404.
7 郭雪华, 蔺勇, 王晔玲, 等.生长因子对人精原干细胞体外存活和增殖的影响 [J].中华男科学杂志, 2008,14(10): 876-878.GUO X H, LIN Y, WANG Y L,et al.Growth factors promote the survival and proliferation of human spermatogonium stem cellsin vitro[J].Zhonghua Nan Ke Xue(in China), 2008, 14(10): 876-878.
8 Wang P, Suo L J, Wang Y F,et al.Effects of GDNF and LIF on mouse spermatogonial stem cells proliferationin vitro[J].Cytotechnology(in China), 2014, 66(2): 309-316.
9 毕聪明, 王珅, 周铁忠, 等.GDNF和SCF促进小鼠精原干细胞增殖与分化的研究 [J].辽宁医学院学报,2009, 30(3): 193-195.BI Congming, WANG Shen, ZHOU Tiezhong,et al.Study on proliferation and diferentiation of spermatogonial stem cells in mouse promoted by GDNF and SCF [J].J Liaoning Medical University, 2009, 30(3):193-195.
10 Huleihel M, Fadlon E, Abuelhija A,et al.Glial cell line-derived neurotrophic factor (GDNF) induced migration of spermatogonial cells in vitro via MEK and NF-kB pathways [J].Differentiation, 2013, 86(1-2):38-47.
11 尹明, 李德雪.体外培养条件下SCF、LIF与bFGF对昆明白小鼠精原干细胞增殖的影响 [J].生物工程学报,2002, 18(6): 754-757.YIN Ming, LI De-Xue.Effects of SCF, LIF and bFGF on Mouse Spermatogonial Stem Cells Proliferationin vitro[J].Chinese Journal of biotechnology, 2002, 18(6):754-757.
12 高晓芳, 王水明, 彭瑞云, 等.微波辐射对原代培养睾丸支持细胞的影响 [J].中华劳动卫生职业病杂志,2009, 27(9): 530-533.Gao X F, Wang S M, Peng R Y,et al.Effect of microwave radiation on primary cultured Sertoli cells [J].Chinese Journal of Industrial Hygiene and Occupational Diseases,2009, 27(9): 530-533.
13 吴惠, 王德文, 王水明.不同波段电磁辐射致大鼠睾丸支持细胞的损伤效应 [J].生物物理学报, 2011, 27(1):38-46.WU Hui, WANG Dewen, WANG Shuiming.The damaging effects of different bands electromagnetic radiation on the rat Sertoli cells [J].Acta Biophysica Sinica, 2011, 27(1): 38-46.
14 Celik S, Aridogan I A, Izol V,et al.An evaluation of the effects of long-term cell phone use on the testes via light and electron microscope analysis [J].Urology, 2012,79(2): 346-350.
15 郭国祯, 郭鹤.微波局部照射小鼠睾丸对睾丸, 附睾及精子的形态学影响 [J].生物医学工程学杂志, 1994,11(4): 286-290.GUO Guozhen, GUO Yao.Morphological changes in testis, epididymis and sperm of mice after exposure to microwave radiation [J].Journal of Biomedical Engineering, 1994, 11(4): 286-290.
16 Wu H, Wang D, Shu Z,et al.Cytokines produced by microwave-radiated Sertoli cells interfere with spermatogenesis in rat testis [J].Andrologia(in China),2012, 44(Suppl 1): 590-599.
17 Makar V R, Logani M K, Bhanushali A,et al.Effect of cyclophosphamide and 61.22 GHz millimeter waves on T-cell, B-cell, and macrophage functions [J].Bioelectromagnetics, 2006, 27(6): 458-466.
18 Makar V R, Logani M K, Bhanushali A,et al.Effect of millimeter waves on natural killer cell activation [J].Bioelectromagnetics, 2005, 26(1): 10-19.
19 Derooij D G.The spermatogonial stem cell niche [J].Microscopy Research and Technique, 2009, 72(8):580-585.
20 Feng L X, Ravindranath N, Dym M.Stem cell factor/c-kit up-regulates cyclin D3 and promotes cell cycle progression via the phosphoinositide 3-kinase/p70 S6 kinase pathway in spermatogonia [J].Journal of Biological Chemistry, 2000, 275(33): 25572-25576.
21 Tajima Y, Sawada K, Morimoto T,et al.Switching of mouse spermatogonial proliferation from the c-kit receptor-independent type to the receptor-dependent type during differentiation [J].Journal of Reproduciton and Fertility, 1994, 102(1): 117-122.
22 Meng X, Lindahl M, Hyvonen M E,et al.Regulation of cell fate decision of undifferentiated spermatogonia by GDNF [J].Science, 2000, 287(5457): 1489-1493.
23 胡建新, 孙兆林, 何坚.胶质细胞源性神经营养因子对体外培养小鼠精原干细胞增殖分化作用的影响 [J].中华泌尿外科杂志, 2010, 31(4): 227-230.HU Jianxin, SUN Zhaolin, HE Jian.Effect of glial cell line-derived neurotrophic factor on mouse spermatogonial stem cellsin vitro[J].Chinese Journal of Urology, 2010,31(4): 227-230.
24 Brouazin-Jousseaume V, Guitton N, Legue F,et al.GSH level and IL-6 production increased in Sertoli cells and astrocytes after gamma irradiation [J].Anticancer Research, 2002, 22(1A): 257-262.
25 Mauduit C, Siah A, Foch M,et al.Differential expression of growth factors in irradiated mouse testes [J].International Journal of Radiation Oncology, Biology,Physics, 2001, 50(1): 203-212.
26 Albuquerque A V, Almeida F R, Weng C C,et al.Spermatogonial behavior in rats during radiation-induced arrest and recovery after hormone suppression [J].Reproduction, 2013, 146(4): 363-376.

