LIG4和HSPB1基因多态性与非小细胞肺癌放疗肿瘤退缩率的相关性
刘 丹 郭根燕 赵玉霞 白 露(中国医科大学附属第四医院肿瘤放射治疗科 沈阳 003)
2(中国医科大学附属第一医院肿瘤放射治疗科 沈阳 110001)
肺癌的发病率呈逐年上升趋势,已经成为全球发病率和死亡率最高的恶性肿瘤[1]。临床工作中发现肺癌患者放疗后肿瘤退缩程度明显不同,主要原因在于肺癌的放射敏感性存在很大的个体差异。DNA是电离辐射的主要靶点,DNA损伤修复能力的强弱是影响放射敏感性的重要因素,与DNA修复功能相关的基因突变、多态性及表观修饰均可使放射敏感性出现差异[2]。电离辐射引起的DNA损伤的修复主要由DNA双链断裂修复通路参与[3]。研究发现 LIG4(DNA连接酶4)是DNA双链断裂修复通路中一个重要的修复因子[4-5]。热休克蛋白B1(Heat shock protein B1, HSPB1)是热休克蛋白(Heat shock proteins, HSPs)家族中27×103的小分子热休克蛋白,在DNA修复方面起着重要的作用[6]。本研究拟探讨HSPB1及LIG4基因单核苷酸多态性与非小细胞肺癌放疗肿瘤退缩率的相关性。
1 材料与方法
1.1 病例与材料
本研究所有对象为北方地区汉族人群,患者之间彼此均无血缘关系。在签署知情同意书后,提供外周血标本,同时完成流行病学调查。病例来自2009年12月至2011年12月期间,中国医科大学附属第一医院的137名原发性非小细胞肺癌(Non-small-cell lung cancer, NSCLC)患者,有明确的病理诊断(鳞癌87例,腺癌50例),所有患者行胸部病灶三维适形放射治疗(Three-dimensional conformal radiotherapy, 3D-CRT)且具有肺内可评估病灶者,放疗前及放疗20次后测量肿瘤大小。
红细胞裂解液(3.85 g NH4Cl+0.42 g NaHCO3加双蒸水至500 mL);核悬浮液(75 mmol·L−1NaCl、24 mmol·L−1pH=8.0, EDTA);TE 缓 冲 液(10 mmol·L−1pH=7.5 Tris-HCI、1 mmol·L−1pH=8.0 EDTA );PCR Taqman 探针及引物(美国应用生物系统公司);Taqman Master Mix(美国应用生物系统公司);Eppendorf BioPhotometer核酸蛋白测定仪(德国Eppendoff公司);低温离心机(德国Sigma公司);移液器(法国Gilson公司);96孔板及盖膜(美国应用生物系统公司);ABI 7500荧光定量PCR仪(美国应用生物系统公司)。
1.2 调查方法
采用统一制定打印的调查表,由2名培训的调查员对病例进行流行病学调查,调查内容包括每个研究对象详细的人口学资料、吸烟史、组织类型、临床表现和伴发疾病等。非吸烟者指终生吸烟少于100支的个体。所有参与研究的个体外周血标本采集使用枸橼酸钠抗凝试管,每人采血2 mL,在−20 ℃到−80 ℃的冰箱中冻存。肿瘤放射治疗方案采用三维适形治疗,放疗单次剂量2 Gy,5次/周,总剂量(Total dose,DT)达到40 Gy/20次/4周后重新CT定位,观察肿瘤消退情况,重新制定放疗计划,单次剂量改为2.5 Gy,5次/周,共8次,使肿瘤DT达到60 Gy。肿瘤体积用放射治疗计划系统计算,放疗前肿瘤体积(Vpre),放疗40 Gy后的肿瘤体积(Vmid)。用下面的公式计算肿瘤体积退缩率(R)。
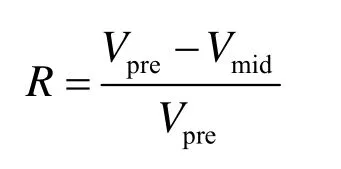
所有调查资料、临床资料经反复检查、核对和编码后,用Excel软件进行数据录入。
1.3 实验方法
采用酚-氯仿法集中进行基因组DNA提取,提取后测OD值确定DNA的原始浓度,再倍比稀释到30−100 ng·μL−1的终浓度备用。采用Taqman real-time PCR方法进行单核苷酸多态性的基因分型。基因分型在ABI 7500荧光定量PCR仪上进行,扩增条件为:95 ℃预变性10 min;92 ℃变性30 s,60 ℃退火以及延伸1 min;共47个循环。以SDS(美国应用生物系统公司)软件 Allelic Discrimination程序进行终点分析,通过检测不同等位基因所标记的FAM和VIC荧光强度,判断待测样本的基因型。
1.4 统计学分析
采用SPSS 13.0统计软件进行分析,数据比较用t检验和方差分析,p<0.05时认为差异有统计学意义。
2 结果
2.1 非小细胞肺癌病例的一般特征
137例患者,平均年龄60.1±5.33岁,肿瘤平均退缩率为0.3474±0.1910,鳞癌87例,腺癌50例,男102例,女35例,Ⅰ期9例,Ⅱ期26例,Ⅲ期70例,Ⅳ期32例。吸烟95例,吸烟者放疗肿瘤退缩率明显高于非吸烟者,分别为0.3755±0.1775和0.2840±0.2068,t=2.643,p=0.009。性别、病理类型及临床分期与放疗肿瘤退缩率无关,具体见表1。
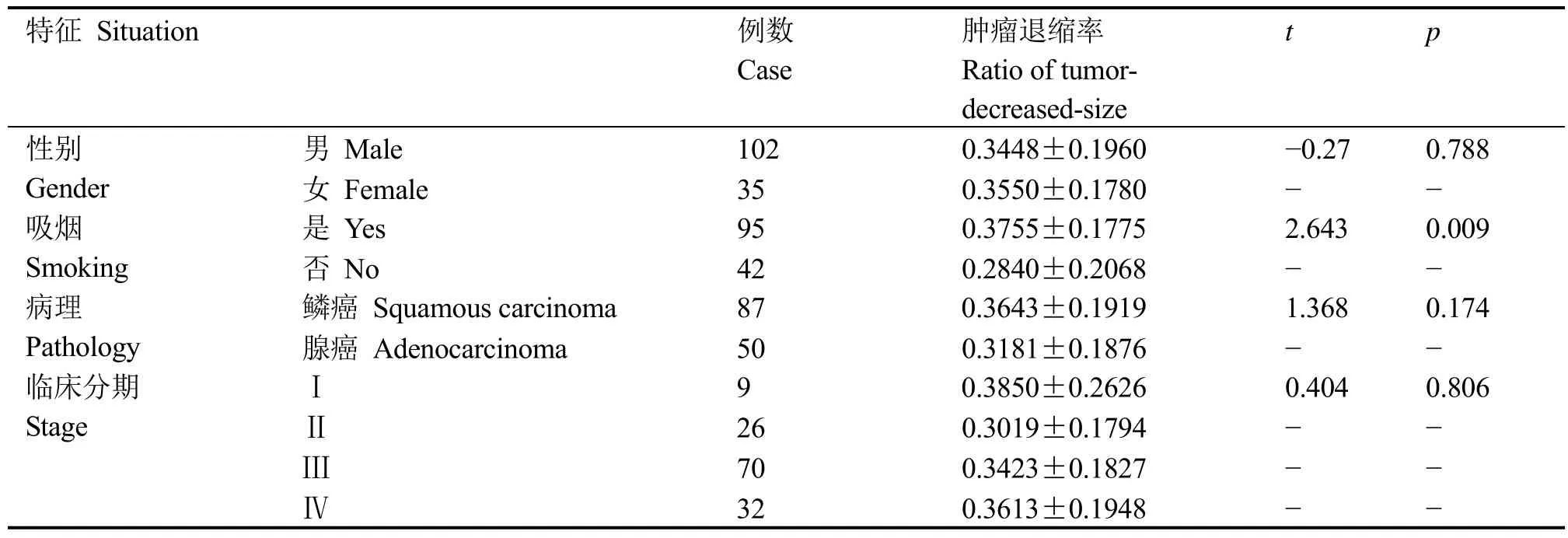
表1 非小细胞肺癌病例的一般特征与放疗肿瘤退缩率关系Table 1 The relationship between general character and the ratio of tumor-decreased-size
2.2 LIG4及HSPB1基因单核苷酸多态性与非小细胞肺癌放疗肿瘤退缩率的关系
LIG4rs1805388的CC、CT和TT基因型放疗肿瘤退缩率分别是0.3395±0.1802、0.342±0.2106和0.5038±0.1892,经方差分析,F=2.142,p=0.121,3种基因型肿瘤退缩率无统计学意义。但经LSD两两比较发现,TT基因型肿瘤退缩率明显高于CC基因型,p= 0.041。HSPB1rs2868371 GG、CG和CC基因型放疗肿瘤退缩率分别是0.3454±0.1932、0.3487±0.1998和0.3487±0.1652,经方差分析和LSD两两比较,未发现3种基因型之间有统计学差异(见表2)。

表2 LIG4和HSPB1基因单核苷酸多态性与非小细胞肺癌放疗肿瘤退缩率的相关性Table 2 The relationship among genetic single nucleotide polymorphisms of LIG4 and HSPB1 and the ratio of tumor-decreased-size
3 讨论
吸烟是肺癌的主要危险因素,其中男性的归因风险为80%,女性的归因风险为45%[7]。非小细胞肺癌中鳞状细胞癌与吸烟状况密切相关[8]。放射生物学研究发现鳞状细胞癌的放射敏感性高于腺癌细胞。我们的研究得出吸烟者放疗肿瘤退缩率明显高于非吸烟者,p=0.009,有统计学意义。目前还未见吸烟与非小细胞肺癌放疗肿瘤退缩率相关的其他报道,我们的研究结果有待大样本实验进一步验证。
非同源末端链接(Non-homologous end joining,NHEJ)修复是哺乳动物细胞中DNA双链断裂(DNA double-strand breaks, DSBs)修复的主要途径。DNA 连接酶 IV及 X-射线修复交叉互补基因均为NHEJ 修复通路中的重要基因[9],影响着肿瘤细胞DNA 损伤后的修复能力及肿瘤细胞对放疗的敏感性[10]。NHEJ修复主要是通过DNA依赖蛋白激酶(DNA dependent proteinkinase, DNAPK)和XRCC4-LIG4连接复合体共同完成的[11]。既往的研究[12-13]显示,XRCC4-LIG4连接复合体功能丧失严重影响DNA断裂双链的再连接,增强放射敏感性。DNA连接酶4综合症是一种罕见的先天性疾病,因LIG4基因突变导致患者对放射线极度敏感[14]。我们的研究显示LIG4rs1805388的CC、CT和TT基因型放疗肿瘤退缩率分别是0.3395±0.1802、0.342±0.2106和0.5038±0.1892,两两比较发现,TT基因型肿瘤退缩率明显高于CC基因型。从我们的实验数据可推论出携带LIG4rs1805388TT基因型非小细胞肺癌患者放疗后肿瘤退缩率高,提示对放疗敏感。但这仍需要大量的实验研究去验证。
热休克蛋白B1,又称热休克蛋白27,是小分子热休克蛋白(sHSP)亚家族的重要一员。Hsp27蛋白可以通过多种途径影响肿瘤的发生和发展,包括维持细胞骨架的正常结构而保证细胞正常生长和存活、调节机体内谷胱甘肽水平进而提高细胞对氧化应激的敏感度[15-16]、抑制内源性和外源性细胞凋亡通路、参与DNA损伤的修复等。研究显示HSPB1通过下调炎症反应,增强细胞对放射线抵抗力[17-18]。Zhang等[19]研究显示鼻咽癌细胞中HSPB1表达上调,增强鼻咽癌细胞对放射线抵抗力。Guo等[20]研究显示HSPB11271C 等位基因可通过下调HSP27表达降低DNA修复能力,增加肺癌细胞对放化疗的敏感性。我们研究结果显示HSPB1rs2868371基因的单核苷酸多态性与非小细胞肺癌放疗肿瘤退缩率无关。目前针对基因的单核苷酸多态性的研究中,来自不同民族、不同地区的研究对象可能得到不同、甚至矛盾的结果,这可能与遗传因素的地域性和种族性有关,还有可能是与样本含量较小有关,HSPB1rs2868371位点纯合突变率较低,小样本结果不能达到应有的统计效能。所以HSPB1rs2868371单核苷酸多态性与非小细胞肺癌放疗肿瘤退缩率的关系还有待于进一步研究。
本研究发现吸烟者和LIG4rs180538TT基因型非小细胞肺癌患者放疗肿瘤退缩率高于其他患者,为临床提高非小细胞肺癌治疗疗效提供理论依据。
1 Curado M P, Edwards B, Shin H R.Cancer incidence in five continents [J].Lyon: IARC Press, 2007, 418-799.
2 Parliament M B, Murray D.Single nucleotide polymorphisms of DNA repairs genes as predictors of radioresponse [J].Seminars Radiation Oncology, 2010,20(4): 232-240.
3 Roddam P L, Rollinson S, O’Driseoll M,et al.Genetic variants of NHEJ DNA ligase IV can affect the risk of developing multiple myeloma, a tumour characterized by aberrant class switch recombination [J].Journal of Medieal Geneties, 2002, 39(12): 900-905.
4 Ahnesorg P, Smith P, Jackson S P.XLF interacts with the XRCC4-DNA ligaseIV complex to promote DNA nonhomologous end-joining [J].Cell, 2006, 124(4): 301-313.
5 Sakata K, Someya M, Matsumoto Y,et al.Ability to repair DNA double-strand breaks related to cancer susceptibility and radiosensitivity [J].Radiation Medicine,2007, 25(9): 433-438.
6 Garrido C, Brunet M, Didelot C,et al.Heat shock proteins 27 and 70: anti-apoptotic proteins with tumorigenic properties [J].Cell Cycle, 2006, 5(22): 2592-2601.
7 Rom W N, Hay J G, Lee T C.Molecular and genetic aspects of lung cancer.American Journal of Respiratory and Critical Care Medicine, 2000, 161(4): 1355-1367.
8 De Stefani E, Boffetta P, Ronco A L,et al.Squamous and small cell carcinomas of the lung: similarities and differences concerning the role of tobacco smoking [J].Lung Cancer, 2005, 47: 1- 8.
9 Ohnishi T, Mori E, Takahashi A.DNA doublestrandbreaks: their production, recognition, and repair in eukaryotes [J].Mutation Research, 2009, 669(1/2): 8-12.
10 Wood R D, Mitchell M, Sgouros J,et al.Human DNA repair genes [J].Science, 2001, 291: 1284-1289.
11 Hefferina M L, Tomkinsonb A E.Mechanism of DNA double-strand break repair by non-homologousendjoining[J].DNA Repair, 2005, 4: 639-648.
12 Ayene I S, Ford L P, Koch C J.Ku protein targeting by Ku70 small interfering RNA enhances human cancer cell response to topoisomerase II inhibitor and gamma radiation [J].Molecular Cancer Therapeutics, 2005, 4(4):529-536.
13 Bertolini L R, Bertolini M, Anderson G B,et al.Transient depletion of Ku70 and Xrcc4 by RNAi as a means to manipulate the non-homologous end-joining pathway [J].Journal of Biotechnology, 2007, 128(2): 246-257.
14 Chistiakov D A, Voronova N V, Chistiakov A P.Ligase IV syndrome [J].European Journal of Medical Genetics,2009, 52(6): 373-378.
15 Mehlen P, Kretz-Remy C, Preville X,et al.Human hsp27,Drosophila hsp27 and human alphaB-crystallin expression-mediated increase in glutathione is essential for the protective activity of these proteins against TNFalpha-induced cell death [J].The Embo Journal, 1996,15(11): 2695-2706.
16 Arrigo A P, Virot S, Chaufour S,et al.Hsp27 consolidates intracellular redoxhomeostasis by upholding glutathione in its reduced form and by decreasing ironintracellular levels [J].Antioxid Redox Signal, 2005,7(3-4): 414-422.
17 Garrido C, Ottavi P, Fromentin A,et al.HSP27 as a mediator of confluence-dependent resistance to cell death induced by anticancer drugs [J].Cancer Research, 1997,57: 2661-2667.
18 Wang G, Kloster gaard J, Khodadadian M,et al.Murine cells transfected with human Hsp27 cDNA resist TNF-induced cytotoxicity [J].J Immunother Emphasis Tumor Immunol, 1996, 19(1): 9-20.
19 Zhang B, Qu J Q, Xiao L,et al.Identification of heat shock protein 27 as a radioresistance-related protein in nasopharyngeal carcinoma cells [J].Cancer Research Clinical Oncology, 2012, 138(12): 2117-2125.
20 Guo H, Bai Y, Xu P,et al.Functional promoter-127G>C variant of HSBP1 predicts lung cancer risk and survival[J].Journal of Clinical Oncology, 2010, 28(11):1928-1935.

