3种常用联合化疗方案一线治疗晚期胃癌的疗效和安全性比较
胃癌是全球范围内第四大恶性肿瘤,尽管手术、介入、放化疗和靶向治疗等综合性治疗手段的发展使死亡率呈下降趋势,但仍是导致癌症死亡的第二大原因。早期胃癌可通过内窥镜黏膜切除术及胃癌根治术获得治愈效果,但绝大多数胃癌患者在初诊时已是疾病中晚期,即使综合外科、介入、放化疗和靶向治疗的手段,仍有较高的复发转移风险,预后不乐观,不仅给老年人带来严重的健康损害,而且也给家庭、社会带来严重的负担。化疗是晚期胃癌患者主要的治疗手段,探索低毒、高效的治疗方案是临床研究的热点。基于此,我们回顾性研究了2010 年1月至2013年6月期间在我科使用奥沙利铂联合氟尿嘧啶(mFOLFOX6)、伊立替康联合氟尿嘧啶(FOLFIRI)或多西他赛、奥沙利铂或顺铂联合氟尿嘧啶(DOF/DCF)方案治疗的晚期胃癌患者,对3种化疗方案的临床疗效及不良反应进行比较分析。
1 材料和方法
1.1 临床资料 回顾性收集了我院2010 年1月至2013年6月肿瘤内科收治的晚期胃癌患者(局部晚期或远处转移)。入选条件:(1)不能手术、拒绝手术或手术后复发,经内镜病理证实为胃癌,治疗前均有可测量病灶;(2)初次进行化疗,或入选时距离末次化疗>6月;(3)血常规、肝肾功能、心电图检查在正常范围内,无化疗禁忌证;(4)治疗前卡诺夫斯基体能状态(KPS)评分≥70分,预计生存时间>3月;(5)治疗前签订知情同意书。共入选46例,男33例,女13例,年龄23~82岁,平均(62.0±13.1)岁。mFOLFOX6方案治疗14例,年龄42~82岁,平均(70.0±11.6)岁;FOLFIRI方案治疗12例,年龄25~79岁,平均(57.0±17.8)岁;DOF/DCF方案治疗20例,年龄43~70岁,平均(60.0±8.0)岁。
1.2 治疗方法 化疗前和化疗后进行三大常规、肝肾功能、心电图、胸腹部CT检查,测量原发病灶或转移灶大小。患者接受的联合化疗方案分别为:(1)mFOLFOX6:第1天奥沙利铂85 mg/m2静滴,亚叶酸钙400 mg/m2静滴,5-氟尿嘧啶(5-FU) 400 mg/m2静脉推注;5-FU 2400 mg/m2持续静脉泵入48 h,第1天开始用,1周期1次,每14 d为1个周期。(2)FOLFIRI:伊立替康150 mg/m2静滴,第1天用;亚叶酸钙400 mg/m2静滴,第1天用;5-FU 400 mg/m2静脉推注,第1天用;5-FU 2400 mg/m2持续静脉泵入48 h第1天开始用,1个周期1次,每14 d为1周期。(3)DOF/DCF:多西他赛35 mg/m2静滴第1天和第8天;奥沙利铂85 mg/m2静滴第1天或顺铂15 mg/m2静滴第1~5天;5-FU 500 mg/m2静滴第1~5天,每28 d为1周期。用药前严格按照患者的体表面积计算各化疗药物剂量,对于年龄≥70岁的老年患者在30%的范围内减少药物用量。每次化疗前常规给予5-羟色氨酸抑制剂和10 mg地塞米松预防呕吐。对于出现白细胞下降患者常规给予粒细胞集落刺激因子治疗; 对于≥Ⅱ度消化道反应患者,给予止吐、止泻、输液对症支持治疗。当疾病进展或出现不能耐受的不良反应时,一线化疗停止并根据患者意愿和身体状况改用其他二线方案或行最佳支持治疗。
1.3 观察指标及疗效判定 每周期化疗前后检查血常规、肝肾功能、KPS评分,每周期评价不良反应。不良反应评价参照世界卫生组织急性、亚急性毒性反应标准[1]。对于双周方案者在完成4周期化疗后进行评价,对于3~4周方案者在完成2周期化疗后半月至1月评价近期疗效。疗效判定根据美国临床肿瘤学会2000年公布的实体瘤疗效评价标准(RECIST)判定临床疗效[2]:完全缓解(CR):全部病灶消失,并持续>4 周;部分缓解(PR):肿瘤2个最大的相互垂直的直径乘积缩小>50%,并持续>4周,无新病灶出现;疾病稳定(SD):肿瘤2个最大的相互垂直的直径乘积缩小<50%,增大<25%,并持续>4 周,无新病灶出现;疾病进展(PD):肿瘤2个最大的相互垂直的直径乘积增大>25%或者有新病灶出现。客观缓解率(ORR)为CR+PR所占比例,疾病控制率(DCR)为CR+PR+SD所占比例。随访时间截止到2014年1月31日,无进展生存时间(PFS)定义为晚期一线治疗开始至疾病进展的时间,总体生存时间(OS)定义为晚期一线治疗开始至死亡的时间。
1.4 统计学分析 采用SPSS 16. 0 统计学软件进行数据分析,各组间ORR、DCR、毒性反应发生率、二线治疗率的比较使用χ2检验,使用寿命表计算中位PFS和OS,使用Kaplan-Meier生存曲线、Log-Rank检验、Cox多因素回归模型进行生存分析。当P<0. 05时,认为差异具有统计学意义。
2 结果
2.1 治疗效果 本研究共入组46例病人,患者一般资料见表1。所有患者均接受了≥2周期化疗(双周方案者接受了≥4周期化疗),32例(69.5%)患者接受了>4周期(双周方案者接受了>8周期化疗),可评价近期疗效。其中CR 0例,PR 11例,SD 27例,PD 8例,总体ORR为23.9%,DCR为82.6%。mFOLFOX6、FOLFIRI和DOF/DCF的ORR分别为28.6%、8.3%和30%,DCR分别为92.9%、66.7%和85.0%,各方案近期疗效无统计学差异。
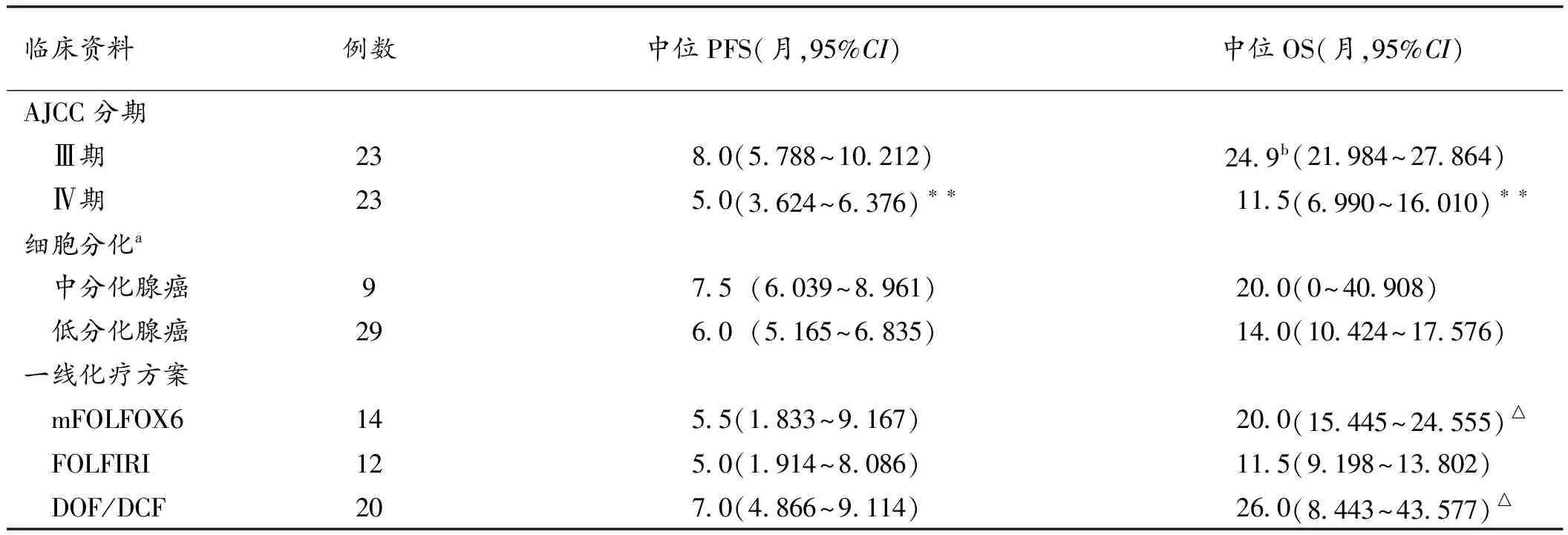
表1 46例胃癌患者采用3种方案化疗后PFS及OS比较
注:a部分数据缺失,基于已有数据计算,低分化腺癌包含印戒细胞癌;b中位生存时间无法计算时,以均数表示;与Ⅲ期患者比较,**P<0.01;与FOLFIRI方案比较,△P<0.05
Kaplan-Meier分析显示患者的年龄、性别、细胞分化与PFS或OS均无显著相关,仅肿瘤分期与患者PFS(P<0.01)和OS(P<0.01)显著相关;mFOLFOX6、FOLFIRI、DOF/DCF治疗的患者中位PFS分别为5.5月、5月和7月,无统计学差异(P=0.135),中位OS具有显著性差异(P=0.043),分别为20月、11.5月和26月(表1)。所有病人中初治患者25例,平均年龄(61.0±14.8)岁,复发后一线治疗患者21例,平均年龄(64.0±14.8)岁。进一步分层分析显示对于复发后一线治疗的患者,在PFS和OS方面3种化疗方案没有显著差异,而对于初治的患者,一线使用FOLFIRI方案患者的PFS和OS相比使用mFOLFOX6或DOF/DCF患者较短。在初治患者中,mFOLFOX6、FOLFIRI、DOF/DCF治疗的患者中位PFS分别为5.5月、2.5月和7月,中位OS分别为19月、4.5月和14月,见表2。因为胃癌的二线治疗也可延长患者的OS[3],我们在初治患者中分析了一线治疗进展后接受二线治疗的情况,DOF/DCF方案治疗的患者接受二线治疗的比例为100%(12/12),显著高于mFOLFOX6(60%,3/5)或FOLFIRI(50%,2/4)(P=0.035)。然而Cox多因素分析显示,排除患者接受二线治疗的因素外,与mFOLFOX6或DOF/DCF相比,FOLFIRI治疗的患者OS仍显著较短(P=0.039)。
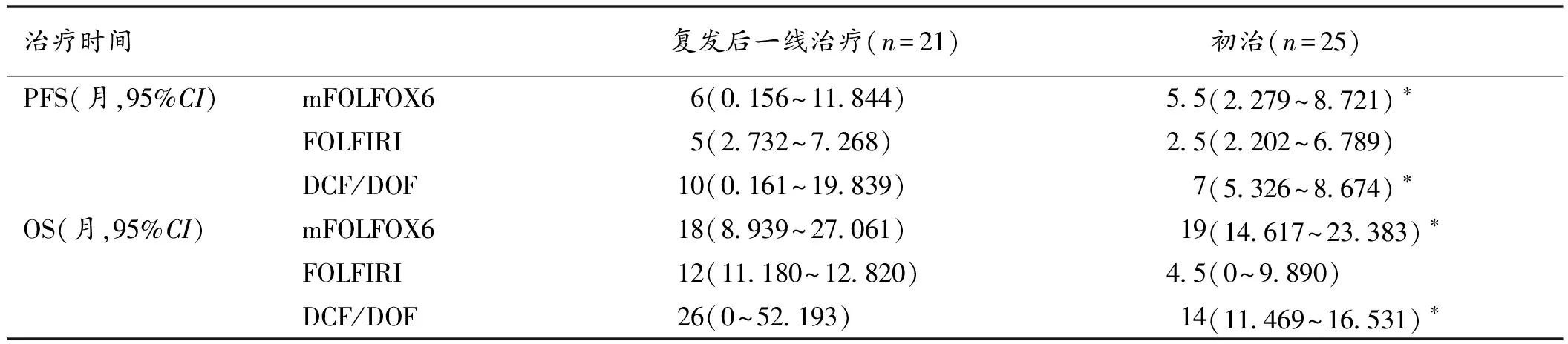
表2 3种化疗方案对胃癌患者初治及复发后一线治疗PFS和OS比较
注:与FOLFIRI治疗比较,*P<0.05
2.2 不良反应 3种化疗方案治疗的胃癌患者均出现了不同程度骨髓抑制、恶心、呕吐、腹泻等消化道反应、肝肾功能异常和神经毒性。其中Ⅲ~Ⅳ度骨髓抑制mFOLFOX6组1例、FOLFIRI组3例、DOF/DCF组5例;Ⅲ~Ⅳ度肝功能异常mFOLFOX6组1例、FOLFIRI组2例;Ⅲ~Ⅳ度恶心呕吐mFOLFOX6组1例、DOF/DCF组2例;Ⅲ~Ⅳ度腹泻FOLFIRI组2例、DOF/DCF组2例,Ⅲ~Ⅳ度神经毒性DOF/DCF组1例。全部Ⅲ~Ⅳ度药物不良反应发生率mFOLFOX6组为21.4%、FOLFIRI组为58.3%、DOF/DCF组为50.0%,无统计学差异(P=0.123)。经粒细胞集落刺激因子、保肝、止吐、止泻、输液治疗后恢复,均未影响治疗。一线化疗结束时进行KPS评分,46例患者KPS评分均≥70分。
3 讨论
晚期胃癌患者预后极差,大量临床试验已证实无论是一线还是二线的联合化疗,相对于最佳支持治疗均可以显著延长患者生存时间,改善生存质量[4-6]。因此,化疗是晚期胃癌综合治疗中的重要组成部分。然而,目前临床上对于晚期胃癌一线化疗并无标准方案,本研究探讨了3种晚期胃癌常用化疗方案——mFOLFOX6、FOLFIRI、DOF/DCF的临床疗效和药物毒性反应,结果显示在OS方面,特别是对于初治的患者一线使用mFOLFOX6或DOF/DCF方案优于FOLFIRI方案;各方案的Ⅲ-Ⅳ度药物不良反应发生率无统计学差异。
3.1 胃癌晚期一线方案与生存获益 目前晚期胃癌患者一线治疗多采用联合化疗方案,仅对症支持治疗的晚期胃癌患者中位生存期为3~4月,氟尿嘧啶类单药治疗后PFS和OS分别为3~5月和7~8月[7-8],而基于氟尿嘧啶和铂类为基础的联合化疗方案可进一步提高PFS达5~7月,OS至8~12月[9-10]。近期荟萃分析显示含多西他赛的3药联合方案(如DCF)治疗晚期胃癌近期疗效总体优于其他临床常用方案,但具有较高Ⅲ~Ⅳ度血液学毒性[11-12],而FOLFOX方案具有与DCF相当的近期疗效和生存获益,并且毒性反应较DCF轻[13-14]。一些Ⅱ期临床试验显示FOLFIRI方案用于一线治疗晚期胃癌DCR为60%~82.5%,中位PFS为5~6月,中位OS为8~13月[15-17],相似于DCF或FOLFOX方案的生存期。我们的研究结果显示:3种联合化疗方案总体ORR为23.9%,DCR为82.6%;mFOLFOX6、FOLFIRI、DOF/DCF治疗的患者ORR、DCR、PFS均无统计学差异;中位OS分别为20月、11.5月和26月,具有显著性差异;其中对于Ⅳ期患者mFOLFOX6、FOLFIRI或DOF/DCF治疗的中位PFS为3.5月、5月和5月,OS分别为9月、11.5月和12月,与大多数临床试验报道的联合化疗生存时间相似。分层分析显示3种化疗方案在具有不同肿瘤分期、肿瘤分化程度以及复发后一线治疗的病人中,其PFS和OS无显著性差异;但值得注意的是,对于初治的晚期患者,mFOLFOX6或DOF/DCF的OS显著优于FOLFIRI,且该生存期的延长与患者是否接受二线治疗无关。因此,FOLFIRI方案可能不是初治的晚期胃癌患者的最佳选择。
3.2 胃癌晚期一线方案与药物不良反应 至今,晚期胃癌化疗仍无“金标准”方案,探索高效低毒的方案是临床研究的重要课题。研究显示FOLFIRI方案用于晚期胃癌,Ⅲ度腹泻的发生率为0~11%,Ⅲ~Ⅳ度骨髓抑制发生率为20%~50%[15-17],FOLFOX与DCF相比,药物不良反应发生率相对较低[16-17]。在药物毒性反应方面,本研究中3种化疗方案治疗的胃癌患者均出现不同程度的骨髓抑制、恶心、呕吐、腹泻等消化道反应、肝肾功能异常和神经毒性,其中Ⅲ~Ⅳ度骨髓抑制、腹泻和恶心呕吐发生率在DOF/DCF和FOLFIRI治疗患者中相对较高,而Ⅲ~Ⅳ度神经毒性在mFOLFOX6和DOF/DCF治疗患者中相对多见。虽然并无统计学差异,但与mFOLFOX6(21.4%)相比,全部Ⅲ~Ⅳ度药物不良反应发生率在FOLFIRI(58.3%)和DOF/DCF(50%)中相对较高。出现化疗相关不良反应的患者在对症支持治疗后,均得到不同程度恢复或缓解,使化疗能按计划顺利完成,这说明3种治疗方案毒性反应均可耐受。mFOLFOX6方案总体Ⅲ~Ⅳ度不良反应发生率较低,可能对提高患者生活质量具有一定优势,值得进一步研究。
由于本研究入组患者例数较少,且受限于回顾性研究,入组患者用药方案和剂量调整无统一标准, 导致研究结果的可信度和可比性有所欠缺。但这仍提示我们对于初治和复发后再治的晚期胃癌患者仍需谨慎选择一线治疗方案,对于初治患者,mFOLFOX6或DOF/DCF可能是优于FOLFIRI的选择。我们的研究结果提示有必要进一步开展设计更为严谨的随机临床研究,基于大样本评价疗效与毒副反应,为优选晚期胃癌高效低毒的治疗方案提供更好的循证医学证据。
[参考文献]
[1] 孙燕. 抗癌药急性及亚急性毒性反应分度标准(WHO标准) [J]. 癌症, 1992,11(3):254.
[2] Therasse P, Arbuck SG, Eisenhauer EA, et al. New guidelines to evaluate the response to treatment in solid tumors. European Organization for Research and Treatment of Cancer, National Cancer Institute of the United States, National Cancer Institute of Canada [J]. J Natl Cancer Inst, 2000, 92(3): 205-216.
[3] Ford HE, Marshall A, Bridgewater JA, et al. Docetaxel versus active symptom control for refractory oesophagogastric adenocarcinoma (COUGAR-02): an open-label, phase 3 randomised controlled trial [J]. Lancet Oncol, 2014, 15(1): 78-86.
[4] Wagner AD, Grothe W, Haerting J, et al. Chemotherapy in advanced gastric cancer: a systematic review and meta-analysis based on aggregate data [J]. J Clin Oncol, 2006, 24(18): 2903-2909.
[5] Kim HS, Kim HJ, Kim SY, et al. Second-line chemotherapy versus supportive cancer treatment in advanced gastric cancer: a meta-analysis [J]. Ann Oncol, 2013, 24(11): 2850-2854.
[6] Kang JH, Lee SI, Lim do H, et al. Salvage chemotherapy for pretreated gastric cancer: a randomized phase III trial comparing chemotherapy plus best supportive care with best supportive care alone [J]. J Clin Oncol, 2012, 30(13): 1513-1518.
[7] Cullinan SA, Moertel CG, Wieand HS, et al. Controlled evaluation of three drug combination regimens versus fluorouracil alone for the therapy of advanced gastric cancer. North Central Cancer Treatment Group [J]. J Clin Oncol, 1994, 12(2): 412-416.
[8] 高炜, 徐艳霞, 梁华, 等. 替吉奥对比卡培他滨一线治疗老年晚期胃癌的疗效分析 [J]. 实用老年医学, 2012, 26(6): 501-503.
[9] Di Lauro L, Vici P, Belli F, et al. Docetaxel, oxaliplatin, and capecitabine combination chemotherapy for metastatic gastric cancer [J]. Gastric Cancer, 2014,17(4):718-724.
[10] 樊卫飞, 王峻, 孟丽娟, 等. 替吉奥联合奥沙利铂一线治疗老年晚期胃癌的疗效分析 [J]. 实用老年医学, 2013, 27(3):240-243.
[11] 王平,陈永法. 多西他赛联合顺铂、5-氟尿嘧啶治疗治疗晚期胃癌的Meta分析 [J]. 中国药物经济学, 2013,(1): 9-14.
[12] Chen XL, Chen XZ, Yang C, et al. Docetaxel, cisplatin and fluorouracil (DCF) regimen compared with non-taxane-containing palliative chemotherapy for gastric carcinoma: a systematic review and meta-analysis [J]. PLoS One, 2013, 8(4): e60320.
[13] 韩国花, 王丽娜, 商艳敏. DCF和FOLFOX4方案治疗晚期胃癌的疗效比较 [J]. 贵阳医学院学报, 2011, 36(4): 379-381.
[14] 白璐,李青山. FOLFOX6方案与DCF方案治疗晚期胃癌的疗效比较 [J]. 广东医学, 2012, 33(14): 2118-2121.
[15] Fonck M, Brunet R, Becouarn Y, et al. Evaluation of efficacy and safety of FOLFIRI for elderly patients with gastric cancer: a first-line phase II study [J]. Clin Res Hepatol Gastroenterol, 2011, 35(12): 823-830.
[16] Samalin E, Afchain P, Thézenas S, et al. Efficacy of irinotecan in combination with 5-fluorouracil (FOLFIRI) for metastatic gastric or gastroesophageal junction adenocarcinomas (MGA) treatment [J]. Clin Res Hepatol Gastroenterol, 2011, 35(1): 48-54.
[17] Kim BG, Oh SY, Kwon HC, et al. A phase Ⅱ study of irinotecan with biweekly, low dose leucovorin and bolus and continuous infusion 5-fluorouracil (modified FOLFIRI) as first line therapy for patients with recurrent or metastatic gastric cancer [J]. Am J Clin Oncol, 2010, 33(3): 246-250.

