脑梗死患者外周血血清和血浆中白细胞基质金属蛋白酶9及基质金属蛋白酶组织掏因子1水平差异分析
细胞外基质合成与降解的平衡失调是血管重构和动脉粥样硬化性脑梗死的主要病理过程,基质金属蛋白酶(MMPs)属于基质蛋白酶家族,能够降解所有细胞外基质成分,同时也是变性和炎症过程的主要调节分子,在血管壁重构以及心脑血管病发病机制中扮演重要角色,目前MMPs已经作为动脉粥样硬化和心脑血管病的预测因子[1]。本研究旨在探讨血清及血浆中白细胞基质金属蛋白酶9(MMP9)和基质金属蛋白酶组织抑制因子1(TIMP-1)的水平差异,为脑组织损伤生物标志物的选择提供依据。
1 对象和方法
1.1 一般资料 收集临床资料:脑梗死患者116例为脑梗死组,男61例,女55例。年龄51~77岁,平均(68.0±6.6)岁。健康体检者43例为健康组,男23例,女20例。年龄48~59岁,平均(53.0±5.7)岁。所有病例经头颅CT或MRI证实,临床表现符合《中国脑血管病防治指南》的诊断标准,发病<1周的患者。脑梗死纳入标准: 符合动脉粥样硬化性血栓性脑梗死、腔隙性梗死的诊断,并具有神经功能缺损的临床表现者。排除标准: 短暂性脑缺血发作(TIA);脑出血;发病>1周;经检查证实由脑肿瘤、脑外伤、血液病等引起的卒中患者,因风湿性心脏病、冠心病及其他心脏病合并房颤引起脑栓塞者;合并有肝、肾、造血系统、内分泌系统等严重疾病及骨关节病、精神病者。
1.2 方法 血清、血浆采集:分别采用无促凝剂的采血管、含EDTAK2抗凝管(购自上海科华)清晨空腹采血,3000 r/min离心20 min,取上清置于-80 ℃保存,避免反复冻融。
MMP9和TIMP-1的水平检测:采用ELISA法,样本和标准品均设复孔,以标准品的浓度为纵坐标,OD值为横坐标,采用ELISA-0.2软件计算标准曲线的四参数Logistic曲线拟合方程,再乘以稀释倍数,即为样品的实际浓度。ELISA试剂购自苏州科创生物技术公司,Biotek 酶标仪(美国 ELX800)。
1.3 统计学处理 数据分析采用统计软件SPSS 11.5,血清和血浆组间MMP9及TIMP-1含量差异采用配对t检验。脑梗死组与健康组血浆MMP9和TIMP-1差异比较采用成组t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 脑梗死组血清和血浆MMP9和TIMP-1水平比较 116例脑梗死患者血清和血浆中MMP9水平及TIMP-1水平均呈线性相关,血清MMP9水平显著高于血浆MMP9水平,差异具有统计学意义(P<0.01)。 血清TIMP-1水平亦显著高于血浆TIMP-1水平,差异具有统计学意义(P<0.01)。见表1。
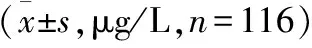
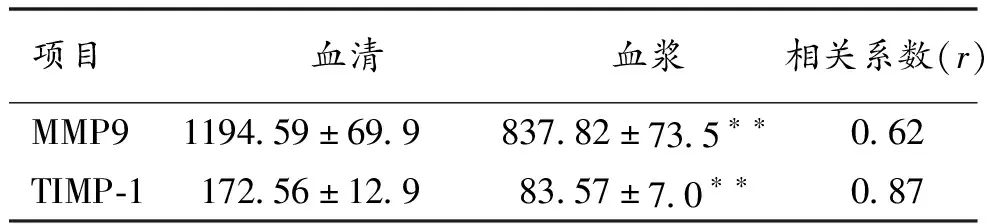
项目血清血浆相关系数(r) MMP91194.59±69.9837.82±73.5∗∗0.62 TIMP-1172.56±12.983.57±7.0∗∗0.87
注:与血清比较,**P<0.01
2.2 脑梗死组与健康组血浆MMP9和TIMP-1水平比较 本研究脑梗死组MMP9血浆水平显著高于健康组,差异具有统计学意义(P<0.01)。而脑梗死组TIMP-1血浆水平显著低于健康组,差异具有统计学意义(P<0.01),见表2。
3 讨论
正常和病态血管壁细胞能够在可溶性细胞因子以及细胞和细胞血小板白细胞之间相互作用活化和上调MMPs水平,MMPs活性增强有益于基质的转化,血管的修复和动脉粥样硬化斑块的稳定,但是也能导致血管内膜增厚动脉粥样硬化和血栓形成[2]。MMP9和TIMP-1水平的不同不仅与疾病状态相关,同时也与血凝和纤维溶解途径相关。凝血过程中凝血酶能够促进MMP9前体和MMP9的活化,凝血酶产生纤维蛋白,连接MMP9单体的纤维蛋白连接域,继而活化的MMP9单体在血清聚集,在纤维蛋白溶解过程,尿激酶纤溶酶原激活剂促进白细胞产生MMP9[3],外周血中MMPs和TIMP-1水平在血清与血浆水平存在差异,血清MMP9和TIMP-1的水平高于含有抗凝剂的血浆,本研究结果与相关报道相一致[4],由于血小板和白细胞在聚集或活化时能够释放MMP9和TIMP-1,而使用抗凝剂能够抑制血小板和白细胞释放MMP9和TIMP-1[5]。因此对于研究MMP9和TIMP-1作为生物学标志和其在病理生理过程中的角色,采血方法和样本前处理非常重要。忽视采血方法对结果的影响,可能影响对正常结果的判断分析。
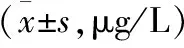

组别nMMP9TIMP-1 脑梗死组116837.82±73.5∗∗83.57±7.0∗∗ 健康组43181.36±7.3186.61±43.5
注:与健康组比较,**P<0.01
脑梗死在缺血组织内以及其周围出现高水平MMP9,可能引起出血原因是毛细血管基底膜大量Ⅳ胶原降解,红细胞和白细胞外渗。MMPs由脑细胞和循环至脑组织的外周血白细胞产生,局部缺血后渗透的白细胞是MMP9 的主要来源[6]。白细胞MMP9敲除嵌合子小鼠与MMP9敲除鼠具有相同表现。脑组织和血中MMP9促进神经元死亡、炎症、渗透、神经血管损伤。MMP9参与神经和血管病理生理过程。血浆水平MMPs已经作为脑组织损伤的潜在生物学标志[7-8]。与健康人比较,缺血性脑卒中患者外周血MMP9水平增高,且与缺血面积及神经症状有关[9], TIMP-1作为MMP9活性的主要抑制物,与MMP9特异性结合,TIMP-1和MMP9之间平衡调节是血管重构的关键,TIMP-1和MMP9之间平衡失调可能导致脑卒中后梗死扩大,损伤血脑屏障[8]。
总之,血浆水平MMP9和TIMP-1更适合作为脑组织损伤的潜在生物学标志,使用血清标本检测MMP9和TIMP-1可能产生分析前的偏倚。
[参考文献]
[1] Sundström J, Vasan RS. Circulating biomarkers of extracellular matrix remodeling and risk of atherosclerotic events[J]. Curr Opin Lipidol, 2006,17(1):45-53.
[2] Androulakis E, Tousoulis D, Papageorgiou N, et al. The role of matrix metalloproteinases in essential hypertension[J]. Curr Top Med Chem, 2012,12(10): 1149-1158.
[3] Mannello F. Effects of blood collection methods on gelatin zymography of matrix metalloproteinases [J]. Clin Chem,2003,49(2):339-340.
[4] John M, Jung K. Pre-analytical conditions for the assessment of circulating MMP-9 and TIMP-1: consideration of pitfalls[J]. Eur Respir J,2005,26(2):364-366.
[5] Jung K, Gerlach RF, Tanus-Santos JE. Preanalytical pitfalls of blood sampling to measure true circulating matrix metalloproteinase 9 and tissue inhibitors of matrix metalloproteinases[J]. Clin Chim Acta, 2006,373(1/2):180-181.
[6] Gidday JM, Gasche YG, Copin JC, et al. Leukocyte-derived matrix metalloproteinase-9 mediates blood—brain barrier breakdown and is proinflammatory after transient focal cerebral ischemia[J].Am J Physiol Heart Circ Physiol,2005, 289(2):H558-H568.
[7] 梁恒,韩江全,李继中,等. MMP9、hs-CRP、BNP、S-100和DD在急性缺血性脑卒中患者中的临床诊断意义[J]. 中国实用医药, 2012, 7(24):4-6.
[8] 谢明剑,薛伟新,邱楚雄,等. 脑梗死病人梗死面积与MMP1、MMP9、TIMP-1的关系探讨[J]. 中西医结合心脑血管病杂志, 2011, 9(2):173-174.
[9] 刘长海. 血清MMP-9、Hs-CRP检测在缺血性脑卒中患者中的意义[J]. 中国实用神经疾病杂志, 2013, 16(2):35-37.

