绝经后妇女MTHFR基因多态性位点联合作用与骨质疏松易感性的相关性分析
绝经后骨质疏松症是指由于绝经后雌激素缺乏而引起的破骨细胞的骨吸收和成骨细胞的骨形成之间不平衡而发生的骨质疏松症和骨折。国内外有关报道显示,在>60岁的老年女性中,骨质疏松症的患病率高达40%~50%,其中约30%~50%的患病女性将经历骨质疏松相关的骨折,由此带来的并发症和巨额医疗费用已使骨质疏松成为全球关注的热点[1-3]。既往研究显示,有60%~85%的骨量、50%~75%的骨代谢和25%~35%的骨质疏松症和骨折的发生取决于遗传因素[4]。5,10亚甲基四氢叶酸还原酶(methylene tetrahydrofolate reductase,MTHFR)基因是叶酸代谢通路上参与DNA正常合成和甲基化的重要基因之一,其突变可能会导致绝经后妇女骨密度的异常,发生骨质疏松症及骨折[5-8]。本研究采用以人群为基础的病例-对照研究方法,探讨MTHFR基因的功能性单核苷酸多态性(single nucleotide polymorphisms, SNPs)位点(rs1801131 A1298C和rs1801133 C677T)的联合作用与我国苏州汉族人群绝经后骨质疏松易感性的关系,进一步阐明绝经后骨质疏松症的可能分子机制,为今后实施目标明确的个体化防治提供理论基础和临床依据。
1 材料与方法
1.1 研究对象 采用分层随机抽样的方法,收集苏州市金阊区、相城区、吴中区有常住户口并长期居住在抽样点的年龄45~70岁自然绝经妇女,排除有影响骨代谢的疾病及其他需长期治疗的严重慢性疾病、调查前6月服用过激素类药物及钙制剂等影响骨代谢药物及近6月内有骨折史者。测量骨密度T值(为与同性别年轻人平均值进行比较而得到),T值<-2.5SD为骨质疏松诊断标准,共收集骨质疏松病例92例,平均(60.23±5.26)岁,骨超声传导速度(SOS)为(3793.91±80.52)m/s。同时期同地区收集正常对照组169例,年龄45~69岁,平均(58.01±5.70)岁,SOS值为(4043.69±94.10)m/s,与病例组年龄匹配。病例组和对照组均来自汉族人群。
1.2 调查方法 使用统一设计的调查表,分别对病例组和对照组进行流行病学调查,主要询问内容包括一般人口学特征、月经史、生育史、高血压等慢性病病史,测量身高、体质量、腰围、臀围、血压等,计算体质量指数(BMI)及腰臀比(WHR)。上述调查和采样均获得被调查者同意并签署知情同意书。调查员经统一培训合格后,方可参加面访调查。
1.3 实验方法 应用以色列Sunlight Medical Ltd公司生产的Omnisense 7000s型骨定量超声仪测定桡骨远端SOS反映骨密度。采用AxyPrep血基因组DNA小量试剂盒(杭州爱思进生物技术有限公司)提取DNA。MTHFR功能性SNPs位点的基因型分析采用TaqMan方法。按下列体系加样(5 μl体系): 0.5 μl DNA模板, 2.5 μl TaqMan®Universal PCR Master Mix、0.25 μl Forward/Reverse Primers 、0.125 μl Probe and 1.25 μl ddH2O。反应条件:2 min 50 ℃、10 min 95 ℃, 15 s 95 ℃, 1 min 60 ℃, 40个循环。利用SDS 2.0软件(ABI)观察结果。每块384孔板包括2个来自同一样本的阳性对照和2个空白样本的阴性对照。本研究检测261份DNA样本,成功率为100%,抽取5%样本重复检测,一致性为100%。引物和探针的序列由南京冀鳌生物技术有限公司合成,见表1。

表1 MTHFR基因SNP位点基因扩增的引物和探针序列
1.4 统计分析 采用Epidata 3.0软件双轨录入全部数据资料,核对无误后供分析使用。采用统计软件SAS 9.1.3进行数据的统计分析:χ2检验 、student-t检验用于分析人口学的基本特征;单因素及多因素Logistic回归分析计算标准化偏回归系数(β)、OR值及95%CI;拟合优度χ2检验用于对照组的基因型分布的Hardy-Weinberg平衡检验;使用PHASE 2.0软件进行单倍型分析;应用广义多因子降维法(GMDR)(GMDR软件,version 0.7)检测位点-位点、位点-环境之间的联合作用。
2 结果
2.1 Hardy-Weinberg遗传平衡检验 在对照组中,对rs1801131位点(1298A>C)基因型及rs1801133位点(677C>T)基因型的频率进行遗传平衡检验,结果显示实际频数与理论频数分布的差别均无统计学意义(P>0.05),说明该对照组人群2个位点基因型频率分布均符合遗传平衡法则,具有人群代表性。见表2。
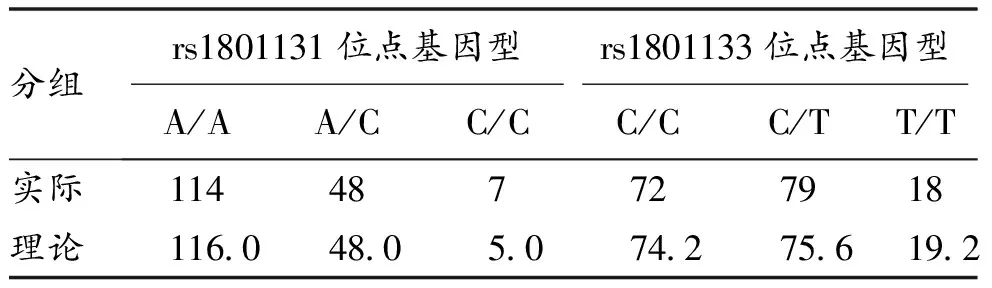
表2 Hardy-Weinberg平衡检验(n)
2.2 MTHFR基因与骨质疏松的关联性分析 调整年龄、BMI、WHR及产次后,MTHFR基因rs1801133(C→T)的位点变异与骨质疏松的发生成正关联。与野生型rs1801133 CC基因型相比,突变纯合型rs1801133 TT及CT/TT型可以显著增加骨质疏松的发生风险[调整OR=2.63,2.37;95%CI=(1.20~5.77),(1.16~4.87)]。经1000次置换检验(Permutation test)方法校正后,该位点的基因型频率分布在病例组与对照组间仍存在统计学差异。rs1801133 C/T的等位基因频率在病例组和对照组中的差异具有显著性(P=0.039)。未发现rs1801131的多态性与骨质疏松的发生存在关联。见表3。
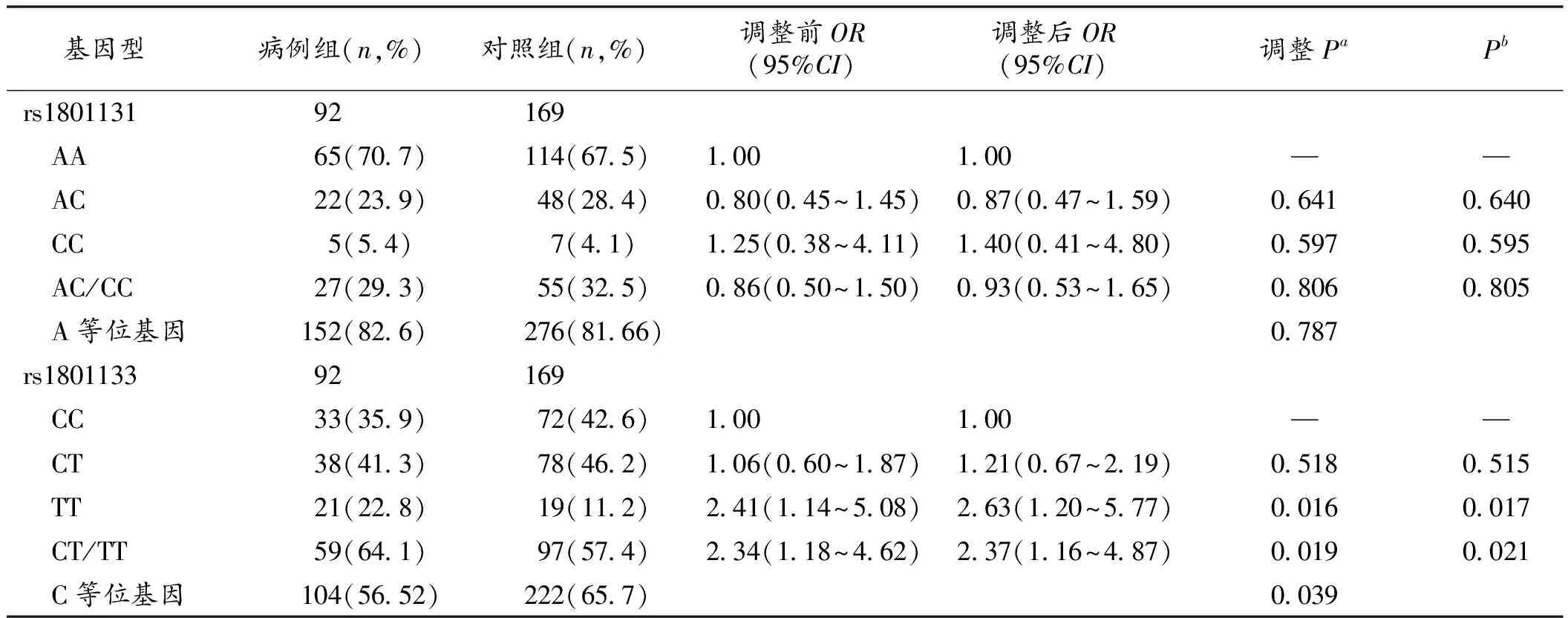
表3 MTHFR基因2个SNPs的基因型及等位基因频率在病例组和对照组的分布
注:a调整因素为年龄、BMI、WHR及产次;b1000次置换检验
2.3 MTHFR基因2个SNPs的单倍型分析 单倍型分析结果表明,与最常见的单倍型CC相比,含野生等位基因rs1801131 A的单倍型AC可以显著降低绝经后妇女骨质疏松的患病风险[调整OR=0.60;95%CI=(0.39~0.90)]。见表4。

表4 MTHFR基因2个SNPs的单倍型分析及与骨质疏松易感性的关系
注:a多态性碱基顺序为5′→3′,多态性位点顺序依次为rs1801131, rs1801133;b调整P值;c调整因素为年龄、BMI、WHR及产次
2.4 MTHFR基因2个SNPs的联合作用分析 将rs1801131、rs1801133依次命名为A1、A2,年龄、BMI、WHR及产次作为环境调整因素,应用GMDR分析2个多态性位点的联合作用,结果显示模型A1A2 (rs1801131, rs1801133)为最佳模型(交叉验证一致性10/10,P=0.0107),提示rs1801131和rs1801133位点在骨质疏松的发病中可能存在联合作用。见表5。
3 讨论
MTHFR基因位于人类染色体1p36.3,cDNA全长约2.2 kb,其编码基因存在遗传多态性,其中部分多态性的存在可能导致MTHFR mRNA表达下降或缺失,使其翻译的蛋白质数量锐减,从而影响该酶的活性及稳定性,不能催化5,10-亚甲基四氢叶酸还原为5-甲基四氢叶酸,引起血浆中5-甲基四氢叶酸的降低和同型半胱氨酸(Hcy)的堆积,使得作为甲基供体的甲硫氨酸合成障碍,最终引起DNA的低甲基化[9]。MTHFR所对应的基因多态性位点从1995年677个位点到1998年1298个位点,前后相继检测出了20余个多态性位点,并且这些多态性位点突变基因型的交互作用较单独作用更为明显。本研究从分子流行病学角度,探讨了MTHFR基因的rs1801131(1298A>C)位点及rs1801133(677C>T)位点联合作用与绝经后妇女骨质疏松发病风险之间的关系。
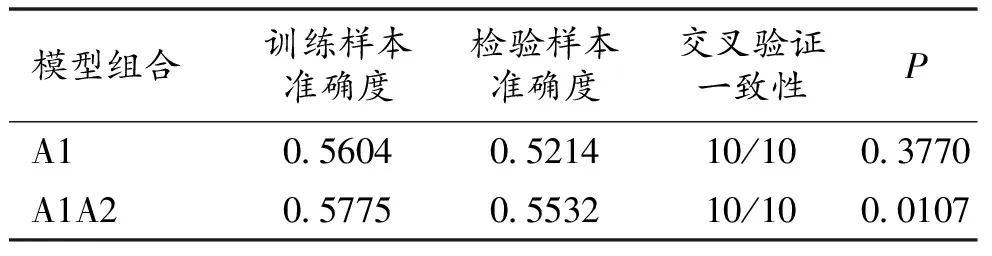
表5 GMDR方法分析MTHFR基因2个SNPs联合作用的模型
3.1 单位点分析 结果表明,rs1801133 TT和CT/TT基因型在病例组和对照组分布的差异具有统计学意义(P<0.05),并且经过1000次置换检验后,其差异仍有统计学意义。与对照组(65.68%)相比,C等位基因频率在病例组(56.52%)显著降低(P<0.05)。携带rs1801133 TT和CT/TT基因型的个体与携带CC基因型者相比较,发生骨质疏松的风险分别增加了2.63和2.37倍[调整OR=2.63,2.37;95%CI=(1.20~5.77),(1.16~4.87)],提示T等位基因突变,可能是发生骨质疏松的危险因素。MTHFR C677T是一个最常见的不耐热错义突变,能引起酶的耐热性及活性改变。该多态性位点存在2种等位基因,即野生型C与突变型T,其基因多态性在不同国家、同一国家不同地区、同一地区不同民族或种族中的分布有显著性差异[10-12],其与骨质疏松和骨质疏松性骨折易感性的研究结论也不尽相同[7,13-14]。有关MTHFR基因多态性与绝经后妇女骨质疏松症的关系,最早是由Miyao等[5]学者于2000年首次报道;随后1项包含1748名丹麦绝经后妇女的研究也证实了MTHFR rs1801133 TT基因型与绝经后妇女的低骨矿盐密度有关,携带rs1801133 TT基因型的妇女骨折的发生率增加[6];Villadsen等[7]也有类似结果。本研究进一步证实了苏州地区汉族绝经后妇女MTHFR基因C677T位点突变与骨质疏松的发生存在相关性,并提示T等位基因可能是骨质疏松发生的独立危险因素。
3.2 单倍型分析 本研究中,单位点分析未发现rs1801131(1298A>C)位点突变与绝经后妇女骨质疏松发病风险之间存在相关性。但在单倍型分析中,与最常见的单倍型CC相比,含野生等位基因rs1801131 A的单倍型AC可以显著降低绝经后妇女骨质疏松的患病风险(P<0.05)。携带单倍型AC的个体与携带单倍型CC者相比较,发生骨质疏松的风险降低了40%[调整OR=0.60;95%CI=(0.39~0.90)]。以上结果提示,突变型rs1801131 C等位基因可能不是骨质疏松发生的独立危险因素,但当野生型rs1801131 A与rs1801133 C等位基因同时存在时,可能产生联合作用降低绝经后妇女骨质疏松发生风险。
3.3 联合作用分析 为研究MTHFR中2个多态性位点是否存在联合作用,本研究对rs1801131(1298A>C)及rs1801133(677C>T)位点进一步进行了GMDR分析。结果表明,在调整了年龄、BMI、WHR及产次等环境因素后,模型A1A2 (rs1801131, rs1801133)为最佳模型(交叉验证一致性10/10,P=0.0107),提示rs1801131和rs1801133位点在骨质疏松的发病中可能存在联合作用。 A1298C点突变是MTHFR基因另外一种常见突变,位于MTHFR基因第7外显子C端调节区域,该位点的腺苷酸突变为胞嘧啶,导致酶的活性降低[15]。MTHFR A1298C基因多态与骨质疏松及骨质疏松性骨折的关联研究不多,研究结论也存在一定争议[16-17]。既往研究认为该位点多态性对酶活性的影响小于C677T多态性。有流行病学研究表明:当研究妇女拥有相同的MTHFR 677 CC基因型时,MTHFR A1298C的 C等位基因突变也是体内Hcy浓度升高的危险因素[18-19]。本研究中,单位点分析未发现rs1801131(1298A>C)位点突变与绝经后妇女骨质疏松发病风险之间存在相关性,与既往研究结果一致。但在单倍型和GMDR分析中,rs1801131 A等位基因可能与rs1801133 C等位基因产生联合作用,并可能成为绝经后妇女骨质疏松发生过程中的保护因素。
综上所述,MTHFR基因多态性与苏州地区绝经后妇女骨质疏松的发病风险存在明显关联,携带rs1801133 TT和CT/TT基因型的个体较携带rs1801133 CC基因型的个体的发病风险明显增加;携带单倍型AC的个体与携带单倍型CC者相比较,发生骨质疏松的风险显著降低;rs1801131 位点可能与rs1801133位点产生联合作用,共同影响绝经后妇女骨质疏松的发生风险。
[参考文献]
[1] Seeman E, Eisman JA. Treatment of osteoporosis: why, whom, when and how to treat. The single most important consideration is the individual’s absolute risk of fracture [J]. Med J Aust, 2004, 180(6):298-303.
[2] 刘菊, 梅群超, 罗娜, 等.老年女性骨质疏松症患者血清骨标志物和E2含量的变化及临床意义[J]. 实用老年医学,2012, 26(6): 470-471, 479.
[3] 马丽娜, 冯明, 李耘, 等. 老年骨质疏松症患者生命质量与社会支持的关系[J]. 实用老年医学, 2013, 27 (8): 634-636.
[4] Ongphiphadhanakul B. Osteoporosis: the role of genetics and the environment[J]. Forum Nutr, 2007, 60:158-167.
[5] Miyao M, Morita H, Hosoi T, et al. Association of methylententrahydrofolate reductase (MTHFR) polymorphism with bone mineral density in postmenopausal Japanese women[J]. Calcif Tissue Int, 2000, 66(3):190-194.
[6] Abrahamsen B, Madsen JS, Tofteng CL, et al. A common methylenetetrahydrofolate reductase(C677T) polymorphism is associated with low bone mineral density and increased fracture incidence after menopause:longitudinal data from the Danish osteoporosis prevention study[J]. J Bone Miner Res, 2003, 18(4):723-729.
[7] Villadsen MM, Bünger MH, Carstens M, et al. Methylenetetrahydrofolate reductase (MTHFR) C677T polymorphism is associated with osteoporotic vertebral fractures, but is a weak predictor of BMD[J]. Osteoporos Int, 2005, 16(4):411-416.
[8] Hong X, Hau YH,Terwedow H, et al. Association of the methylenetetrahydrofolate reductase C677T polymorphism and fracture risk in Chinese postmenopausal women[J]. Bone, 2007, 40(3):737-742.
[9] Homberger A, Linnebank M, Winter C, et al. Genomic structure and transcript variants of the human methylenetetrahydrofolate reductase gene[J]. Eur J Hum Genet,2000, 8(9):725-729.
[10] Schneider JA, Rees DC, Liu YT, et al. Worldwide distribution of a common methylenetetrahydrofolate reductase mutation[J]. Am J Hum Genet, 1998, 62(5):1258-1260.
[11] Robien K, Ulrich CM. 5,10-methylenetetrahydrofolate reductase polymorphisms and leukemia risk: a HuGE minireview[J]. Am J Epidemiol, 2003, 157(7):571-582.
[12] 于佳梅, 王新春, 陈白宾, 等.中国5个民族亚甲基四氢叶酸还原酶基因多态的研究[J].人类学学报, 1998, 17(3): 242-246.
[13] Riancho JA, Valero C, Zarrabeitia MT. MTHFR polymorphism and bone mineral density: meta-analysis of published studies[J]. Calcif Tissue Int, 2006, 79(5):289-293.
[14] Jørgensen HL, Madsen JS, Madsen B, et al. Association of a common allelic polymorphism (C677T) in the methylenetetrahydrofolate reductase gene with a reduced risk of osteoporotic fractures. A case control study in Danish post-menopausal women[J]. Calcif Tissue Int, 2002, 71(5):386-392.
[15] Weisberg I, Tran P, Christensen B, et al. A second genetic polymorphism in methylenetetrahydrofolate reductase (MTHFR) associated with decreased enzyme activity[J]. Mol Genet Metab, 1998, 64(3):169-172.
[16] Zhu K, Beilby J, Dick IM, et al. The effects of homocysteine and MTHFR genotype on hip bone loss and fracture risk in elderly women[J]. Osteoporos Int, 2009, 20(7):1183-1191.
[17] Gjesdal CG, Vollset SE, Ueland PM, et al. Plasma total homocysteine level and bone mineral density: the Hordaland Homocysteine Study[J]. Arch Intern Med, 2006, 166(1):88-94.
[18] Böttiger AK, Hurtig-Wennlöf A, Sjöström M, et al.Association of total plasma homocysteine with methylenetetrahydrofolate reductase genotypes 677C>T,1 298A>C, and 1793G>A and the corresponding haplotypes in Swedish children and adolescents[J].Int J Mol Med, 2007, 19(4): 659-665.
[19] Ulvik A, Ueland PM, Fredriksen A, et al.Functional infe-rence of the methylenetetrahydrofolate reductase 677C>T and 1298A>C polymorphisms from a large-scale epidemiological study[J].Hum Genet,2007, 121(1): 57-64.

