菌根真菌对白三叶根际团聚体稳定性、球囊霉素相关土壤蛋白和糖类物质的影响
吴强盛,袁芳英,2,费永俊,李莉,黄咏明
(1.长江大学园艺园林学院,湖北 荆州434025;2.京山县农业局,湖北 荆门431800)
土壤结构指的是土壤团聚体和土壤孔隙建立的三维排列,控制着土壤水分、气体和营养物质的流动,同时也影响根系对土壤养分和水分的吸收,进而影响整个植株的生长[1]。通常,团聚体稳定性和不同粒级团聚体的含量可用于土壤结构的评价[2]。研究显示,植物根系以及土壤中一些微生物(包括丛枝菌根真菌)的菌丝和代谢产物(多糖和其他有机物)对土壤颗粒产生的胶结作用能够使土壤形成稳定性团聚体,从而改善土壤结构[1,3-6]。
丛枝菌根(arbuscular mycorrhizas,AM)指的是土壤中 AM 真菌(arbuscular mycorrhizal fungi,AMF)与80%的陆生高等植物根系形成的互惠共生体。AMF除了对宿主植物的营养和水分吸收、抗逆性、植物生长发育产生促进效应外,还可以提高植物根际土壤的理化性状[7]。AMF侵染宿主植物后形成发达的根外菌丝,这种菌丝可将土壤颗粒机械地缠绕在一起而形成团聚体[4,6],此外,AMF菌丝还能分泌一类特殊糖蛋白即球囊霉素相关土壤蛋白(glomalin-related soil protein,GRSP)[8],其在土壤团聚体稳定性中扮演着重要的角色[1]。研究表明,接种摩西球囊霉(Glomusmosseae)和根内球囊霉(G.intraradices)处理增加了紫花苜蓿(Medicagosativa)根际GRSP含量,且GRSP与团聚体稳定性间呈极显著正相关关系[9]。此外,菌根释放的GRSP粘附土壤颗粒的能力比其他土壤糖类物质强3~10倍[10],能把小的土壤颗粒粘成直径<0.25mm的微团聚体,进而形成稳定的大团聚体(>0.25mm)。因此,增加植物根际GRSP的含量能够改善土壤结构,从而有利于植物的生长。
在草地中,放牧作用通过家畜采食、践踏从而减少稳定性团聚体,土壤结构遭到破坏,土壤退化[11-12]。白三叶(Trifoliumrepens)为豆科三叶草属多年生牧草,由于其易于管理、生长快、固氮能力强等特点而被广泛应用[13-14],但也经常遭受土壤干扰,导致根际土壤结构变劣。本研究以白三叶为材料,通过接种2种AMF对其生长效应、叶绿素、根际土壤水稳性团聚体粒级的分布、团聚体稳定性、GRSP和糖类物质含量的影响,分析AMF和GRSP对团聚体稳定性的贡献,为防止土壤退化提供新的思路。
1 材料与方法
1.1 试验材料
选择白三叶作为植物研究材料。中国“丛枝菌根真菌种质资源库”(BGC)提供的地表球囊霉(Glomusversiforme)和隐内球囊霉(Paraglomusoccultum)作为供试的AMF。菌根菌剂包含感染菌根的高粱(Sorghumvulgare)根段、根外菌丝、孢子以及沸沙的混合物。试验土壤选自长江大学校内的黄棕壤,自然风干,过4mm筛,高压蒸气灭菌(121℃,0.11MPa,2h),以杀死原有的AMF孢子。2010年10月19日对白三叶种子播种,播种前预先采用70%酒精表面消毒5min,蒸馏水冲洗数次后,播种于白色塑料盆(上口径16cm、下口径11cm、盆高13 cm)基质表层0.5cm处,每盆点播35粒种子,5d后间苗至30株/盆。试验盆放置在PQX人工气候箱中,25℃白天/18℃晚上,16h光照/8h黑暗,空气湿度85%,光通量密度800μmol/(m2·s)。
1.2 试验设计
试验由3个处理组成,分别包括接种地表球囊霉、接种隐类球囊霉和不接种丛枝菌根真菌(Non-AMF)的对照。对于AMF接种处理,每盆施入15g菌剂。每个处理重复4次,每盆30株白三叶,共12盆,随机排列,定期对人工气候箱中的试验盆进行位置的置换,以减少摆放位置对试验的影响。
1.3 测定方法
经过85d培养后结束试验,随机从每处理的重复中选取15株白三叶,分成地上部和地下部,于70℃下烘干48h,然后测定各自干重。剩余每盆15株的叶片混合,采用80%丙酮溶液提取,646和663nm波长下进行比色测定叶绿素含量[15];少量根系,剪成1cm根段,经过10%KOH于90℃下透明30min,然后采用10%H2O2漂白10min以及0.2mol/L HCl酸化10min,0.05%曲利苯蓝染色10min[7],然后在生物显微镜下观察,根系菌根侵染率用感染的根段长度占检查根段总长的百分数表示。菌根依赖性用接种植株总干重与不接种植株总干重的百分比表示。
收集各处理的土壤,不同粒级团聚体比例的测定采用湿筛法[16]进行。称取过4mm筛风干土样30g,将土样依次通过从上到下孔径为2,1,0.5,0.25mm的网筛,在自来水下湿洗每个孔筛的土样,残留在各级网筛的土壤转移到预先称重的铝盒中,于100℃下烘至恒重,称重,然后计算各级团聚体的百分数。
团聚体稳定性采用平均质量直径(mean weight diameter,MWD)表示[17],具体计算公式如下:
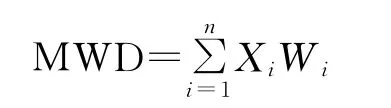
式中,Xi为任一粒级范围内水稳性团聚体的平均直径(mm),Wi为Xi的水稳性团聚体百分含量。
土壤热水提取碳水化合物(hot-water extractable carbohydrates,HWC)和土壤水解碳水化合物(hydrolyzed carbohydrates,HYC)含量采用蒽铜比色法[18]测定。取风干土样0.75g,加蒸馏水5mL,沸水浴2h,冷却后定容至50mL,吸取滤液1mL加入蒽酮试剂5mL,沸水浴15min,然后630nm波长下比色测量HWC的含量;取风干土样0.5g,加入2.5mol/L的硫酸10mL,沸水浴加热20min,过滤,定容(50mL),吸取滤液1mL,加入蒽酮试剂5mL,沸水浴15min,然后630nm波长下比色测量HYC的含量。
取1.0g风干土样,分别用20mmol/L柠檬酸缓冲液(pH 7.0)提取30min或者50mmol/L柠檬酸钠缓冲液(pH 8.0)提取60min,提取条件为0.11MPa、121℃,然后再10000r/min离心5min,分别得到土壤易提取球囊霉素相关土壤蛋白(easily extractable glomalin-related soil protein,EE-GRSP)和总球囊霉素相关土壤蛋白(total glomalin-related soil protein,T-GRSP)的提取液[19],然后采用Braford法[8]测定上清液中 GRSP的含量。
1.4 统计分析
运用SAS(8.1)软件的ANOVA过程对处理间作差异性测验,LSD法进行多重比较。
2 结果与分析
2.1 不同AMF对白三叶菌根侵染率、生物量和菌根依赖性的影响
从表1可知,未接种AMF的白三叶根系没有观察到真菌的侵染,而接种两个不同属的AMF都侵染了白三叶根系,根系菌根侵染率在35%~75%,其中隐类球囊霉对白三叶根系的侵染率最高,与地表球囊霉间差异显著。从表1还可以看出,与对照相比,两个不同属的AMF都显著增加了白三叶地上部、地下部和植株总干重,接种处理间没有表现显著的差异。
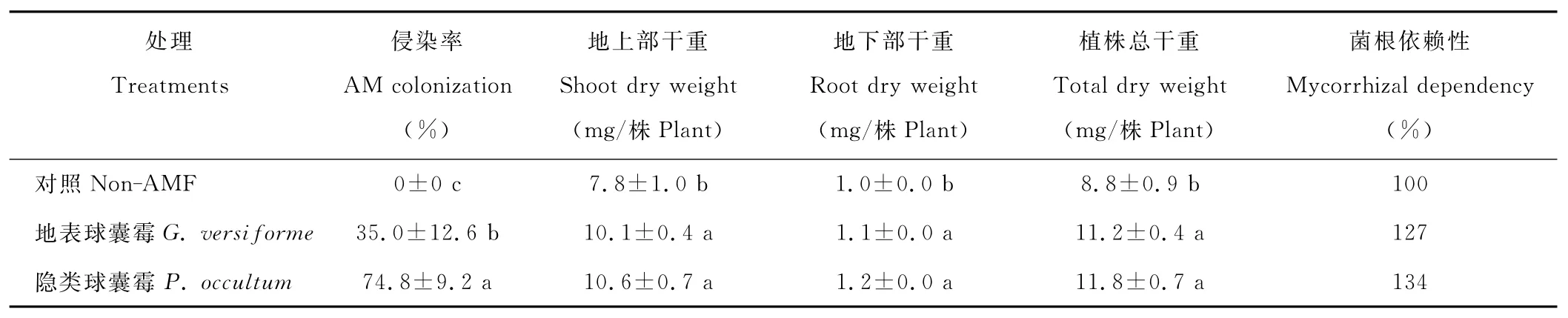
表1 两种AMF对白三叶菌根侵染率、生物量和菌根依赖性的影响Table 1 Effects of two AMF on mycorrhizal colonization,biomass production and mycorrhizal dependency of white clover
2.2 不同AMF对白三叶叶绿素含量的影响
图1显示了不同AMF接种处理对白三叶叶绿素含量的影响。结果可知,接种地表球囊霉和隐类球囊霉都显著提高了白三叶叶绿素的含量,分别提高了16.2%和23.5%。
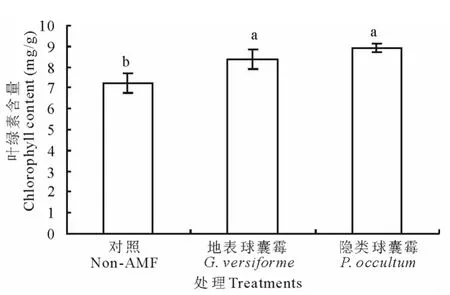
图1 两种AMF对白三叶叶绿素含量的影响Fig.1 Effect of two AMF on chlorophyll content of white clover
2.3 不同AMF对白三叶根际水稳性团聚体的粒级分布和稳定性的影响
由表2可知,两种AMF显著地降低了1~2 mm粒径土壤水稳性团聚体的含量,分别降低了52.4%和42.9%。然而,地表球囊霉和隐类球囊霉却显著增加了0.5~1mm粒径土壤水稳性团聚体的含量,分别增加了43.8%和51.0%。地表球囊霉和隐类球囊霉也显著增加了0.25~0.5mm粒径土壤水稳性团聚体的含量,分别增加了72.5%和60.2%,两种 AMF处理间差异显著(P<0.05),表现为地表球囊霉>隐类球囊霉。此外,菌根真菌接种对白三叶根际平均质量直径没有显著的影响。
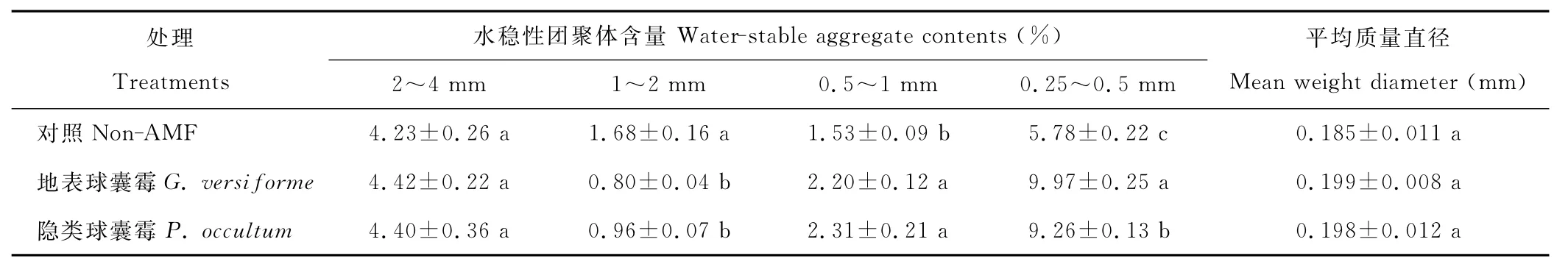
表2 两种AM真菌对白三叶根际土壤水稳性团聚体含量和平均质量直径的影响Table 2 Effects of two AM fungi on water stable aggregate contents and mean weight diameter of white clover
2.4 不同AMF对白三叶根际GRSP和糖类物质含量的影响
接种地表球囊霉和隐类球囊霉显著增加了根际土壤中EE-GRSP和T-GRSP含量,其中EE-GRSP含量分别被提高了28.6%和41.8%;T-GRSP含量分别被提高了26.9%和28.5%(图2)。
接种地表球囊霉和隐类球囊霉也显著增加了根际土壤中HWC的含量,分别增加了44.1%和14.7%,且地表球囊霉的增加效果最好,与隐类球囊霉间差异显著(P<0.05)(图3)。隐类球囊霉显著增加了根际土壤中HYC的含量,增加了44.7%,而地表球囊霉的效果不显著,两个菌种间的差异显著(图3)。
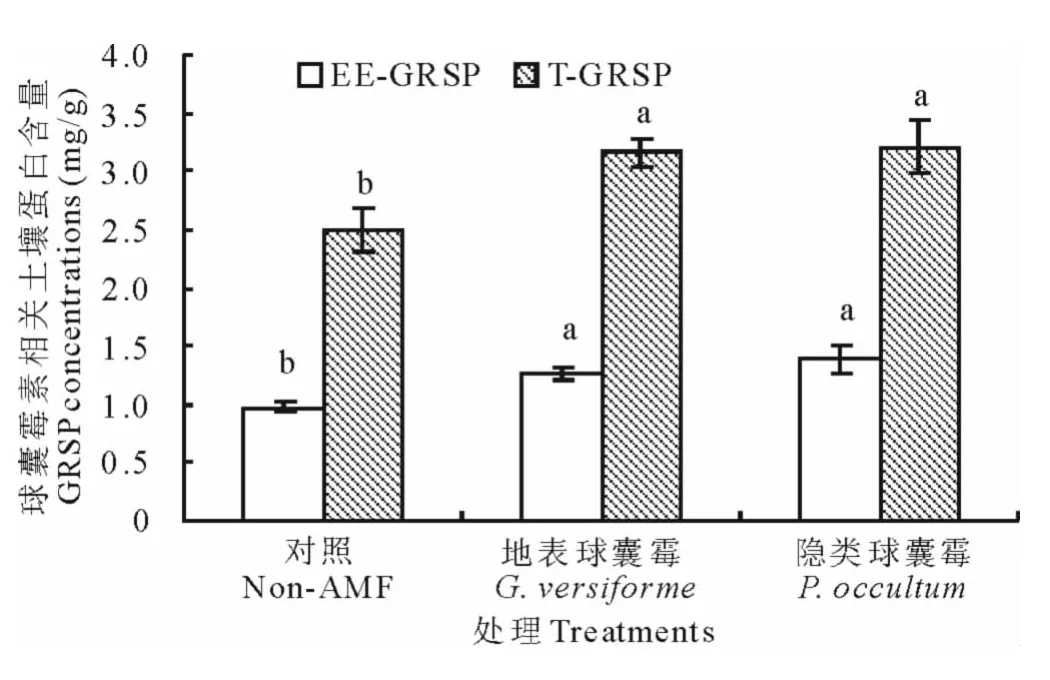
图2 两种AM真菌对白三叶根际土壤中球囊霉素相关土壤蛋白含量的影响Fig.2 Effect of two AM fungi on GRSP concentrations in rhizosphere of white clover
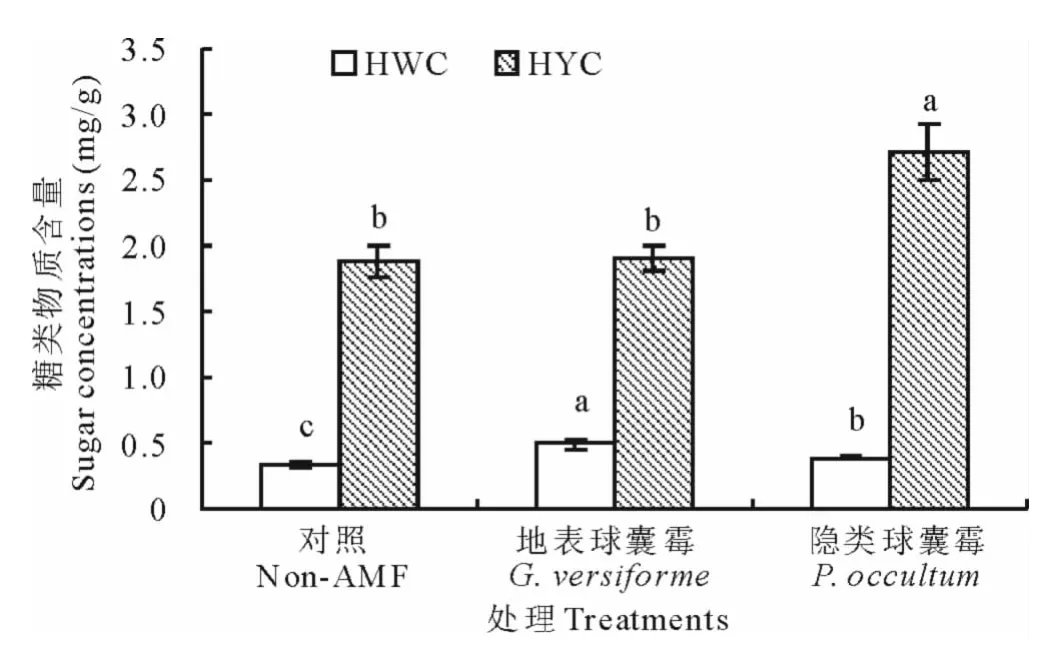
图3 两种AM真菌对白三叶根际土壤中糖类物质含量的影响Fig.3 Effect of two AM fungi on sugar concentrations in rhizosphere of white clover
2.5 白三叶根际GRSP与其他各指标间的相关性
表3显示,EE-GRSP与AMF侵染率、0.5~1mm粒径土壤水稳性团聚体、0.25~0.5mm粒径土壤水稳性团聚体间分别存在极显著的正相关关系(P<0.01),与HYC间存在显著的正相关关系(P<0.05),与1~2mm粒径土壤水稳性团聚体间存在极显著的负相关关系(P<0.01),但与2~4mm粒径土壤水稳性团聚体、MWD和HWC间未达到显著的相关关系。T-GRSP与0.5~1mm粒径土壤水稳性团聚体、0.25~0.5mm粒径土壤水稳性团聚体间分别存在极显著的正相关关系(P<0.01),与菌根侵染率、MWD和HWC间分别存在显著的正相关关系(P<0.05),与1~2mm粒径土壤水稳性团聚体间存在极显著的负相关关系(P<0.01),而与2~4mm粒径土壤水稳性团聚体和HYC间均未达到显著的相关关系。

表3 EE-GRSP和T-GRSP与其他指标间的相关系数Table 3 Pearson correlation coefficients between EE-GRSP or T-GRSP and other variables
3 讨论
3.1 AMF接种对白三叶生长的效应
本试验结果表明,接种AMF都显著增加了白三叶生物量(干重),且不依赖AMF种类,这与叶少萍等[20]在狗牙根(Cynodondactylon)上接种聚丛球囊霉(Glomusaggregatum)和摩西球囊霉的研究结果相一致。一般而言,菌根真菌对植物根系的侵染状况越好,则对植物生长的促进作用也越显著[21]。在本研究中,两种AMF都能够与白三叶根系建立良好的共生关系,特别是隐类球囊霉。已知植物90%~95%干物质积累源于光合产物[22],同时AMF的侵染能够明显提高宿主植物叶绿素含量,使得植物制造光合产物的能力增加,因而提高植株生物量[23],本研究也证明了这一点。
3.2 AMF接种对白三叶GRSP以及团聚体分布的效应
在本试验中,接种AMF处理的白三叶根际土壤EE-GRSP和T-GRSP含量均显著高于未接种处理的植株,且相关性分析显示了EE-GRSP和T-GRSP与菌根真菌侵染率间有显著或极显著的正相关关系,这与Bedini等[9]在紫花苜蓿上接种摩西球囊霉和根内球囊霉的研究结果相一致,也暗示着AMF对根系的侵染能够促进土壤中GRSP含量的提高,且优势菌种(如本研究中的隐类球囊霉)效应更强,因为GRSP的释放是源于菌根菌丝和孢子。GRSP与菌根侵染率的正相关关系对菌根改善土壤团聚体的稳定性具有重要的意义。已有研究表明,土壤中GRSP的含量与水稳性团聚体的百分含量正相关[24]。在本研究中,两种AMF仅对小粒径(0.5~1mm和0.25~0.5mm)土壤水稳性团聚体含量有显著的促进效果,却显著抑制了1~2mm粒径团聚体的形成。相关性分析也显示,GRSP与小粒径土壤水稳性团聚体间有极显著的正相关关系,这说明GRSP对团聚体的效应依赖粒级大小:对<1mm粒径团聚体的形成有显著的促进作用,对1~2mm粒径团聚体的形成有显著的抑制效应。Rillig等[25]在细茎针草(Stipatenacissima)生长土壤中也发现EE-GRSP和T-GRSP与1~2mm粒径土壤水稳性团聚体含量呈负相关关系。
3.3 GRSP对白三叶根际团聚体稳定性和糖类物质的效应
研究发现,GRSP的主要作用是改善土壤团聚体的稳定性和增加土壤有机碳库[4,26]。在本研究中,只有TGRSP与MWD呈显著的相关关系,可能由于EE-GRSP的稳定性较T-GRSP差而易转化为难提取的GRSP[27],导致T-GRSP和EE-GRSP对团聚体稳定性的分工上的差异[19]。MWD是各级水稳性团聚体的综合指标,其值主要随大粒径水稳性团聚体含量的增加而增大[17],而本实验结果显示两种AMF对白三叶根际土壤大粒径的水稳性团聚体(>2mm)含量的影响较对照差异不显著,因而接种AMF后,MWD值增加不显著。当然,团聚体稳定性除了依赖GRSP外,还依赖根系、菌丝、根系分泌物、土壤有机碳等多个因子[4,28]。因此,进一步地试验还需明确各个因子对团聚体稳定性的贡献。
由于AMF是从宿主植物(如本研究中的白三叶)获取糖类物质(主要是己糖,特别是葡萄糖)进行相关代谢活动,生长的菌丝代谢产物包括GRSP[4]。本研究结果显示,接种AMF处理显著提高了白三叶叶绿素含量,暗示了接种植株合成了更多的糖类物质[29],为菌根的发育提供了良好的碳源基础。菌根分泌的球囊霉素是土壤碳库的重要来源[4]。本试验结果显示,接种处理显著增加了HWC和HYC含量(除地表球囊霉对HYC没有差异外),其中EE-GRSP与HYC呈显著的正相关关系,而T-GRSP与HWC呈显著的正相关关系,这暗示着不同组分的GRSP对土壤不同类型糖类物质的贡献不同。
[1] Rillig M C,Wright S F,Eviner V T.The role of arbuscular mycorrhizal fungi and glomalin in soil aggregation:comparing effects of five plant species[J].Plant and Soil,2002,238:325-333.
[2] Díaz-Zorita M,Perfect E,Grove J H.Disruptive methods for assessing soil structure[J].Soil and Tillage Research,2002,64:3-22.
[3] 单贵莲,初晓辉,田青松,等.典型草原恢复演替过程中土壤性状动态变化研究[J].草业学报,2012,21(4):1-9.
[4] Rillig M C,Mummey D L.Mycorrhizas and soil structure[J].New Phytologist,2006,171:41-53.
[5] 刘中良,宇万太.土壤团聚体中有机碳研究[J].中国生态农业学报,2011,19(2):447-455.
[6] 冯固,张玉风,李晓林.丛枝菌根真菌的外生菌丝对土壤水稳性团聚体形成的影响[J].水土保持学报,2001,15(4):99-102.
[7] 吴强盛.园艺植物丛枝菌根研究与应用[M].北京:科学出版社,2010.
[8] Wright S F,Upadhyaya A.Extraction of an abundant and unusual protein from soil and comparison with hyphal protein of arbuscular mycorrhizal fungi[J].Soil Science,1996,161:575-586.
[9] Bedini S,Pellegrino E,Avio L,etal.Changes in soil aggregation and glomalin-related soil protein content as affected by arbuscular mycorrhizal fungal speciesGlomusmosseaeandGlomusintraradices[J].Soil Biology and Biochemistry,2009,41:1491-1496.
[10] Franzluebbers A J,Wright S F,Stuedemann J A.Soil aggregation and glomalin under pastures in the Southern Piedmont USA[J].Soil Science Society of America Journal,2000,64:1018-1026.
[11] 张成霞,南志标.放牧对草地土壤理化特性影响的研究进展[J].草业学报,2010,19(4):204-211.
[12] 安慧,徐坤.放牧干扰对荒漠草原土壤性状的影响[J].草业学报,2013,22(4):35-42.
[13] 卢艳敏,苏长青,李会芬.不同盐胁迫对白三叶种子萌发及幼苗生长的影响[J].草业学报,2013,22(4):123-129.
[14] 包国章,李向林,白静仁.放牧及土壤斑块质量对白三叶密度及峰值格局的影响[J].生态学报,2000,20(5):779-783.
[15] 王学奎.植物生理生化实验原理和技术(第2版)[M].北京:高等教育出版社,2008.
[16] Wu Q S,Xia R X,Zou Y N.Improved soil structure and citrus growth after inoculation with three arbuscular mycorrhizal fungi under drought stress[J].European Journal of Soil Biology,2008,44:122-128.
[17] Kemper W D,Rosenau R C.Aggregate stability and size distribution[A].Methods of Soil Analysis,Part 1.Physical and Mineralogical Methods[M].South Segoe,USA:American Society of Agronomy-Soil Science Society of America,1986:425-442.
[18] 李小刚.施用秸秆对土壤有机碳组成和结构稳定性的影响[J].土壤学报,2002,39(3):422-423.
[19] Wu Q S,He X H,Cao M Q,etal.Relationships between glomalin-related soil protein in water-stable aggregate fractions and aggregate stability in citrus rhizosphere[J].International Journal of Agriculture and Biology,2013,15:603-606.
[20] 叶少萍,曾秀华,辛国荣,等.不同磷水平下丛枝菌根真菌(AMF)对狗牙根生长与再生的影响[J].草业学报,2013,22(1):46-52.
[21] Abbott L K,Robson A D.The role of vesicular arbuscular mycorrhizal fungi in agriculture and the selection of fungi for inoculation[J].Australian Journal of Agricultural Research,1982,33:389-408.
[22] 李羿桥,李西,胡庭兴.巨桉凋落叶分解对假俭草生长及光合特性的影响[J].草业学报,2013,22(3):169-176.
[23] 李登武,王冬梅,余仲东.AM真菌与植物共生的生理生化效应研究进展[J].西北植物学报,2002,22(5):1255-1262.
[24] Wu Q S,He X H,Zou Y N,etal.Spatial distribution of glomalin-related soil protein and its relationships with root mycorrhization,soil aggregates,carbohydrates,activity of protease andβ-glucosidase in the rhizosphere ofCitrusunshiu[J].Soil Biology and Biochemistry,2012,45:181-183.
[25] Rillig M C,Maestre F T,Lamit L J.Microsite differences in fungal hyphal length,glomalin,and soil aggregate stability in semiarid Mediterranean steppes[J].Soil Biology and Biochemistry,2003,35:1257-1260.
[26] 田慧,刘晓蕾,盖京苹,等.球囊霉素及其作用研究进展[J].土壤通报,2009,40(5):1215-1220.
[27] Koide R T,Peoples M S.Behavior of Bradford-reactive substances is consistent with predictions for glomalin[J].Applied Soil Ecology,2013,63:8-14.
[28] Piotrowski J S,Denich T,Klironomos J N,etal.The effects of arbuscular mycorrhizas on soil aggregation depend on the interaction between plant and fungal species[J].New Phytologist,2004,164:365-373.
[29] 张利刚,曾凡江,刘波,等.绿洲-荒漠过渡带四种植物光合及生理特征的研究[J].草业学报,2012,21(1):103-111.

