4种地生兰菌根的显微结构研究
高 瑾,王 芳,伍建榕,
(1 西南林业大学 林学院 云南省高校森林灾害预警控制重点实验室,云南 昆明 650224;2 国家林业局 西南地区生物多样性保育重点实验室,云南 昆明 650224)
兰科是仅次于菊科的第二大科,是被子植物的最大科,全世界约有700属,近20 000种,主产于热带地区[1]。我国是兰属植物分布中心之一,且以地生兰为主,种质资源十分丰富,在中国有171属,1 247 种,在云南最多,约有100属、530多种,是世界上兰花资源最丰富的地区之一[2]。兰花大多都生长在湿润、温暖、有阳光散射且排水良好的地方,根据兰科植物生境的不同可以分为3种:地生兰、附生兰和腐生兰。地生兰一般生于有砾石和腐殖质的沙壤土中,极少数也可以生于沼泽或湿土上,常见的有兰属、兜兰属的部分种类等;附生兰一般生于树上或岩石缝隙中;腐生兰通常生长在腐殖质和枯枝落叶丰富的地方,一般自身没有叶绿素,不能进行光合作用,只能通过吸收环境中的营养物质来生存,获得的营养大部分靠真菌提供[4]。
要探明菌根真菌在兰花根部的生长状况及其侵入方式,需要进行切片观察[5]。但就目前的研究进展看,关于兰科菌根真菌对兰花组培苗生长影响的研究报道较少,仅见有对墨兰(Cymbidiumsinense)、建兰(Cymbidiumensifolium)、卡特兰(Cattleyasp.)、石斛兰(Dendrobiumsp.)、春兰(Cymbidiumgoeringii)、五唇兰(Doritispulcherrima)等[6]的研究,还未见对兜兰属植物菌根的研究报道。兰科兜兰属的兰花具有较高的观赏价值,中国是兜兰属植物物种最丰富的国家,兜兰属为热带亚洲属,主要分布于东南亚至喜马拉雅山低地再到中国西南部。目前共计有79个野生种记录在案,其中约1/3产自于中国[7]。杏黄兜兰特产于我国云南西北部福贡、碧江、泸水等县。飘带兜兰主产于云南南部,缅甸和泰国也有分布,生于海拔1 200~2 200 m的石灰岩山地林缘树上或是苔藓覆盖的岩石上[8-9]。兜兰属植物都被列为一级保护物种,但大量的人工采挖对其生境造成了破坏,故需对兜兰属植物进行保护性研究[10]。春兰和墨兰属于我国国兰,绝大部分产于热带和亚热带地区,很受国人喜欢,都是很有价值的兰花种质资源[11]。
本试验选取兰属的春兰、墨兰及兜兰属的飘带兜兰和杏黄兜兰4种地生兰,对其菌根进行石蜡切片,通过光学显微镜观察兰花根与真菌共生形成菌根的过程及菌根真菌的侵入途径,从形态学角度分析菌根真菌与兰科植物的共生关系,旨在为兰属和兜兰属植物的保护提供参考。
1 材料与方法
1.1 材 料
1.1.1 供试野生地生兰 兰科植物兰属(Cymbidium)的春兰(C.goeringii)、墨兰(C.sinense)分别采自云南保山和西双版纳;兜兰属(Paphiopedilum)的杏黄兜兰(P.armeniacum)、飘带兜兰(P.parishii)分别采自云南文山和勐腊。
1.1.2 供试菌根真菌 共生真菌菌株CLB113、CLB111分离自野生地生兰菌根,现保存于西南林业大学。
1.2 方 法
1.2.1 无菌组培苗的培育[6,12]将春兰、墨兰、飘带兜兰和杏黄兜兰4种地生兰种子无菌萌发形成的原球茎,作为外植体进行组织培养,原球茎分化形成完整的兰花苗,即为无菌组培苗。当每株地生兰苗生长至8~10片叶、株高10~18 cm、根长7~8 cm时,取出待用。
1.2.2 地生兰与真菌的共生培养 将4种地生兰无菌组培苗从光照培养箱(25 ℃,2 000 lx)中取出,置于室温条件下培养1周进行练苗,之后取出幼苗,冲洗掉附在根部的琼脂块,种植到装有栽培基质的花盆中,同时将感染真菌CLB113、CLB111的麻栎叶放入根的周围,与根相距0.5 cm,进行共生培养1年。
1.2.3 石蜡切片的制作 取长度3~5 cm 的野生地生兰颜色泛黄的新鲜根段及其无菌组培苗的根段,以流水冲洗干净,吸水纸吸干水分,切成 2~4 mm厚的小薄片,迅速放入FAA液中固定48 h,抽气、梯度脱水、石蜡包埋,再用番红、固绿染色,旋转连续切片机切成厚度为8 μm的薄片,中性树胶封片。15 d后用二甲苯擦去多余的树胶即可观察。在光学显微镜下观察菌丝的特点,并记录拍照(Nikon-E800)[13-14]。
2 结果与分析
2.1 不同地生兰根部结构的比较
观察发现,4种野生地生兰的菌根呈现褐黄色或是灰色,有的根段有乳白色根尖,这是刚生长出的新根,且新根中还没有菌丝定殖。无菌组培苗的根段为细长的圆柱形,呈乳白色。鉴于4种野生地生兰菌根与其无菌组培苗营养根的基本结构相同,故本研究以杏黄兜兰和春兰为例进行分析。显微观察发现,在杏黄兜兰和春兰中,无菌组培苗营养根与菌根的结构相同,从外到内分别包括根被、皮层和髓 3部分(图1~4),皮层包括外皮层、中皮层和内皮层3部分。此外,在墨兰的皮层组织中,可以观察到有针状结晶(图5)。针状结晶常分布于与外皮层相邻的几层皮层细胞中,研究表明,这些针状结晶是植酸钙镁,皮层细胞中的这种结晶可能也是这类物质[15]。

图1 杏黄兜兰种子萌发无菌组培苗营养根的显微结构

图3 春兰种子萌发无菌组培苗营养根的显微结构

图5 墨兰营养根皮层细胞中的针状结晶
观察发现,虽然4种野生地生兰的根与无菌组培苗营养根的结构基本相似,但在细胞大小、层数以及排列上等有差异。4种地生兰无菌组培苗营养根结构的比较见表1。由表1可知,兰属中春兰和墨兰无菌组培苗的营养根较粗大,直径均为4~6 mm,兜兰属中杏黄兜兰和飘带兜兰无菌组培苗的营养根较细,直径分别为2~4,3~5 mm,这可能与植株大小以及生长环境有关。飘带兜兰的根被细胞层数最多,其次是春兰和墨兰,杏黄兜兰的最少。4种地生兰无菌组培苗营养根的外皮层、内皮层和中皮层细胞层数均相同,但中皮层厚度不同,其中飘带兜兰中皮层最厚,为220~240 μm,这是因为其细胞较大;其次是春兰、墨兰;杏黄兜兰的中皮层最薄。这4种地生兰无菌组培苗营养根均无根毛。
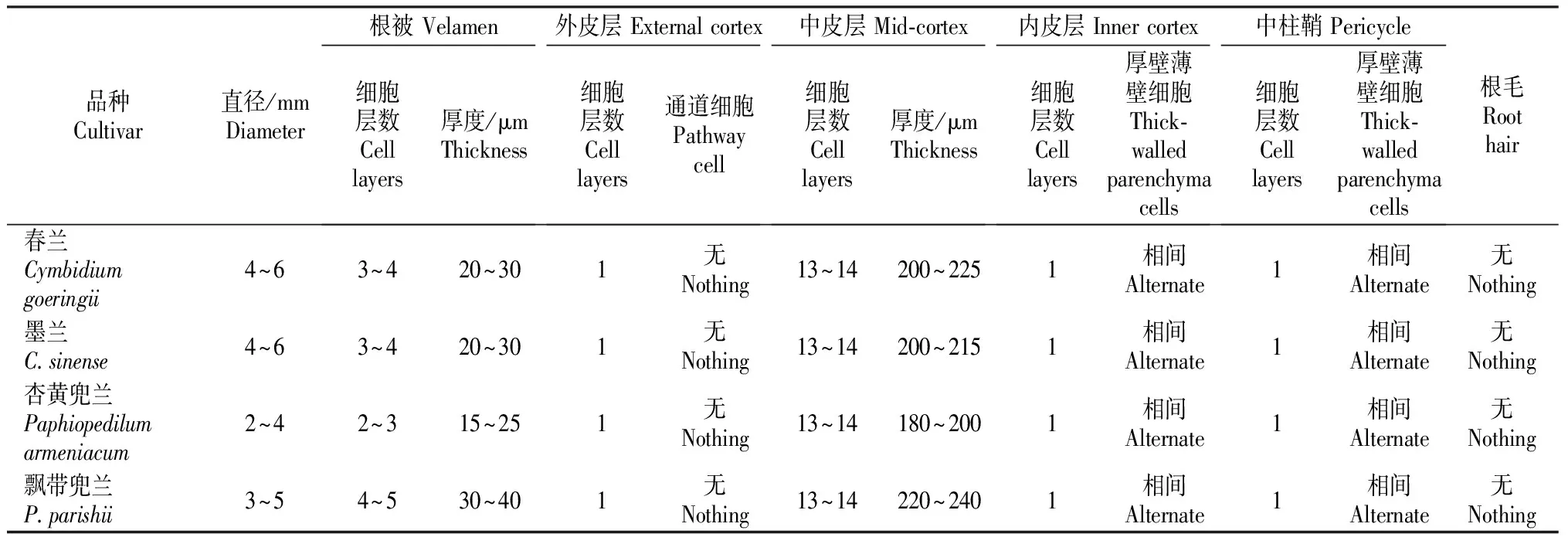
表1 4种地生兰无菌组培苗营养根结构的比较
2.2 4种地生兰真菌菌丝的入侵、消解过程
一般真菌侵入兰科植物根部分为2种方式:一种是菌根真菌破坏根被侵入到皮层细胞中, 另一种是根被细胞中存在通道细胞,菌丝穿过通道细胞到达皮层[16-18]。本研究在 4种地生兰菌根中均观察了菌丝侵入根部组织的过程,在根被细胞中未看到通道细胞,可知菌丝通过破坏根被细胞到达皮层组织(图6)。在菌丝侵入早期阶段,其会破坏根被细胞进入皮层细胞,此时能看到清晰的菌丝形态,且皮层组织中还无菌丝结存在;中期阶段,可观察到菌丝围绕在皮层细胞核周围,形成典型的菌丝结;后期阶段,随着菌丝向内皮层移动,已经形成的菌丝结被吸收,菌丝结消解形成残片,新定殖的菌丝又形成新的菌丝结,伴随新菌丝的生长和侵入,菌根真菌可不断地为地生兰的生长提供营养,促进其快速生长发育(图7~9)。

图6 菌丝破坏根被侵入皮层组织后春兰菌根结构的显微观察

图7 菌丝侵入皮层组织不同阶段的墨兰菌根显微观察

图8 菌丝侵入皮层组织不同阶段的杏黄兜兰菌根显微观察
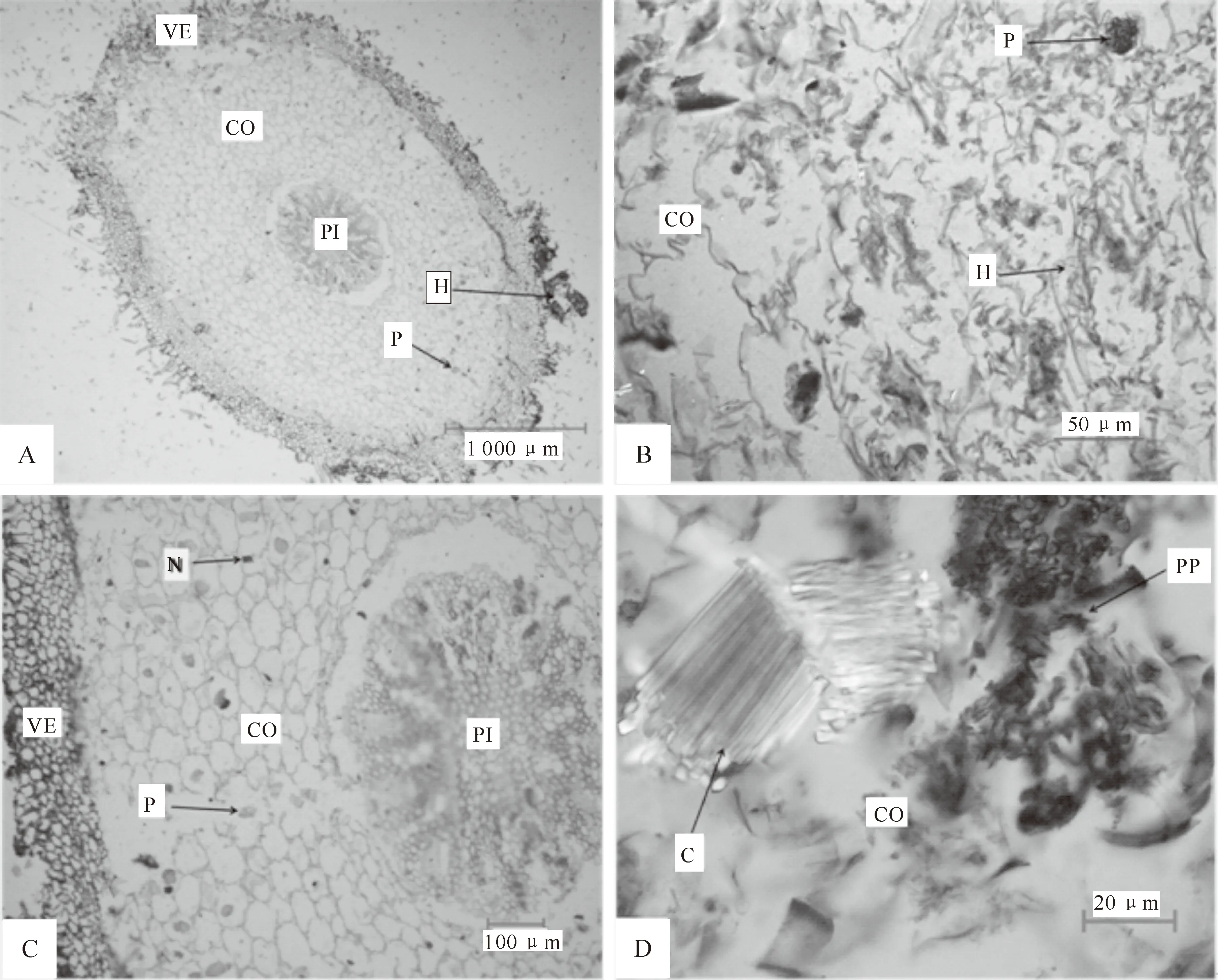
图9 菌丝侵入皮层组织不同阶段的飘带兜兰菌根显微观察
2.3 4种地生兰菌根皮层中菌丝形态的变化
地生兰菌根具有典型的兰科菌根结构,菌丝集中在皮层细胞的细胞核周围,细胞核膨大形成菌丝结。菌丝很少存在于皮层细胞的细胞间隙中,因此在皮层中未见哈蒂氏网,在根的表面也不能形成菌套。地生兰菌根真菌是一种内生真菌,在地生兰生长的各个时期,菌根真菌对地生兰的生长都具有一定的作用。本研究观察发现,在地生兰根部有3种不同形态的菌丝,分别为丝状菌丝、菌丝结和菌丝结残片。丝状菌丝在真菌刚侵入皮层细胞时呈现蓝绿色,这些新入侵的丝状菌丝向皮层细胞核靠近,为下一步形成菌丝结做准备。新入侵的丝状菌丝缠绕在皮层细胞核周围,细胞核膨大成团状,形成了棕红色或咖啡色菌丝结。菌丝结形成之后,细胞便会分泌化学物质将其包围、消解,在皮层细胞中能清晰地观察到被消解后的菌丝结残片(图7~9)。而在相应的无菌组培苗营养根中未观察到真菌入侵的迹象,在皮层部位也无菌丝结。有时在地生兰菌根同一皮层组织的不同部位可同时观察到3种不同形态的菌丝存在,随采样季节不同,可观察到菌丝的形态不同,由此推断,在真菌与地生兰的共生过程中,3个阶段是连续进行的,相邻细胞之间虽然不是完全同步,但相互之间不会产生影响。
通过对4种地生兰不同季节菌根内菌丝状态及数量比较,可知菌丝结和菌丝残片在菌根中所占的比例因季节的不同而有所差异。春兰的花期为1-3月,墨兰为10月-翌年3月,杏黄兜兰为2-4月,飘带兜兰为6-7月,切片观察发现,在花期以及花期前后4种地生兰菌丝结和菌丝结残片较多,而在生长季节丝状菌丝较多(表2)。

表2 4种地生兰不同季节菌根内菌丝的组成
3 结论与讨论
兰科植物(Orchidaceae)是典型的菌根(mycorrhizal)植物,不仅在种子萌发阶段与真菌有着密不可分的联系,在幼苗和成年期仍需要真菌为其提供营养。兰科植物菌根真菌入侵根部有2个时期,第一个时期是在种子萌发时,真菌穿过胚根的细胞壁,侵入细胞进行生长,此时可以为种子的萌发提供营养物质;第二个时期是在胚芽形成幼根之后,菌根真菌侵入根部皮层细胞。天麻是兰科植物的代表种。徐锦堂等[19]从天麻根中分离到紫萁小菇(Mycenaosmundicola)和蜜环菌(Armiuariamellea),结果表明,天麻种子可与紫萁小菇共生萌发形成原球茎。形成原球茎之后,就需要蜜环菌的侵入。说明兰科植物在生长的不同时期,需要不同的真菌与其共生。菌根真菌侵入皮层细胞有2种方式,一种是在根被细胞中存在通道细胞时,菌根真菌通过根被细胞中的通道细胞进入,根被中的通道细胞为活细胞,壁薄,具细胞核,其他细胞通常是密集的厚壁死细胞;另一种是在根被中不存在通道细胞时,菌根真菌通过直接破坏根被细胞进入皮层细胞[20]。
本研究发现,地生兰与菌根真菌共生时,菌根真菌破坏根被侵入其皮层细胞内,在皮层细胞核周围形成菌丝结,菌丝结被消解吸收之后,周围的菌丝会继续形成新的菌丝结。伴随新菌丝的生长和侵入,菌根真菌可不断地为地生兰提供营养物质,促进其快速生长发育。本研究观察发现,成年的野生地生兰根细胞内包含2种菌丝,一种是菌丝团状的,菌根真菌侵入地生兰的营养根后,在皮层细胞内形成螺旋状的菌丝结或是不规则形状的菌丝附属物,这种菌丝团寿命不长,几天之内就会逐渐被皮层细胞消解吸收;另一种是非菌丝团状的,这种菌丝会在先前的菌丝团被消解之后重新定殖形成新的菌丝团,这个过程不断重复。
本研究通过4种地生兰根部结构的显微切片,观察到了菌根真菌菌丝在地生兰根部皮层组织中的定殖及消解过程,但地生兰的皮层组织细胞分泌了何种物质及如何将菌丝结消解吸收,还有待进一步研究。此外,关于地生兰与菌根真菌的共生关系,到底是偏利共生还是互利共生,也有待从营养物质流向以及生长状态等方面进行深入研究。通过对4种地生兰不同季节菌根内菌丝状态及数量的比较发现,菌丝结和菌丝残片在菌根中所占的比例依季节的不同而有所不同。关于菌丝的形态在花期及生长期不同的原因还有待进一步研究。
[参考文献]
[1] 黄运峰,杨小波.兰科菌根研究综述 [J].热带亚热带植物学报,2008,16(3):283-288.
Huang Y F,Yang X B.Summary of research on orchidaceous mycorrhizae [J].Journal of Tropical and Subtropical Botany,2008,16(3):283-288.(in Chinese)
[2] Rasmussen H N.Recent developments in the study of orchid mycorrhiza [J].Plant and Soil,2002(244):149-163.
[3] 周玉杰,宋希强,朱国鹏.兰科植物菌根营养研究与展望 [J].热带农业科学,2009,29(2):83-87.
Zhou Y J,Song X Q,Zhu G P.Research and prospect for nutrition of orchid mycorrhiza [J].Chinese Journal of Tropical Agriculture,2009,29(2):83-87.(in Chinese)
[4] 刘仲健,陈心启,茹正忠,等.中国兰属植物 [M].北京:科学出版社,2009.
Liu Z J,Chen X Q,Ru Z Z,et al.The genusCymbidiumin China [M].Beijing:Science Press,2009.(in Chinese)
[5] 伍建榕.云南濒危野生兰花与菌根真菌的相互关系研究 [D].南京:南京林业大学,2005:79-88.
Wu J R.Studies on endangerous wild orchids and its relationship with mycorrhizal fungi in Yunnan Province [D].Nanjing:Nanjing Forestry University,2005:79-88.(in Chinese)
[6] 伍建榕,吕 梅,刘婷婷,等.6种兰科植物菌根的显微及超微结构研究 [J].西北农林科技大学学报:自然科学版,2009,37(7):199-207.
Wu J R,Lü M,Liu T T,et al.Study on observation of the mycorrhiza under optical and electronic microscope of six orchids [J].Journal of Northwest A&F University:Nat Sci Ed,2009,37(7):199-207.(in Chinese)
[7] 吕 梅,伍建榕,马焕成.春兰菌根的显微结构观察 [J].西南林学院学报,2005,25(2):8-11.
Lü M,Wu J R,Ma H C.Observation of the microstructure ofCymbidiumgoeringiimycorrhiza [J].Journal of Southwest Forestry College,2005,25(2):8-11.(in Chinese)
[8] 刘仲健,陈心启,陈利君,等.中国兜兰属植物 [M].北京:科学出版社,2009.
Liu Z J,Chen X Q,Chen L J,et al.The genusPaphiopedilumin China [M].Beijing:Science Press,2009.(in Chinese)
[9] 罗毅波,贾建生,王春玲.初论中国兜兰属植物的保护策略及其潜在资源优势 [J].生物多样性,2013,11(6):491-498.
Luo Y B,Jia J S,Wang C L.Conservation strategy and potential advantages of the ChinesePaphiopedilum[J].Biodiversity Science,2013,11(6):491-498.(in Chinese)
[10] 陈心启,吉占和.中国兰花全书 [M].北京:中国林业出版社,1998.
Chen X Q,Ji Z H.The orchid of China [M].Beijing:China Forestry Publishing House,1998.(in Chinese)
[11] 李 明.兰花菌根研究及应用 [M].昆明:云南大学出版社,2006.
Li M.Orchid mycorrhizal research and application [M].Kunming:Yunnan University Press,2006.(in Chinese)
[12] 丁 晖,韩素芬,王光萍,等.卡特兰与丝核菌共培养体系的建立及卡特兰菌根显微结构的研究 [J].菌物系统,2002,21(3):425-429.
Ding H,Han S F,Wang G P,et al.Symbiosis betweenCattleyasp.andRhizoctoniasp.and mycorrhizal microstructure ofCattleyasp. [J].Mycosystema,2002,21(3):425-429.(in Chinese)
[13] 范 黎,郭顺星,肖培根.密花石斛等兰科植物菌根的显微结构研究 [J].植物学报,2000,17(1):73-79.
Fan L,Guo S X,Xiao P G.A study on the mycorrhizal microstructure of six orchids [J].Journal of Integrative Plant Biology,2000,17(1):73-79.(in Chinese)
[14] 伍建榕,韩素芬,朱有勇,等.春兰与丝核菌共培养体系的建立及菌根显微结构研究 [J].南京林业大学学报,2005,29(4):105-108.
Wu J R,Han S F,Zhu Y Y,et al.Ultrastructure of symbiosismy corrhizal betweenCymbidiumgoeringiiandRhizoctoniasp. [J].Journal of Nanjing Forestry University,2005,29(4):105-108.(in Chinese)
[15] Rasmussen H N.Cell differentiation and mycorrhizal infection inDactylorhizamajalis(Rchb.F) Hunt & Summerh (Orchidaceae) during germinationinvitro[J].New Phytologist,1990,116(1):137-147.
[16] 胡 陶,李潞滨,杨 凯,等.中国兰属植物菌根真菌的分离与鉴定 [J].北京林业大学学报,2008,30(3):132-135.
Hu T,Li L B,Yang K,et al.Isolation and identification ofCymbidiummycorrhizaeof China [J].Journal of Beijing Forestry University,2008,30(3):132-135.(in Chinese)
[17] 刘润进,陈应龙.菌根学 [M].北京:科学出版社,2007.
Liu R J,Chen Y L.Mycorrhizology [M].Beijing:Science Press,2007.(in Chinese)
[18] Yagame T,Yamato M,Suzuki A,et al.Ceratobasidiaceae mycorrhizal fungi isolated from nonphotosynthetic orchidChamaegastrodiasikokiana[J].Mycorrhiza,2008,18:97-101.
[19] 徐锦堂,郭顺星,范 黎,等.天麻种子与小菇属真菌共生萌发的研究 [J].菌物系统,2001,20(1):137-141.
Xu J T,Guo S X,Fan L,et al.Gastrodia seed and small mushroom fungi researchinvitroseed germination [J].Mycosytem,2001,20(1):137-141.(in Chinese)
[20] Alexander C,Hadley G.Carbon movement between host and mycorrhizal endophyte during the development of the orchidGoodyerarepensBr. [J].New Phytologist,1985,101(4):657-665.

