黄瓜高频再生体系的建立
万旭花,陈书霞,申晓青,陈为峰,张然然,成思琼
(西北农林科技大学 园艺学院,陕西 杨凌 712100)
黄瓜(CucumissativusL.)为葫芦科黄瓜属1年生草本植物,具有较高的营养价值和食疗作用,尤其是具有独特的清香风味,广受消费者喜爱。在长期的定向选择和育种实践中,人们倾向于选择抗病优质的黄瓜品种,这造成黄瓜遗传基础狭窄,因此常规育种的发展面临着桎梏。利用基因工程进行黄瓜新种质创制已成为重要的手段之一[1-2],其中通过遗传转化途径进行新种质创制的前提是建立黄瓜的高频再生体系[3-4]。
关于黄瓜离体再生已有许多报道。前人从不同外植体类型如子叶[5-6]、子叶节[7-8]、下胚轴[9]、真叶[10],不同的激素组合[11-14]和苗龄[15-16]等方面,研究了不同因素对黄瓜再生体系建立的影响,结果表明,不同基因型黄瓜适宜的激素组合及浓度不同[13-17],子叶切割及接种方式会对黄瓜再生效率产生重要影响[7-8],由此可见,不同因素对再生频率的影响很大[17-20]。在具体实践中,仍存在黄瓜再生率较低、重复性差、培养周期长等问题。因此,在实际操作中,需要进一步对上述影响因素进行优化和探索。本试验在前人研究的基础上,对影响欧洲型黄瓜和华北型黄瓜种质再生体系的因素进行了优化研究,以期为黄瓜种质的遗传转化奠定技术基础。
1 材料与方法
1.1 材 料
华北型黄瓜26号种质、欧洲型黄瓜14-1种质,均由西北农林科技大学园艺学院黄瓜课题组提供。
1.2 方 法
试验在西北农林科技大学园艺学院农业部西北地区园艺作物生物学与种质创新重点实验室进行。
1.2.1 黄瓜无菌苗的获得 挑选颗粒饱满一致的黄瓜种子,用体积分数75%的乙醇消毒90 s,再用体积分数30%的次氯酸钠消毒25 min,期间不断摇动,消毒后用无菌水冲洗4~5次,无菌滤纸吸干水分后,接种于装有MS 培养基的三角瓶中,每瓶接种8粒种子,遮光培养2~3 d后,置于室温22~25 ℃、光照时间16 h/d、光照强度2 000 lx条件下培养5 d,即可获得无菌苗。
1.2.2 黄瓜芽诱导培养基的激素配比 芽诱导培养基为:MS附加不同质量浓度的6-BA(0.5,1.0,2.0,3.0,4.0 mg/L)和IAA(0.1,0.2,0.3,0.4,0.5 mg/L),MS附加不同质量浓度的6-BA(0.5,1.0,2.0,3.0,4.0 mg/L)和ABA(0.1,0.5,1.0,1.5,2.0 mg/L),另附加7 g/L琼脂和30 g/L蔗糖,pH 5.8。在上述添加不同激素配比的MS培养基上进行芽诱导,每处理接种30个外植体,重复3次。培养条件同1.2.1。芽诱导10~15 d后,统计各处理丛生芽诱导及芽生长情况,确定最适宜的芽诱导培养基。
1.2.3 AgNO3质量浓度对黄瓜芽诱导的影响 为了研究AgNO3质量浓度对黄瓜芽诱导及生长的影响,在筛选出的芽诱导培养基中,分别附加不同质量浓度的AgNO3(0,0.5,1.0,1.5,2.0,2.5,3.0 mg/L),培养条件同1.2.1。每处理接种30个外植体,重复3次。培养2周后观察统计不定芽数目及生长情况。
1.2.4 苗龄对黄瓜芽诱导的影响 分别以培养4,5,6,7 d的14-1无菌苗为材料,切去子叶端部2/3并附带1 mm的子叶柄,采用竖直方式插入MS+3.0 mg/L 6-BA+2.0 mg/L ABA+1.0 mg/L AgNO3培养基中,培养条件同1.2.1。每处理接种30个外植体,重复3次。培养2周后观察统计不定芽数目及生长情况。
1.2.6 接种方式对黄瓜芽诱导的影响 以5 d苗龄的14-1无菌苗为材料,切除子叶端部2/3并附带1 mm的子叶柄,以此为外植体分别以竖直插入(b1)、叶背向下平接(b2)、叶背向下子叶柄微插入(b3)的方式,接种于MS+3.0 mg/L 6-BA+2.0 mg/L ABA+1.0 mg/L AgNO3培养基中,培养条件同1.2.1。培养2周后观察并统计再生芽。
1.2.7 黄瓜不定芽的伸长及生根培养 芽伸长培养按照金宝燕等[21]的方法进行。切取再生芽转入含有0.5 mg/L 6-BA的MS培养基中进行芽伸长培养,待芽伸长到1.5 cm左右,从主茎基部切取伸长的芽转入1/2 MS培养基中进行生根培养。
1.2.8 数据调查与统计 接种外植体后进行出芽率及出芽系数的统计[8]。
再生率=出芽外植体数/接种总外植体数×100%;
再生系数=出芽总数/接种总外植体数。
2 结果与分析
2.1 不同激素组合对黄瓜再生的影响
2.1.1 6-BA和IAA不同质量浓度组合对黄瓜子叶节再生的影响 由表1可知,适宜的6-BA和IAA激素配比能够诱导14-1和26号黄瓜种质子叶节芽的再生,但不同的激素组合对芽的再生效率不同。随着6-BA质量浓度的增大,黄瓜子叶芽再生率和再生系数呈增大趋势,但在一定质量浓度(≥2.0 mg/L)的6-BA下,芽再生率和再生系数随着IAA质量浓度的增大先增加后减小。较低的6-BA质量浓度(0.5~1.0 mg/L)及较高的IAA质量浓度(0.3~0.5 mg/L)组合时,不能有效地诱导不定芽的产生。在激素组合为4.0 mg/L 6-BA+0.2 mg/L IAA的MS培养基上,14-1的子叶节不定芽的再生效果较好,再生率可达76.70%,再生系数可达2.08(图1B)。 26号子叶节的再生随激素质量浓度的变化趋势同14-1,但其在激素组合为4.0 mg/L 6-BA+0.3 mg/L IAA的MS培养基上再生效率较高,再生芽的生长状态良好,再生率和再生系数分别可达78.67%和2.10。
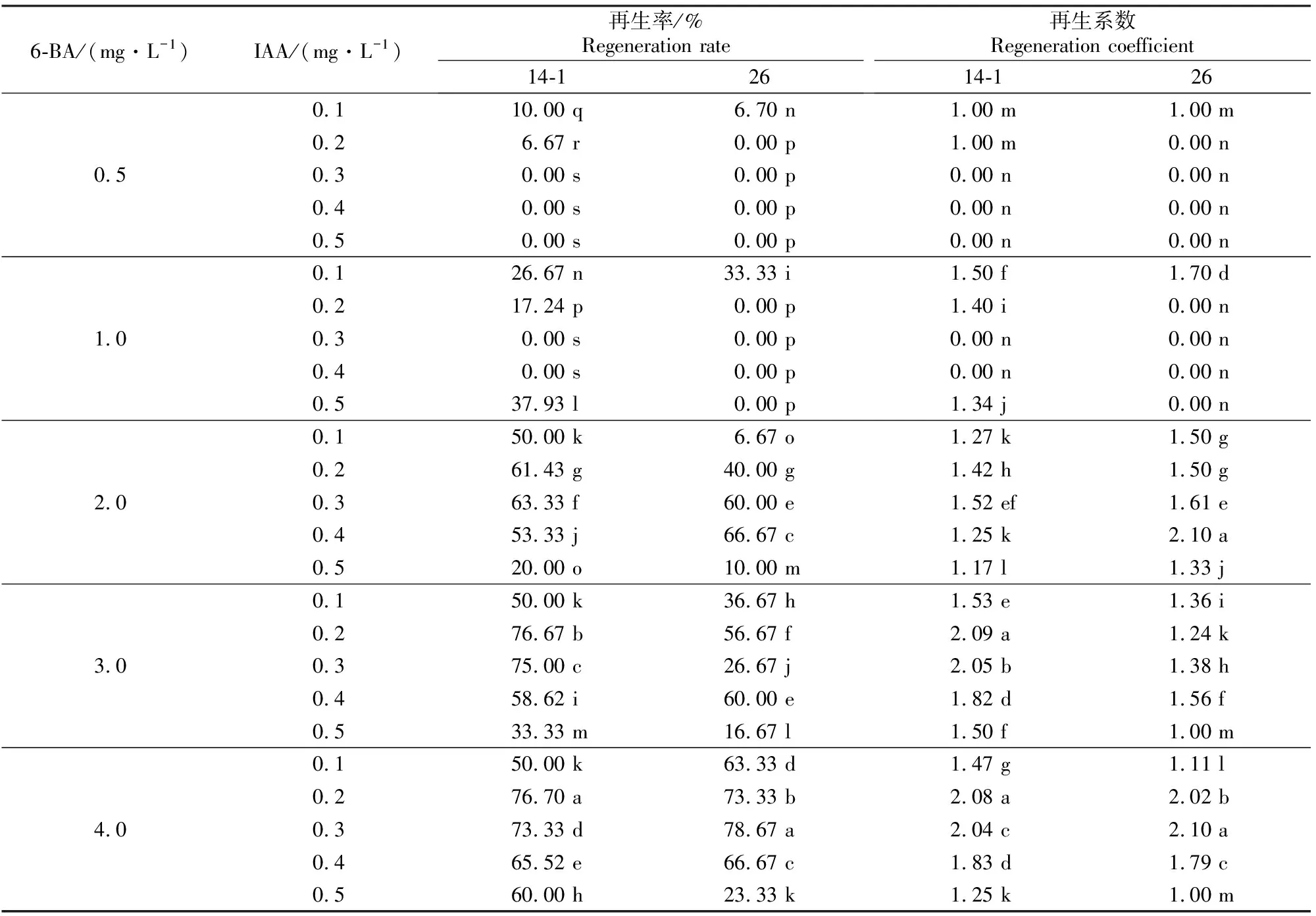
表 1 6-BA和IAA不同质量浓度组合对黄瓜子叶节再生的影响
2.1.2 6-BA和ABA不同质量浓度组合对黄瓜子叶节再生的影响 分别对14-1和26号黄瓜种质的子叶节进行6-BA和ABA组合的芽诱导试验,10 d 后可见2份种质的子叶节处都有芽点出现。在芽诱导培养基上继续培养到15 ~18 d后,子叶节部位有大量丛生芽点出现,且芽点略有伸长。由表2可知,不同激素组合对不同基因型黄瓜芽再生率的影响不同。较低质量浓度的6-BA (0.5~1.0 mg/L)与较高质量浓度的ABA(2.0 mg/L)组合时,14-1种质的子叶节不能诱导出不定芽;而在较低质量浓度的6-BA(0.5~1.0 mg/L)下,26号种质的子叶节芽再生率高于14-1。14-1种质的子叶节在3.0 mg/L 6-BA与2.0 mg/L ABA组合时再生效果较好,再生率为78.30%,再生系数为2.14(图1C);而26号种质的子叶节则在4.0 mg/L 6-BA与1.5 mg/L ABA 组合时再生效果较好,再生率可达 73.33%,再生系数可达2.08。
党的十九大报告指出:中国特色社会主义进入新时代,我国社会的主要矛盾已经转化为人民日益增长的美好生活需要和不平衡不充分的发展之间的矛盾。人民需要什么,需要解决什么,这是党面临的主要任务,是党的奋斗目标,党的十九大报告对此指明了方向。生老病死是人生常态,生而快乐、老有所养、病有所医、死而安详,无疑是人民美好生活的具体体现。上述两个案例说明,我国医疗保障还有不如意的地方,30多年医疗改革还存在不够彻底的地方。基于此,对进一步完善我国医疗改革提出如下建议。
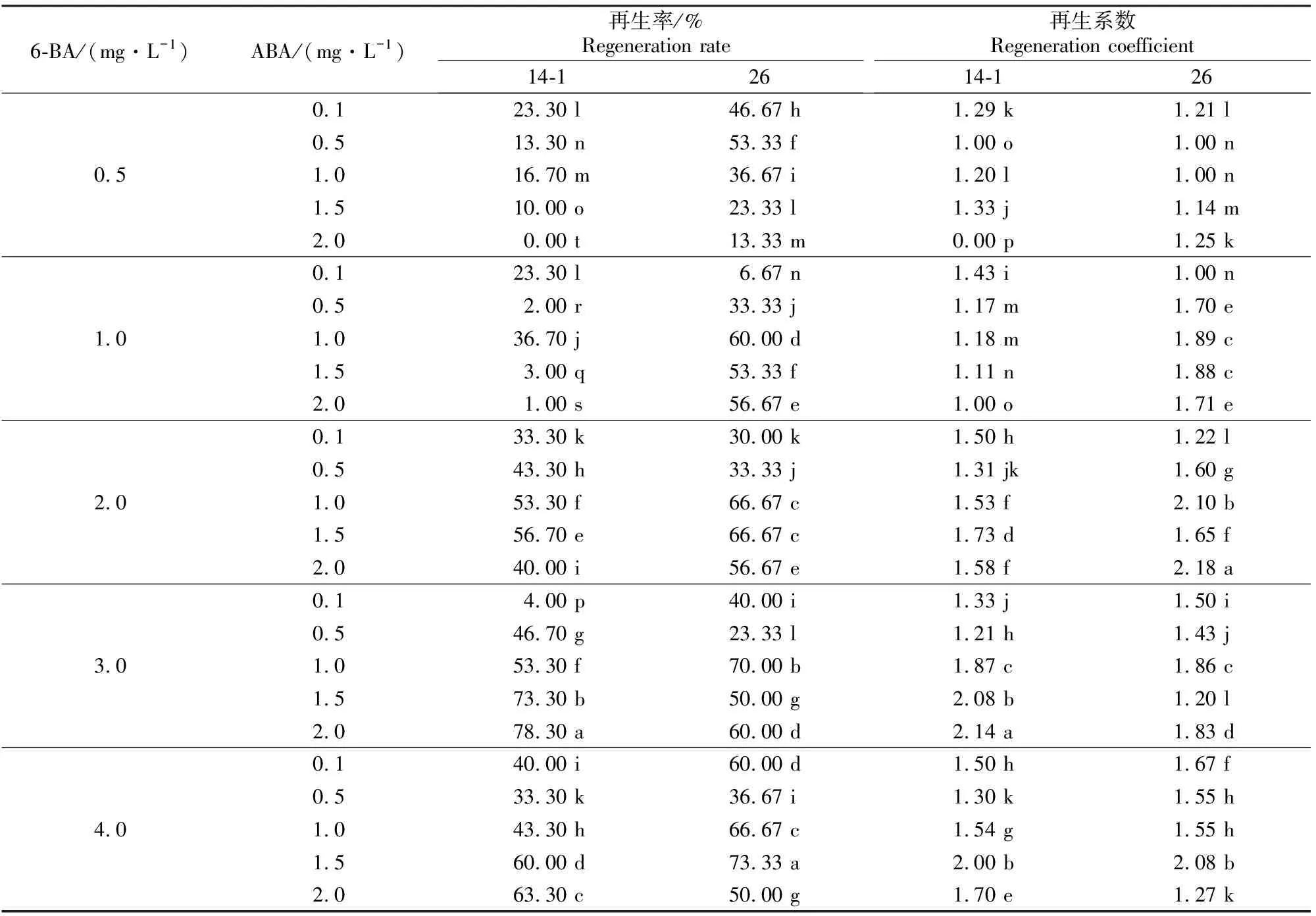
表 2 6-BA和ABA不同质量浓度组合对黄瓜子叶节再生的影响
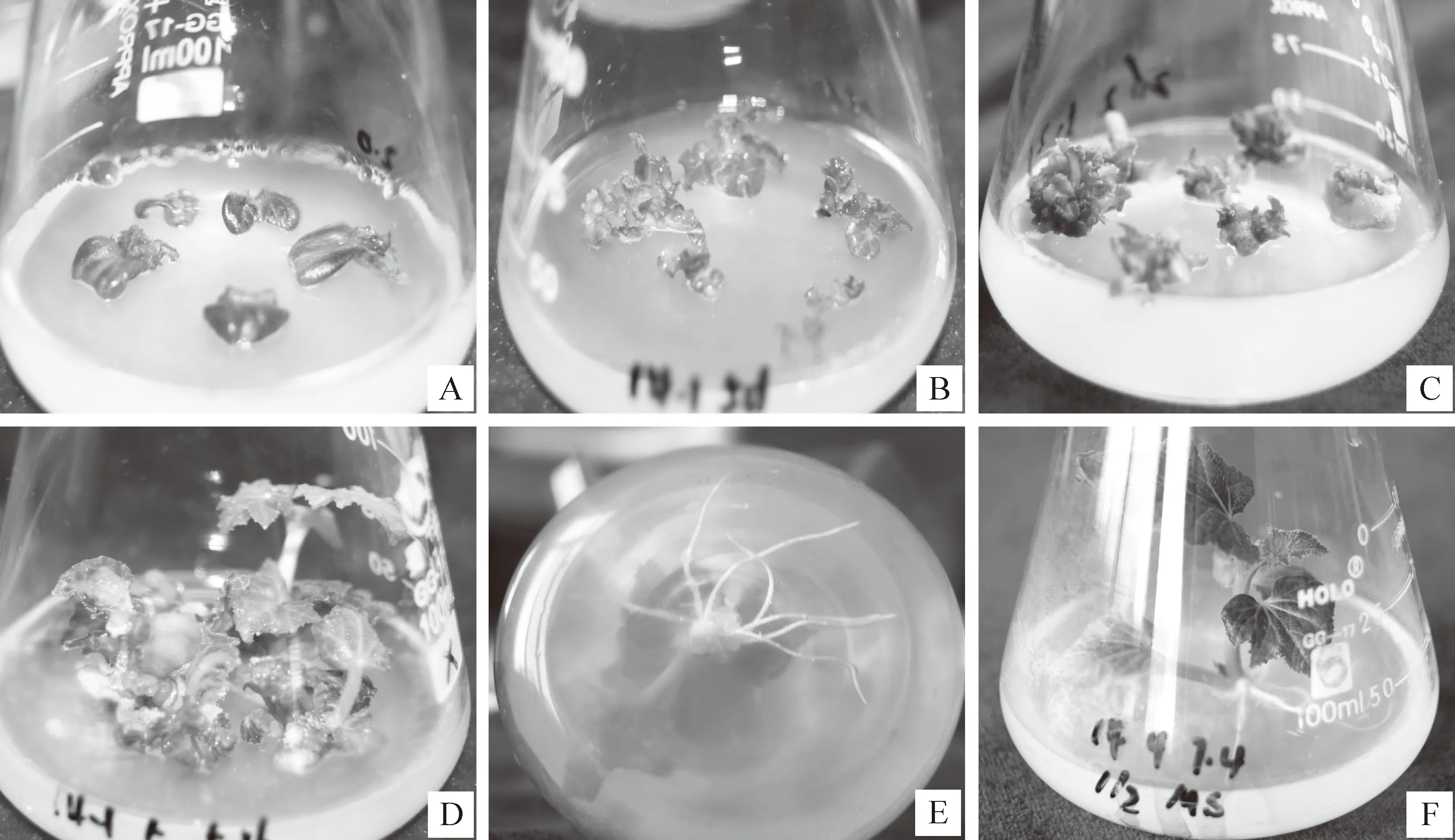
图 1 黄瓜种质14-1子叶节芽的再生过程
2.2 AgNO3质量浓度对黄瓜子叶节再生的影响
14-1和 26号黄瓜种质的子叶节分别在添加 3.0 mg/L 6-BA+2.0 mg/L ABA、4.0 mg/L 6-BA+0.3 mg/L IAA的MS培养基上,进行不同AgNO3质量浓度对黄瓜子叶节再生的影响试验,结果见表3。由表3可知,0.5~1.5 mg/L的 AgNO3对黄瓜子叶节不定芽的生成都有促进作用,且与不加AgNO3时相比差异显著,其中以AgNO3为1.0 mg/L时再生效果最好,14-1和26号的再生率分别达到86.70%和85.00%,再生系数分别达到 2.77 和2.51;当AgNO3质量浓度≥2.0 mg/L时芽的再生受到抑制,再生率和再生系数降低。
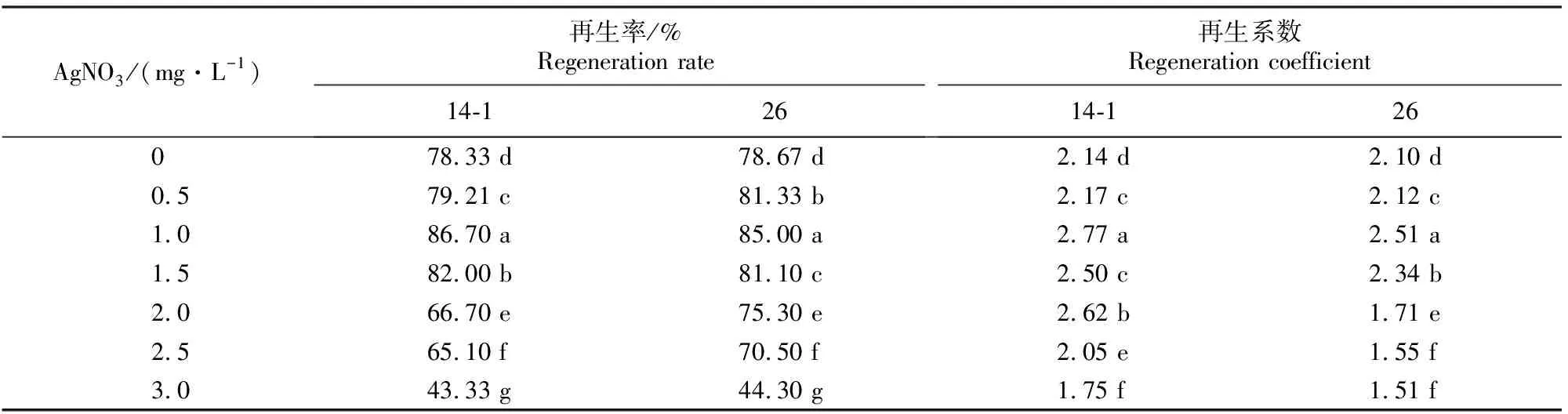
表 3 AgNO3质量浓度对黄瓜子叶节再生的影响
2.3 苗龄对黄瓜子叶节再生的影响
在3.0 mg/L 6-BA+2.0 mg/L ABA+1.0 mg/L AgNO3的MS培养基上,进行不同苗龄对14-1黄瓜种质子叶节再生的影响试验,结果见表4。由表4可知,4 d和7 d苗龄黄瓜无菌苗子叶节的再生率和再生系数都较低,4 d的无菌苗子叶呈黄绿色,极其幼嫩,子叶节不能再生;7 d的无菌苗2片子叶已完全展开,呈深绿色且生长点较大,但子叶节的再生率仅有51.00%;5 d苗龄的子叶节再生能力最强,再生率可达87.35%,再生系数可达3.38。说明外植体的生理状态对子叶节再生至关重要。
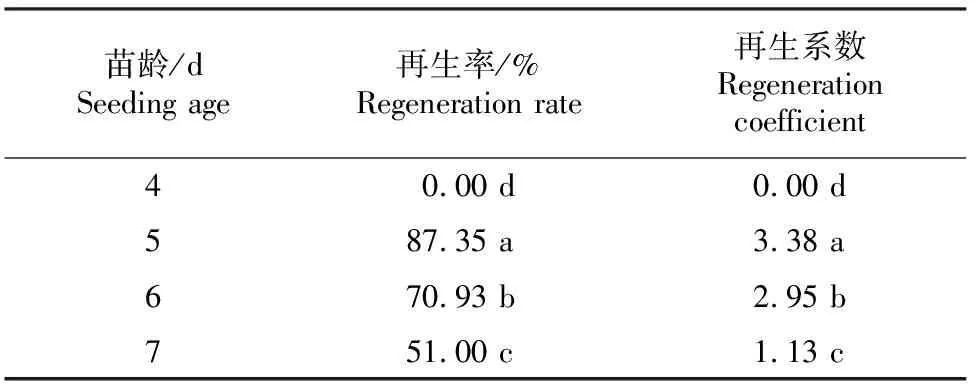
表 4 苗龄对黄瓜14-1种质子叶节再生的影响
2.4 子叶切割方式对黄瓜子叶节再生的影响
在MS培养基中附加3.0 mg/L 6-BA+2.0 mg/L ABA+1.0 mg/L AgNO3,对5 d苗龄的14-1黄瓜种质进行子叶切割方式试验,结果(表5)表明,黄瓜子叶节的大小和部位对再生都有影响,以a4再生力最强,即切除子叶端部2/3且带有1 mm子叶柄时,再生率达81.53%,再生系数达2.09。
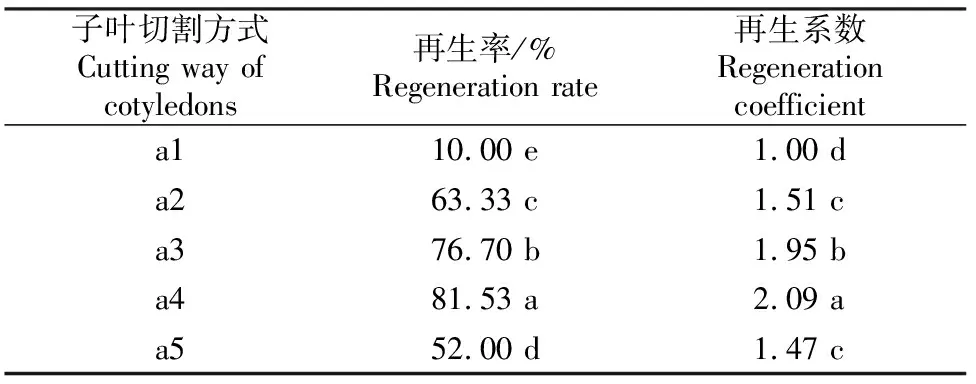
表 5 子叶切割方式对黄瓜14-1种质子叶节再生的影响
2.5 接种方式对黄瓜子叶节再生的影响
接种方式对黄瓜子叶节再生也有一定的影响。接种方式对黄瓜种质14-1子叶节再生的影响见表6。
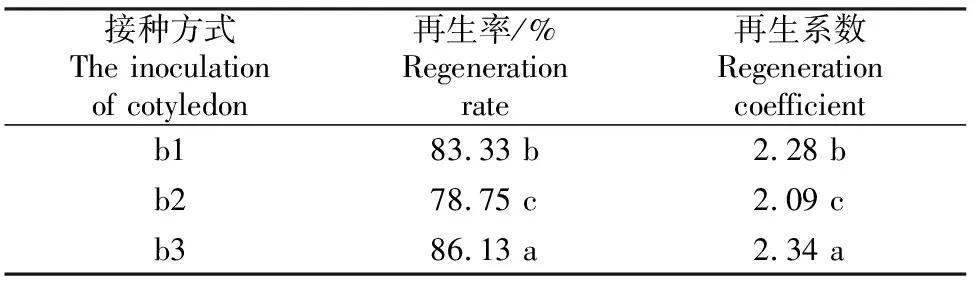
表 6 接种方式对黄瓜种质14-1子叶节再生的影响
由表6可知,接种方式对黄瓜子叶节不定芽再生的影响没有其他因素明显,不同接种方式下再生率均可达80%左右,再生系数可达2.00以上,但3种接种方式对子叶再生影响仍存在显著差异,以叶背向下子叶柄微插入的接种方式(b3)较其他2种方式的再生力强,再生率可达86.13%,再生系数可达 2.34;竖直插入方式(b1)再生力强于叶背向下平接方式(b2)。
2.6 黄瓜再生芽的伸长及生根
将再生的不定芽转入加有0.5 mg/L 6-BA的MS培养基中,10 d左右芽伸长至1.5 cm(图1D),将其从基部切下转入1/2 MS培养基中,5~7 d后有白色的根形成(图1E),10 d左右大量根产生,形成生理状态良好的再生植株(图1F)。
3 讨 论
黄瓜再生能力弱,且不同基因型、外植体类型对其再生的影响都有很大差异[22]。何晓明等[5]、侯爱菊等[19]研究表明,黄瓜可通过直接分化再生、愈伤组织再生、胚状体再生和原生质体再生等途径再生植株,而子叶一般作为黄瓜再生较理想的外植体,可直接通过器官分化途径诱导产生丛生芽,缩短培养周期。本研究以欧洲型黄瓜14-1和华北型黄瓜26号为试验材料,以子叶为外植体分析了多个因素对黄瓜子叶节再生的影响,建立了黄瓜14-1和26号种质材料的高频再生体系,为外源基因的遗传转化奠定了基础。
本研究结果表明,对于欧洲水果型黄瓜材料14-1最适的激素配比是3.0 mg/L 6-BA+2.0 mg/L ABA+1.0 mg/L AgNO3,在此诱导条件下再生率可达86.70%,再生系数可达2.77,与其他激素组合有显著差异。由于是通过器官直接发生途径,因此此过程中最好不要产生过多的愈伤组织,而6-BA和ABA组合可抑制愈伤组织的形成,提高芽分化率。王艳蓉等[11]对S05和S06 2个黄瓜基因型的芽诱导试验也得出了相似的结论,但其试验中6-BA质量浓度是3.0 mg/L,ABA的质量浓度为0.5~1.0 mg/L。华北型自交系黄瓜材料26号适宜的芽诱导激素组合是 4.0 mg/L 6-BA+0.3 mg/L IAA+1.0 mg/L AgNO3,在此诱导条件下再生率可达到85.00%,再生系数可达到2.51。薛丹丹等[12]对津研4号芽的诱导试验表明,在激素组合未加AgNO3的条件下,同为华北型的津研4号出芽率和出芽系数分别为 85.00% 和2.51。此外,赵隽等[7]和赵宇瑛等[13]的研究也表明,华北型黄瓜较适宜的激素组合是6-BA和IAA。14-1和26号黄瓜材料的最适芽诱导激素组合不同,这主要是由于基因型不同所致。
研究表明,AgNO3可有效促进器官发生[23],在芽诱导培养基中添加一定质量浓度的AgNO3,对不定芽的诱导有促进作用。本试验结果也表明,未加AgNO3时,6-BA+IAA组合子叶切口处产生的愈伤组织较6-BA+ABA组合多,添加AgNO3后则不易产生愈伤组织,说明AgNO3抑制了愈伤组织的形成。本研究中1.0 mg/L的AgNO3对芽诱导效果最好,这与李建欣等[24]的结果一致。还有研究表明,促进黄瓜不定芽再生的AgNO3质量浓度为2.0 mg/L[11-20],这可能是由于所使用材料的基因型及其生理状态等因素不同所致。遗传转化相关研究也表明,向黄瓜再生和筛选培养基中添加一定质量浓度的AgNO3能够有效促进抗性芽的再生,说明AgNO3在遗传转化中对于抗性芽的再生具有关键作用[25-27]。
苗龄是影响黄瓜再生的关键因子之一,不同苗龄的子叶再生能力是不同的。Colijn-Hooymans等[15]报道,再生能力与无菌苗的发育阶段有关,当子叶处于垂直生长阶段,其再生频率较高,而当子叶处于水平生长(2片子叶张开)阶段时,其再生能力显著降低。本研究表明,5 d苗龄的无菌苗,子叶全部转绿,2片子叶呈竖直状态且微分开时芽的再生效果最好,随着苗龄的增大,其再生率降低。这与韩欣等[16]、薛丹丹等[12]的研究结果一致;而赵隽等[7]研究认为,10 d苗龄的黄瓜子叶再生效果较好,Colijn-Hooymans等[15]发现苗龄为3~5 d的子叶外植体的不定芽发生率最高,梅茜等[14]则认为1~2 d苗龄的芽再生率较高。上述研究结果的差异,主要是由基因型、生理状态、培养条件等因素造成的。
黄瓜再生可通过子叶、真叶、下胚轴、胚根、胚和子叶节等外植体进行,但较为理想的再生方式是子叶再生,其子叶的大小和部位又是影响再生的关键因素。赵隽等[7]研究表明,保留2片子叶,且各切除子叶的1/3时外植体出芽最好;范爱丽等[8]认为,保留单片子叶,下胚轴纵切,去除顶芽并切除此子叶的2/3是最佳的切割方式。本研究结果表明,切除子叶端部2/3并带有1 mm子叶柄时再生率可达81.53%,再生系数可达2.09,且以叶背向下子叶柄微插入的方式接种,其不定芽的再生最好。
黄瓜再生体系研究中关于外植体具体的接种方式目前没有详细的阐述,大多数研究是以平铺方式进行的,范爱丽等[8]认为竖直插入为最佳的接种方式,本试验以叶背向下子叶柄微插入培养基的方式接种芽的再生最佳。外植体的接种方式对不定芽再生造成的影响可能与植物体的极性有关,具体机理还需进一步探究。
[参考文献]
[1] Liu L Y,Duan L S,Zhang J C,et al.Cucumber (CucumissativusL.) over-expressing cold-induced transcriptome regulator ICE1 exhibits changed morphological characters and enhances chilling tolerance [J].Scientia Horticulturae,2010,124:29-33.
[2] Tabei Y,Kitade S,Nishizawa Y.Transgenic cucumber plants ha-rboring a rice chitinase gene exhibit enhanced resistance to gray mold (Botrytiscinerea) [J].Plant Cell Reports,1998,17:159-164.
[3] Kielkiewicz M,Gajc-Wolska J,Slusarz S,et al.Growth development and yield of transgenic 35S-thaumatin Ⅱ-expressing cucumber plants-open field evaluation [J].Scientia Horticulturae,2012,143:82-91.
[4] 张若纬,顾兴芳,王 烨,等.基因型和6-BA对黄瓜子叶节再生频率的影响 [J].中国蔬菜,2009(22):45-48.
Zhang R W,Gu X F,Wang Y,et al.Effects of genotypes and 6-BA on regeneration frequency of cotyledonary nodes in cucumber (CucumissativusL.) [J].China Vegetables,2009(22):45-48.(in Chinese)
[5] 何晓明,林毓娥.黄瓜子叶和下胚轴的离体培养 [J].植物生理学通讯,2001,37(5):423-424.
He X M,Lin Y E.Invitroculture of cotyledon and hypocotyl inCucumissativus[J].Plant Physiology Communications,2001,37(5):423-424.(in Chinese)
[6] 杜胜利,魏惠军,魏爱民,等.苗龄、基因型和外植体类型对黄瓜离体器官发生的影响 [J].天津农业科学,2000,6(4):1-5.
Du S L,Wei H J,Wei A M,et al.Effects of seedling stage, genotype and explant type oninvitrosomatic organogenesis of cucumber [J].Tianjin Agricultural Science,2000,6(4):1-5.(in Chinese)
[7] 赵 隽,王 华,潘俊松,等.黄瓜子叶节离体再生体系的研究 [J].上海交通大学学报:农业科学版,2004,22(1):43-53.
Zhao J,Wang H,Pan J S,et al.Invitroculture and plantlet regeneration from cotyledonary nodes of cucumber(CucumissativusL.) [J].Journal of Shanghai Jiaotong University:Agricultural Science Edition,2004,22(1):43-53.(in Chinese)
[8] 范爱丽,孙艳丽,徐凌飞,等.黄瓜子叶节再生体系优化研究 [J].西北农林科技大学学报:自然科学版,2006,34(9):69-73.
Fan A L,Sun Y L,Xu L F,et al.Optimum study ofinvitroculture and plantlet regeneration system from cotyledonary nodes of cucumber (CucumissativusL.) [J].Journal of Northwest Sci-Tech University of Agriculture and Forestry:Natural Science Edition,2006,34(9):69-73.(in Chinese)
[9] 赵秀娟,吴定华.黄瓜的组织培养 [J].华南农业大学学报,1998,19(4):125-126.
Zhao X J,Wu D H.Tissue culture of cucumber [J].Journal of South China Agricultural University,1998,19(4):125-126.(in Chinese)
[10] 董灵迪.黄瓜组织培养研究 [J].西南农业大学学报,2000,22(1):23.
Dong L D.Studies on tissue culture cucumber [J].Journal of Southwest Agricultural University,2000,22(1):23.(in Chinese)
[11] 王艳蓉,陈丽梅,潘俊松,等.黄瓜子叶高效再生体系的建立与遗传转化 [J].上海交通大学学报:农业科学版,2006,24(2):152-156.
Wang Y R,Chen L M,Pan J S,et al.Establishment of high effective regeneration system in cucumber(CucumissativusL.) and agrobacterium tumefaciens mediated genetic transformation [J].Journal of Shanghai Jiaotong University:Agricultural Science Edition,2006,24(2):152-156.(in Chinese)
[12] 薛丹丹,张凤生,王保菊,等.黄瓜再生体系的建立 [J].北方园艺,2010(7):119-121.
Xue D D,Zhang F S,Wang B J,et al.The regeneration system of cucumber [J].Northern Horticulture,2010(7):119-121.(in Chinese)
[13] 赵宇瑛,李永辉,李丛玉,等.6-BA、NAA和IAA对黄瓜子叶离体培养分化的影响 [J].长江大学学报:自然科学版,2007,4(3):26-28.
Zhao Y Y,Li Y H,Li C Y,et al.Influences of 6-BA,NAA and IAA on cotyledons differentiation of cucumberinvitro[J].Journal of Yangtze University:Natural Science Edition,2007,4(3):26-28.(in Chinese)
[14] 梅 茜,张兴国.黄瓜组织培养研究 [J].西南农业大学学报,2002,24(3):266-267.
Mei Q,Zhang X G.Studies on tissue culture cucumber [J].Journal of Southwest Agricultural University,2002,24(3):266-267.(in Chinese)
[15] Colijn-Hooymans C M,Hakkert J C,Jansen J J.Competence for regeneration of cucumber cotyledons is restricted to specific developmental stages [J].Plant Cell,Tissue and Organ Culture,1994,39:211-217.
[16] 韩 欣,张卫华,曹齐卫,等.黄瓜子叶节再生体系的建立 [J].吉林蔬菜,2009(2):86-87.
Han X,Zhang W H,Cao Q W,et al.The establishment of regeneration system from cotyledonary nodes ofCucumissativusL. [J].Jilin Vegetables,2009(2):86-87.(in Chinese)
[17] 张卫华,朱妍妍,王志峰,等.三个不同基因型黄瓜再生体系的优化研究 [J].山东农业科学,2007(6):5-7.
Zhang W H,Zhu Y Y,Wang Z F,et al.Studies on optimizing cucumber regeneration system of three different genotypes [J].Shandong Agricultural Sciences,2007(6):5-7.(in Chinese)
[18] 余阳俊,朱其杰.黄瓜成熟胚离体培养中的胚状体诱导和植株再生 [J].植物生理学通讯,1992,28(1):37-39.
Yu Y J,Zhu Q J.Embryoid induction aud plantlet regeneration in mature embryos of cucumberinvitro[J].Plant Physiology Communications,1992,28(1):37-39.(in Chinese)
[19] 侯爱菊,朱延明,杨爱馥,等.诱导黄瓜直接器官发生主要影响因素的研究 [J].园艺学报,2003,30(1):101-103.
Hou A J,Zhu Y M,Yang A F,et al.Main factors influencing the frequency of direct organogenesis of cucumberinvitro[J].Acta Horticulturae Sinica,2003,30(1):101-103.(in Chinese)
[20] 张若纬,顾兴芳,王 烨,等.不同黄瓜基因型子叶再生体系的建立 [J].华北农学报,2010,25(增刊):50-54.
Zhang R W,Gu X F,Wang Y,et al.Regeneration system establishment from cotyledons in different cucumber (CucumissativusL.) genotypes [J].Acta Agriculturae Boreali-Sinica,2010,25(Suppl.):50-54.(in Chinese)
[21] 金宝燕,苏 华,任华中.影响黄瓜直接不定芽诱导的品种等因素研究 [J].中国农学通报,2006,22(6):45-48.
Jin B Y,Su H,Ren H Z.Effects of cultivar etc on direct shoot induction from cotyledonary nodes of cucumber [J].Chinese Agricultural Science Bulletin,2006,22(6):45-48.(in Chinese)
[22] Sarmento G S,Alpert K,Tang F A.Factors influencing agro-bacterium tumefaciens-mediated transformation and expression of kanamycin resistance in Pickling cucumber [J].Plant Cell Organ Cult,1992,31:185-193.
[23] 张 鹏,凌定厚.提高菜心离体植株再生频率的研究 [J].植物学报,1995,37(11):902-908.
Zhang P,Ling D H.Enhancement of plant regeneration rate ofBrassicaparachinensisculturedinvitro[J].Acta Botanica Sinica,1995,37(11):902-908.(in Chinese)
[24] 李建欣,李建吾,葛桂民.黄瓜子叶离体再生体系研究 [J].长江蔬菜,2008(1):44-46.
Li J X,Li J W,Ge G M.Invitroculture and plantlet regeneration from cotyledon ofCucumissativusL. [J].Journal of Changjiang Vegetables,2008(1):44-46.(in Chinese)
[25] 赖 来,潘俊松,何欢乐,等.农杆菌介导的MADS-box基因转化黄瓜初步研究 [J].上海交通大学学报:农业科学版,2007,25(4):374-382.
Lai L,Pan J S,He H L,et al.Agrobacterium-mediated genetic transformation of cucumber(CucumissativusL.) withMADS-boxlike gene [J].Journal of Shanghai Jiaotong University:Agricultural Science Edition,2007,25(4):374-382.(in Chinese)
[26] Perl A,Aviv D,Galun E.Ethylene andinvitroculture of potato:Suppression of ethylene generation vastly improves protoplast yield,planting efficiency and transient expression of an alien gene [J].Plant Cell Rep,1988,7:403-406.
[27] DeBlock M,DeByouwer D,Tenning P.Transformation ofBra-ssicanapusandBrassicaderaceausingAgrobacteriumtumefaciensand the expression of thebarandneogenes in the transgenic plants [J].Plant Physiol,1989,91:694-701.

