文冠果腋芽诱导关键影响因素与培养体系优化
张娜,张芸香,郭晋平
(1.山西农业大学 林学院,山西 太谷 030801;2.山西省林业科学研究院,山西 太原 030012)
腋芽增生是指茎尖或初代培养的芽在适宜的培养基上诱导,不断发生腋芽,腋芽又不断萌发形成丛生苗,通过一代又一代地诱导腋芽发育,获得大量再生植株的技术[1]。腋芽增生过程中不经历脱分化阶段而直接从芽发育成新芽,再生植株能够最大限度地保持母本的优良性状,已成为木本植物无性系快速繁殖中运用最为广泛的组培技术途径。腋芽诱导是实现腋芽增生的首要和关键步骤,解决好腋芽增生技术体系中腋芽诱导环节的技术问题,是发挥腋芽增生方法的优势、实现无性系高效快繁的关键技术问题。
文冠果优良品种和类型的选育是目前林业生产中亟待解决的问题,在优良无性系选育中,实现无性系高效组培快繁是技术瓶颈,而文冠果属于组织培养繁殖困难的树种。文冠果组织培养体系的建立方面已开展了大量的探索和实验工作,文冠果茎段外植体组织培养技术方面也有许多试验研究[2~6],但迄今为止,尚无文冠果茎段外植体腋芽诱导关键影响因素的明确研究结果,组培技术体系尚不完善。
以文冠果幼嫩茎段作为外植体,对灭菌剂种类及灭菌时间、外植体采集时间、基本培养基类型、BA浓度、糖源种类和浓度等文冠果腋芽诱导的可能影响因素进行了试验研究,旨在掌握腋芽诱导的关键影响因素和作用规律,建立文冠果茎段外植体高效腋芽诱导技术体系,为突破文冠果大规模组培快繁关键技术难题,实现文冠果优良品种繁育的突破提供理论依据与技术支持。
1 材料与方法
1.1 试验材料
试验材料采自课题组在山西农业大学林学院苗圃栽培的6年生文冠果实验林,选择植株生长健康的幼嫩茎段作为试验所用的外植体材料。
将大田采回的茎段洗净后,在超净工作台上操作,先用75%的酒精灭菌10~30 s,无菌水冲洗3次,再用实验设计的2种灭菌剂进行不同时间的灭菌处理,无菌水冲洗5~6次,切成1.5 cm左右的茎段,每个茎段至少带1个腋芽,准备接种。
1.2 试验设计和培养条件
本研究分6个分项实验,分别解决文冠果茎段增生组培腋芽诱导中的灭菌剂类型和灭菌时间、外植体采集时期、基本培养基类型、培养基BA浓度、培养基糖源类型和浓度、培养环境光照条件共6个关键技术指标的选择和组合优化。
试验采用单因素完全随机设计,每处理均为30瓶,每瓶接种1个外植体,重复3次,接种培养时间4 w。
试验的培养过程在全自动恒温培养箱中进行,温度为25±2℃;除培养环境光照条件实验外,光照强度均为2500~3000 lx,光照时间为14~16 h·d-1;除培养基类型选择试验采用多种培养基外,其余试验均采用MS培养基;除培养基糖源类型和浓度试验外,培养基糖源均为蔗糖,浓度为30 g·L-1;所有培养基均添加琼脂4.5 g·L-1,培养基调至pH 5.8~5.9。
1.3 灭菌剂及灭菌时间
试验设计2种灭菌剂,分别为2%次氯酸钠(NaClO)和0.1%氯化汞(HgCl2)。对2种灭菌剂均分别设计4个灭菌时间梯度,用2%NaClO灭菌时,灭菌时间梯度分别为5、8、10、12 min;用0.1%HgCl2灭菌时,灭菌时间梯度分别为2、3、4和5 min。采用4~5月采集的幼嫩茎段,经各项处理后进行接种培养,4 w后对文冠果茎段外植体的污染率、死亡率和成活率进行观察统计。
1.4 外植体采集时间
为分析外植体采集时间和枝条木质化程度对茎段外植体组培灭菌效果的影响,设计4~9月中共6个外植体采集时间,选在每月中旬晴朗的中午,选择当年生枝条采集文冠果茎段。由于采集时间、枝条木质化程度不同,不同的采集时间代表了不同的外植体木质化程度。不同时期采集的外植体及时经处理后接种培养,4 w后统计外植体的污染率、死亡率和成活率。
1.5 基本培养基
供选择试验的基本培养基为MS、B5和WPM,按试验设计确定的试验材料准备和培养条件,接种至3种培养基中进行培养,4 w后观察腋芽生长情况,统计腋芽诱导率。
1.6 培养基BA浓度
采用上述筛选的最佳基本培养基作为基本培养基,并添加0.2 mg·L-1NAA,再添加不同浓度的BA,设计BA浓度梯度为0.5、1.0、3.0和5.0 mg·L-1,接种培养4 w后,观察文冠果腋芽生长情况,统计腋芽诱导率。
1.7 培养基糖源类型及浓度
采用上述筛选出的最佳基本培养基及激素组合作为该试验的基本培养基,设计培养基糖源种类为蔗糖、葡萄糖和果糖3个,并分别设计3个浓度梯度:10、30、50 g·L-1。接种培养4 w后,观察文冠果腋芽生长情况,统计腋芽诱导率。
1.8 培养环境的光照
采用上述筛选出的最佳基本培养基及激素组合作为该试验的基本培养基,添加蔗糖30 g·L-1,琼脂4.5 g·L-1,分别进行光照培养和黑暗培养。4 w后,观察文冠果腋芽生长情况,统计腋芽诱导率。
1.9 数据统计与分析
将试验所得数据采用SPSS17.0进行方差分析,并用Duncan多重比较方法对各处理间的均值进行差异显著性检验。具体指标计算如下:
污染率=污染的外植体数/接种的外植体总数×100%
死亡率=死亡的外植体数/接种的外植总体数×100%
成活率=100%-污染率-死亡率
腋芽诱导率=[诱导出腋芽的外植体总数/(接种的外植体总数-污染的外植体数)]×100%
2 结果与分析
2.1 灭菌剂及灭菌时间对文冠果茎段外植体灭菌效果的影响
对灭菌剂和灭菌时间的方差分析表明,灭菌剂及灭菌时间对外植体的污染率、死亡率和成活率的影响极显著。
由表1可见,采用2%NaClO作为灭菌剂,当灭菌时间为5 min时,污染率高达92.43%,虽然死亡率很低,但成活率仅为5.42%;随着灭菌时间延长,污染率有所降低,但死亡率也相应升高;当灭菌时间为10 min时,污染率和死亡率分别为64.85%和15.38%,成活率最高,仅为19.77%;当灭菌时间继续延长至12 min时,污染率降低为42.21%,但死亡率却高达42.22%,其成活率也仅为15.57%。采用0.1% HgCl2作为灭菌剂,当灭菌时间为2 min时,污染率高达77.87%,成活率仅达14.31%;随着灭菌时间的延长,污染率逐渐降低,死亡率逐渐升高;当灭菌时间为4 min时,污染率和死亡率均较低,成活率最高,达74.38%;当灭菌时间继续延长为5 min时,污染率达最低,为12.16%,但死亡率很高,达45.66%,成活率仅为42.18%;如图1-A为外植体茎段死亡,主要是由于灭菌时间过长所致。
可见,2%NaClO无论浓度如何,都不是文冠果茎段外植体的适宜灭菌剂,而0.1% HgCl2灭菌4 min是文冠果茎段外植体组培的适宜灭菌处理方式。
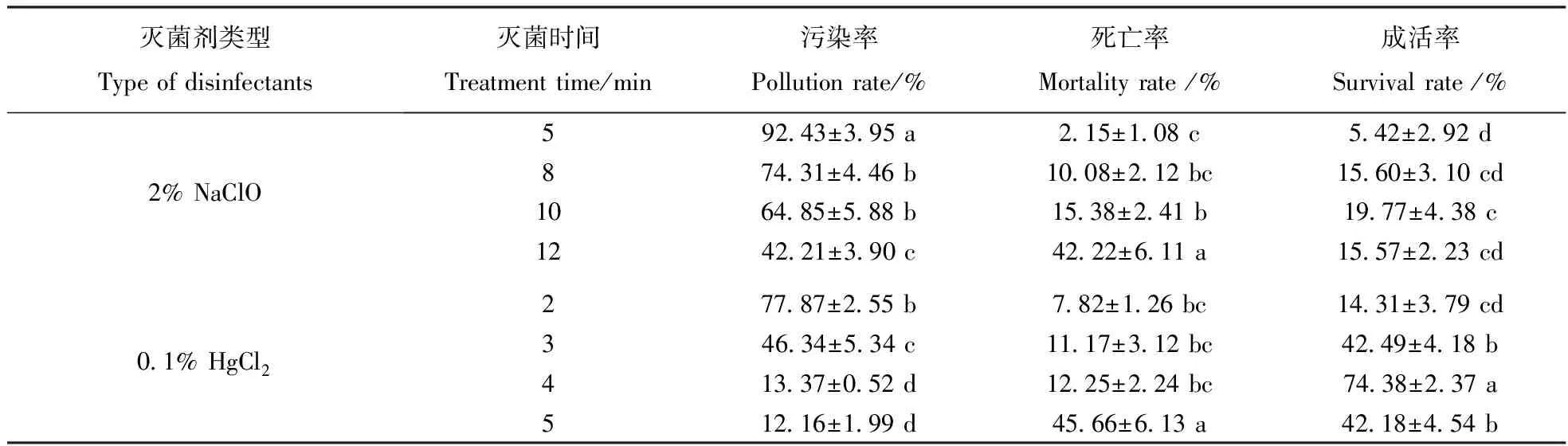
表1 灭菌剂及灭菌时间对茎段外植体灭菌效果的影响
注:每个值代表标准值±标准误。所有数据在P=0.05水平采用邓肯多重比较法进行比较;同一列中相同字母之间表示差异不显著,不同字母之间表示差异显著。表2~表6同。
Note: Each value represents the mean ± standard error. Data within a column followed by the same letter in superscript are not significantly different by Duncan's multiple-range test (P<0.05). The same as in table 2~table 6.
2.2 外植体采集时期对文冠果茎段外植体灭菌效果的影响
对外植体采集时间的方差分析表明,不同采集时期对外植体污染率和成活率的影响极显著,对外植体的死亡率影响不显著。4~5月采集外植体进行组培,污染率较低,分别为10.01%和14.92%,成活率最高,分别为80.06%和74.77%;6月采集外植体进行组培,污染率逐渐升高,成活率逐渐降低;至7~8月采集外植体,污染率达到最高,而成活率达到最低,分别为15.60%和12.07%;到9月采集外植体,污染率又有所降低,成活率有所升高,分别为42.68%和47.24%,如表2所示。
表2外植体采集时期对茎段外植体灭菌效果的影响
Table2 Effect of collection period on disinfection of stem segment explants

采集时期Collectionperiod污染率Pollutionrate/%死亡率Mortalityrate/%成活率Survivalrate/%4月10.01±1.93 c9.93±1.73 a80.06±1.54 a5月14.92±0.89 c10.31±1.93 a74.77±1.92 a6月42.40±3.39 b10.35±0.21 a46.09±3.78 b7月72.20±2.31 a12.19±0.93 a15.60±3.10 c8月77.88±1.08 a9.04±1.49 a12.07±1.54 c9月42.68±2.03 b11.23±1.06 a47.24±2.44 b
2.3 基本培养基类型对文冠果茎段组培腋芽诱导的影响
对基本培养基类型的腋芽诱导效果的方差分析表明,基本培养基类型对文冠果腋芽诱导率影响显著。由表3可见,在供试验的3种基本培养基中,MS基本培养基腋芽诱导率最高,达88.77%,腋芽萌发时间也较早,在第6~8 d即开始萌发(图1-B),之后叶片伸展较快,植株长势良好,如图1-C。B5和WPM培养基腋芽诱导率略低,且腋芽萌发时间较晚,均在8~10 d开始萌发。在B5培养基上进行外植体培养,叶片伸展较快,但植株长势细弱(图1-D);在WPM培养基中培养,植株长势良好,但叶片伸展较慢(图1-E)。
表3基本培养基类型对腋芽诱导的影响
Table3 Effect of basal medium on induction of axillary bud
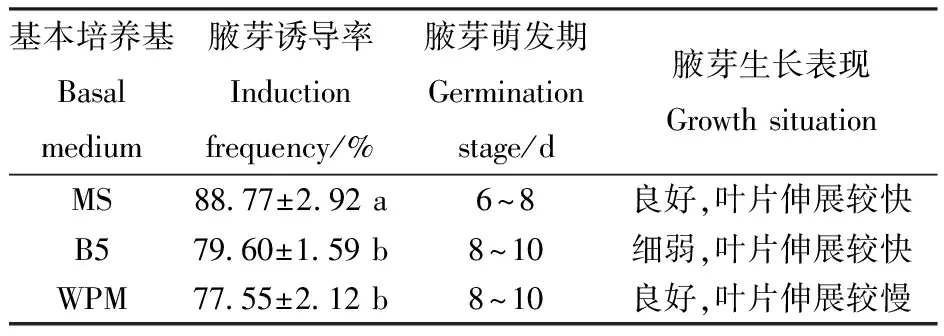
基本培养基Basalmedium腋芽诱导率Inductionfrequency/%腋芽萌发期Germinationstage/d腋芽生长表现Growth situation MS88.77±2.92 a6~8良好,叶片伸展较快B579.60±1.59 b8~10细弱,叶片伸展较快WPM77.55±2.12 b8~10良好,叶片伸展较慢
2.4 培养基BA浓度对文冠果腋芽诱导的影响
对培养基BA浓度的腋芽诱导效果的方差分析表明,培养基BA浓度对文冠果腋芽诱导率影响显著。由表4可见,当BA浓度为0.5 mg·L-1时,腋芽诱导率达83.36%,腋芽在培养5~7 d后萌发,且生长较慢;将BA浓度提高到1.0 mg·L-1时,腋芽诱导率达92.25%,腋芽培养4~5 d后开始萌发,且腋芽生长较快;继续提高BA浓度到3.0 mg·L-1时,腋芽诱导率略有下降,腋芽培养4~5 d后萌发,腋芽生长较快,但出现轻微玻璃化现象(图1-F);当BA浓度为5.0 mg·L-1时,腋芽诱导率最低,且玻璃化现象严重。
2.5 糖源类型及浓度对文冠果腋芽诱导的影响
对糖源类型及浓度的腋芽诱导效果的方差分析表明,糖源类型及浓度对文冠果腋芽诱导率的影响极显著。培养基中3种糖源的3个糖含量梯度指标中均以30 g·L-1为最佳,腋芽诱导率达最高。
由表5可见,在3种糖源中,在3个相同浓度下,添加蔗糖的培养基腋芽诱导率均显著高于添加其它2种糖源的培养基,而添加葡萄糖和果糖的培养基,腋芽诱导率差异不显著。
表4培养基BA浓度对腋芽诱导的影响
Table4 Effect of different concentrations of BA on induction of axillary bud

BA/mg·L-1腋芽诱导率Inductionfrequency/%腋芽萌发期Germinationstage/d腋芽生长表现Growth situation0.583.36±1.81 b5 ~ 7 较慢1.092.25±0.97 a4 ~ 5较快3.081.94±3.67 b4 ~ 5较快,伴有轻微玻璃化现象5.068.94±2.29 c4 ~ 5较快,玻璃化现象严重
表5糖源类型及浓度对腋芽诱导率的影响
Table5 Effect of different types and concentrations of sugar on the frequency of auxiliary bud induction
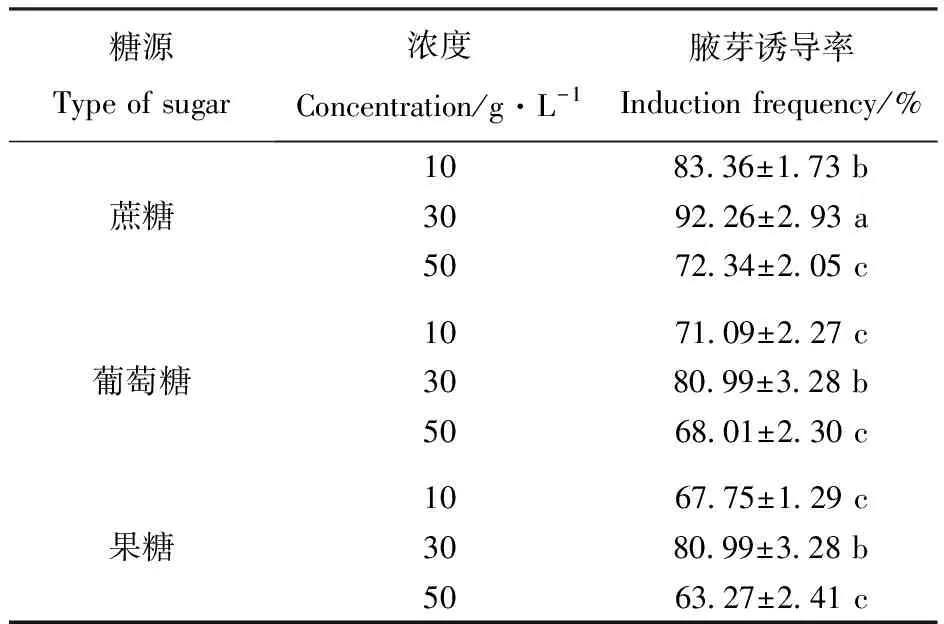
糖源Type of sugar浓度Concentration/g·L-1腋芽诱导率Induction frequency/%蔗糖1083.36±1.73 b3092.26±2.93 a5072.34±2.05 c葡萄糖10 71.09±2.27 c30 80.99±3.28 b50 68.01±2.30 c果糖10 67.75±1.29 c30 80.99±3.28 b50 63.27±2.41 c
2.6 光照培养环境对文冠果腋芽诱导的影响
对光照培养环境的腋芽诱导效果的方差分析表明,光照培养和黑暗培养对文冠果腋芽诱导率影响不显著,但不同光照培养环境下腋芽生长状况存在差异。由表6可见,光照培养条件下,腋芽4~5 d开始萌发,生长较快,叶片呈绿色;在黑暗培养条件下,腋芽萌发较晚,在6~8 d开始萌发,生长较慢,叶片呈淡绿色甚至白色(图1-G),出现白化或黄化苗(图1-H),说明光照培养环境有利于茎段外植体腋芽诱导及生长。
表6光照培养环境对腋芽诱导的影响
Table6 Effect of light condition on induction of axillary bud
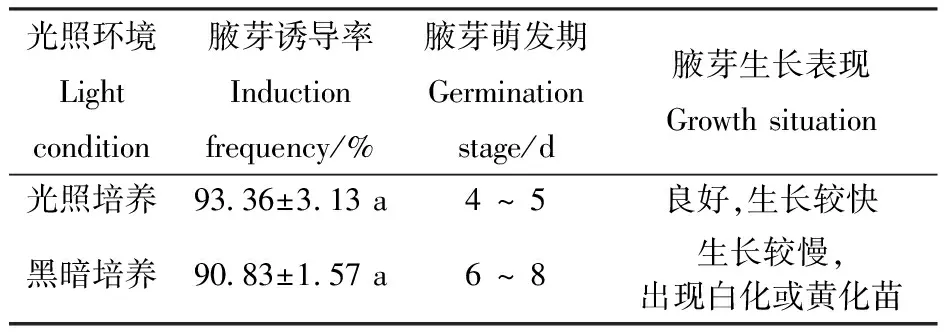
光照环境Lightcondition腋芽诱导率Inductionfrequency/%腋芽萌发期Germinationstage/d腋芽生长表现Growth situation 光照培养93.36±3.13 a4 ~ 5 良好,生长较快黑暗培养90.83±1.57 a6 ~ 8 生长较慢,出现白化或黄化苗

图1 文冠果幼嫩茎段外植体的腋芽诱导生长情况Fig.1 Axillary bud induction using young stem segments as explants of Xanthoceras sorbifolia注:A,茎段死亡;B,培养6 d时,腋芽开始萌发;C,在MS培养基上培养30 d后的腋芽生长情况;D,在B5培养基上培养30 d后的腋芽生长情况;E,在WPM培养基上培养30 d的腋芽生长情况;F,在添加3.0 mg·L-1 BA和0.2 mg·L-1 NAA的MS培养基上观察到腋芽有轻微玻璃化现象;G & H,黑暗培养环境下,观察到腋芽呈淡绿白色或淡黄白色。Note:A,Stem segment died; B,Axillary bud began to sprout when cultured for 6 d; C,Axillary bud cultured on MS medium for 30 d; D,Axillary bud cultured on B5 medium for 30 d; E,Axillary bud cultured on WPM medium for 30 d; F,The slight hyperhydric buds observed on MS medium supplemented with 3.0 mg·L-1 BA and 0.2 mg·L-1 NAA; G &H,The light white or light yellow buds observed when cultured on dark condition.
3 结论与讨论
有效控制外植体污染是植物组织培养成功的先决条件。植物组织培养中常用的灭菌剂有漂白粉、次氯酸钠(2%~10%)、氯化汞(0.1%~1%)和酒精(70%~75%)等[7]。适宜的灭菌剂既要有良好的灭菌效果,又要对外植体的损伤较小,还要易清洗,残留少。因此,需要针对树种、外植体类型和取材时期等正确选择灭菌剂类型和处理时间。本研究选用了两种灭菌剂,并分别设置了4个时间梯度进行筛选研究。结果表明,2%NaClO无论浓度如何,都不是文冠果茎段外植体的适宜灭菌剂,而0.1% HgCl2灭菌处理4 min是文冠果茎段外植体组培的适宜灭菌处理方式。Raha and Roy[8]在对止泻木茎段外植体进行灭菌时,也采用0.1% HgCl2作为灭菌剂。HgCl2是重金属,对环境危害大,对人畜的毒性极强,用时需慎重,使用后必须做好回收工作。
植物采集时期对外植体的灭菌效果也不尽相同。结果表明,4~5月采集的外植体易于灭菌,污染率较低,成活率最高,可能是由于4~5月是文冠果自然萌发的季节,腋芽处于萌动状态,并且经过一个寒冷的冬季,外界环境中的各种病菌和病虫害较少,易于灭菌。而7~8月正值雨季,空气相对湿度大,加之高温导致文冠果病害严重,致使外植体灭菌非常困难,此时期的污染率很高。在三倍体毛白杨的腋芽诱导试验研究中也发现,5月份采集的外植体灭菌效果最好[9]。苹果在3~6月采集的成活率可达60%,而7~11月采集时,其成活率降到10%[1]。
基本培养基的选择直接影响植物组织培养的效果。结果表明,在MS基本培养基中,文冠果腋芽诱导率最高,达88.77%,而且腋芽在6~8 d即开始萌发,叶片伸展较快,植株长势良好。而B5和WPM培养基的腋芽诱导率略低,且腋芽均在8~10 d萌发。可能是由于MS基本培养基中的无机盐含量高,尤其是硝酸盐、铵离子和钾离子含量丰富,易于文冠果腋芽诱导及生长[7]。Jiménez等[10]试验发现,MS培养基是瓜多竹腋芽诱导的最佳基本培养基。
基本培养基需要配合使用适当的植物生长调节剂才能诱导细胞分裂的启动、培养物形态建成、芽和根的分化与发育等[11]。本试验对不同浓度的BA与0.2 mg·L-1NAA组合进行研究,结果表明,当BA浓度为1.0 mg·L-1时,腋芽诱导率最高,是文冠果腋芽诱导的最佳浓度。Yan等[12]对山药进行腋芽诱导研究时发现,培养基中添加1.0 mg·L-1BA与NAA组合是山药腋芽诱导的最佳培养基。
在植物组织培养中,糖类既为培养物提供能量,也是培养物渗透环境的主要调节者。蔗糖作为碳源和渗压剂的比例约为3∶1~3∶2,即约有1/4~2/5的蔗糖用于保持培养基的渗透压[13]。本研究表明,当蔗糖浓度为30 g·L-1时,是文冠果腋芽诱导的最佳浓度。
参 考 文 献
[1]刘欣,薛金芝,赵丹,等.植物组织培养技术在林木育种中的应用[J].吉林林业科技,2007,36(3):8-13.
[2]张桂琴,徐祥龄,赵志学.文冠果嫩茎组织诱导植株移栽初获成功[J].林业科技通讯,1980,7:4-5.
[3]王永明,赵静茹,陈颖.文冠果的组织培养[J].植物生理学通讯,1986,1:42.
[4]王玉珍,李霞,张弛.文冠果组培快速繁殖方法[P].中国专利:CN 101032226,2007-9-12.
[5]柳金凤,吴建华,闵丽霞.文冠果组培快繁技术研究[J].江苏农业科学,2010:252-254.
[6]兰士波,崔云英,李秀兰.文冠果优异种质选择及茎段离体培养技术[J].黑龙江生态工程职业学院学报,2011,24(3):16-18.
[7]王蒂.植物组织培养[M].北京:中国农业出版社,2004:29-29.
[8]Raha S,Roy S C.In vitro plant regeneration in Holarrhena antidysenterica Wall,through high-frequency axillary shoot proliferation[J].In Vitro Cell Dev Biol-Plant,2001,37:232-236.
[9]李景琦,胡晓莉,王成社,等.不同激素对三倍体毛白杨腋芽诱导和增殖效应的研究[J].西北林学院学报,2002,17(2):37-40.
[10]Jiménez V M,Castillo J,Tavares E,et al.In vitro propagation of the neotropical giant bamboo,Guadua angustifolia Kunth,through axillary shoot proliferation[J].Plant Cell Tiss Organ Cult,2006,86:389-395.
[11]谭文澄,戴策刚.观赏植物组织培养[M].北京:中国林业出版社,1991:117-117.
[12]Yan H,Yang L,Li Y.Axillary shoot proliferation and tuberization of Dioscorea fordii Prain et Burk[J].Plant Cell Tiss Organ Cult,2011,104:193-198.
[13]丁世萍,严菊强,季道藩.糖类在植物组织培养中的效应[J].植物学通报,1998,15(6):42-46.

