肝硬化模型大鼠CYP2B6和CYP3A酶活性变化
朱加银,王贤亲,朱仔花,胡卢丰,陈锡文
(温州医科大学1.实验动物中心,2.药学院,3.附属第一医院药剂科,浙江温州 325035)
肝硬化模型大鼠CYP2B6和CYP3A酶活性变化
朱加银1,王贤亲2,朱仔花2,胡卢丰3,陈锡文1
(温州医科大学1.实验动物中心,2.药学院,3.附属第一医院药剂科,浙江温州 325035)
目的研究CYP2B6和CYP3A酶活性在肝硬化模型大鼠体内的变化。方法雄性SD大鼠分别采用每周2次ip给予30%CCl4连续7周、饮用含0.03%~0.04%硫代乙酰胺(TAA)液连续10周、复合法(sc给予用花生油配制的40%CCl4+高脂饲料+15%乙醇,共6周)及免疫法(sc给予牛血清白蛋白20~40 mg·kg-1,共11周)制备肝硬化模型后,联合ig给予安非他酮15 mg·kg-1和咪达唑仑10 mg·kg-1。测定给药前及给药后0.083,0.25,0.5,1,1.5,2,2.5,3,4,6,8,12和24 h的血药浓度。结果与正常对照组相比,四氯化碳组和TAA组的2个探针药曲线下面积(AUC)均显著性升高(P<0.05),峰浓度cmax显著性升高(P<0.01),清除率Cl/F均显著性下降(P<0.05);复合法组2个探针药cmax均显著性下降(P<0.05);免疫组2个探针药的药代参数均无统计学意义。结论CCl4和TAA诱导的肝硬化模型大鼠体内CYP2B6和CYP3A酶活性降低。
探针药;肝硬化;药代动力学;细胞色素P450 CYP2B6;细胞色素P450 CYP3A
DO l:10.3867/j.issn.1000-3002.2014.01.013
肝硬化是一种肝细胞弥漫性变性坏死并伴有结节形成、肝纤维化呈广泛性特点的慢性疾病。肝纤维化是各种损伤因子持续作用而引起的损失修复反应,以肝星状细胞(hepatic stellate cells,HSC)活化增殖为中心环节,使主要为胶原纤维的细胞外基质(extracellular matrix,ECM)大量沉积,促使肝细胞大量凋亡,胆管内皮细胞(bile duct endothelial ce lls,BEC)异常增生,并破坏正常的肝结构与功能,从而最终发展成为肝硬化[1]。
肝是药物体内代谢的重要器官,而细胞色素P450酶(cytochrome P450,CYP)是参与药物Ⅰ相代谢反应的主要超家族酶系。CYP是微粒体混合功能氧化酶系中最重要的一族氧化酶,分布在多个器官、组织,与内外源性的物质代谢密切相关[2-3]。因而通过评价肝硬化模型大鼠体内CYP活性,对合理用药治疗肝病具有潜在意义。以往研究表明,肝损伤大鼠CYP3A基因表达减弱[4];CYP2B基因表达增强[5];肝硬化时大鼠的肝微粒体CYP总量明显降低[6]。目前尚未见从CYP方面评价肝硬化模型大鼠,并对其体内CYP2B6和CYP3A酶活性变化的报道。本研究通过4种不同因素诱导大鼠肝硬化模型,以探针药安非他酮(amfebutamone)和咪达唑仑(midazolam)的体内代谢情况探讨肝硬化大鼠体内CYP2B6和CYP3A酶活性的变化。
1 材料与方法
1.1 药物、试剂及仪器
四氯化碳(CCl4),购自西陇化工股份有限公司,批号:1111012,硫代乙酰胺(thioacetamide,TAA),国药集团化学试剂有限公司,批号:20111128、牛血清白蛋白(bovine serum album in,BSA)与石蜡油,购自上海生工生物工程有限公司,批号:分别为RS0327B2012J与SJ0222S7512J)、咪达唑仑、安非他酮与阿托品,购自中国药品生物制品检定所,批号分别为171250-200401,100671-201001与100040-200510)、咪达唑仑注射液;购自江苏恩华药业股份有限公司,批号:20100108,色谱纯甲醇与乙腈,购自德国Merck公司;其余试剂为分析纯。Bruker Esquire系列HCT质谱仪,德国Bruker公司产品、Agilent 1200型高效液相色谱仪,美国Agilent公司产品。
1.2 动物
SPF级雄性SD大鼠50只,体质量220~240 g,由温州医学院实验动物中心提供,动物质量合格证号:SCXK(浙)2010-0044。实验与饲养条件严格按照SPF级动物实验室标准操作规程(SOP)规范操作,动物使用许可证号:SYXK(浙)2010-0150。
1.3 模型制备、分组与给药
大鼠适应性饲养1周后,随机分为5组(n=10):正常对照组、四氯化碳组(CC l4)、TAA组、复合法组及免疫组。CC l4组:ip给予30%CC l4石蜡油2 m L·kg-1,每周2次,连续7周。TAA组:蒸馏水稀释TAA,前5周含饮0.03%TAA水,后5周饮0.04%TAA水,共10周。复合法组:每3 d ip给予40%CCl4花生油。首次5 m L·kg-1,以后3 m L·kg-1,同时饲喂高脂饲料,15%乙醇饮水,连续6周。免疫组:生理盐水稀释BSA,第1,15,25,35天同剂量皮下2~3个点注射BSA,20 mg·kg-1,间隔10 d,再每周2次,第1次和第3次40 m g·kg-1,其余每次20 m g·kg-1,共9次。正常对照组:给予相应的生理盐水。造模结束后尾静脉采血测血清谷丙转氨酶(glutamic-pyruvic transaminase,GPT),禁食12 h联合ig给予安非他酮15 mg·kg-1和咪达唑仑10 mg·kg-1并测定血药浓度。
1.4 肝组织病理形态检测、肝微粒体制备
实验结束时,麻醉安乐处死大鼠,开腹取肝,用滤纸吸干水分,称重计算肝系数〔肝质量(g)/体质量(g)×100〕后,切取小块肝组织置于4%甲醛溶液中固定,石蜡包埋,制成6μm厚的切片,HE染色,光镜下观察肝组织病理形态的改变。其余肝液氮速冻后于-80℃保存以制备肝微粒体。采用差速离心法制备微粒体。在4℃以下环境中,每10 g肝,加蔗糖PBS缓冲液25 m L匀浆后再超声分散30 s。匀浆液8 944×g、上清液、吸取上清液894 400×g分别离心15,15,90 m in后,弃去上清液,沉淀再用PBS缓冲液10 m L复溶,保存于-80℃备用。用BCA法定量,测定肝微粒体蛋白浓度。
1.5 血样采集与处理
探针药给予前及给药后的0.083,0.25,0.5,1,1.5,2,2.5,3,4,6,8,12和24 h取大鼠尾静脉0.3 m L置于肝素化试管中,2 236×g离心5 m in,分离血浆,-40℃保存待测。精密取血浆100μL,加入内标阿托品(0.2 m g·L-1)10μL,混匀,再加入乙腈-甲醇(90∶10,V/V)混合溶液200μL,涡旋0.5 m in,15 115×g离心10 m in后,取上清液200μL于自动进样器的样品瓶中,设定10μL进样检测。
1.6 检测条件
Zorbax SB-C18(2.1 mm×150 mm,5μm),流速0.4 m L·m in-1,柱温30℃,A(0.1%甲酸),B(乙腈);0~4 m in,10%~85%B;4~8 m in,85%~85%B;8~9 m in,85%~10%B;9~10 m in,10%~10%B。ESI(电喷雾离子源),雾化气(N2)压力30 psi,干燥气(N2)的流速7 L·m in-1、温度350℃。选择正离子方式检测,检测电压3.5 kV,采用选择离子监测(SIM)方式进行定量。安非他酮、咪达唑仑和内标阿托品的分子离子峰[M+H]+分别为m/z 240.2,326.3和290.2。
1.7 血浆标准曲线及准确度与精密度的测定
取空白血浆100μL,共9份,精密加入不同量的2种探针药物,使血浆中安非他酮和咪达唑仑的浓度分别为5,10,20,50,100,200,500,1000,2000μg·L-1,按1.5项处理血浆样品。用大鼠空白血浆配制安非他酮和咪达唑仑10,200和1600μg·L-1质控样品,每个浓度进行5样本分析,连续测定3 d,计算准确度与精密度。
1.8 药代动力学参数的测定
测定大鼠单次ig给予安非他酮15 mg·kg-1和咪达唑仑10 mg·kg-1后0.083,0.25,0.5,1,1.5,2,2.5,3,4,6,8,12和24 h血浆中安非他酮和咪达唑仑的平均血药浓度-时间曲线,计算药代动力学参数。
1.9 统计学分析
2 结果
2.1 肝硬化大鼠的体质量、肝系数、GPT和肝微粒体蛋白含量
由表1可见,与正常对照组相比,除TAA组体质量明显降低外(P<0.01),其余3组均无明显变化;4个模型组的肝系数均显著升高(P<0.05),GPT均显著性升高(P<0.01);肝微粒体蛋白含量均显著降低(P<0.05)。
2.2 肝硬化大鼠肝组织形态表现
肉眼见模型组大鼠肝变形,质地变硬,色泽暗淡,表面肉眼可见弥漫分布大小不等的结节样增生,直径0.1~0.3 cm,最大者直径不超过0.7 cm,边缘较薄,被膜增厚切面弥漫性圆形或类圆形结节,纤维间隔较薄且均匀。由图1可见,正常对照组大鼠光镜下可见正常肝小叶结构完整,细胞排列整齐,网状结构完整,胞浆均匀(图1A);模型组大鼠大多可见明显假小叶,肝细胞水肿,脂肪样变性,甚至坏死,炎症细胞浸润,纤维化程度严重。CCl4组与复合法组大鼠肝组织均轻度肝硬化,正常肝小叶结构破坏或消失,被假小叶所取代,假小叶呈圆形或类圆形,部分假小叶由几个不完整的肝小叶构成,内含≥2个中央静脉或1个偏在边缘部的中央静脉(图1B,D);TAA组大鼠肝组织重度肝硬化,伴自溶,假小叶呈圆形或卵圆形,中央静脉缺如,汇管区可包绕在假小叶内,肝细胞索和血窦的排列紊乱,分布极不规则(图1C);免疫组大鼠肝组织轻度肝硬化,假小叶内肝细胞水肿变性,脂肪浸润(图1E)。
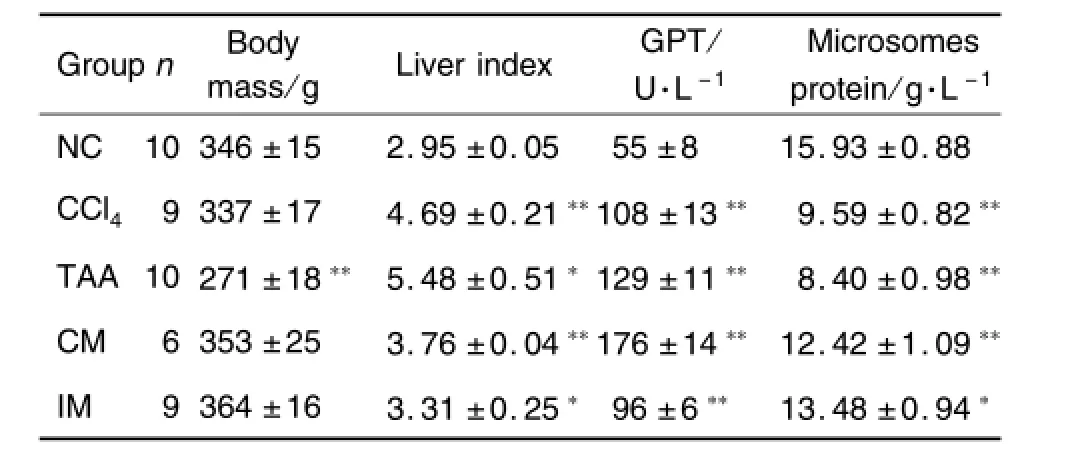
Tab.1 Body mass,liver index,glutamic-pyriuvic transaminase(GPT)and microsomes content in liver of rats with liver cirrhosis
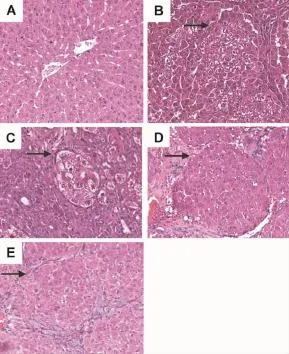
Fig.1 Pathological changes of liver tissue of rats with liver cirrhosis(HE×400).See Tab.1 for the rat treatments.A:NC group;B:CC l4group;C:TAA group;D:CM group;E:IM group.Arrow s show hepatic fibrosis and pseudolobuli.
2.3 肝硬化大鼠体内CYP2B6和CYP3A对药物药代动力学的影响
2.3.1 色谱行为
由图2可见,安非他酮、咪达唑仑和内标阿托品的色谱峰保留时间分别在5.0,5.4和4.4 m in左右,药物与内标分离良好,不受血浆内源物质干扰,基线平稳,本方法具有一定的专属性和特异性。
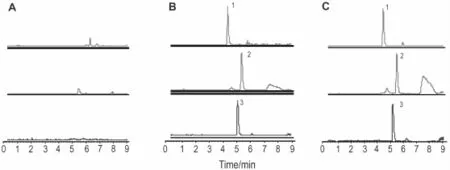
Fig.2 Chromatograms of midazolam and amfebutamone in rat plasma by LC-MS.A:blank plasma sample;B:blank plasma sample spiked with midazolam 500μg·L-1,amfebutamone 500μg·L-1and IS 200μg·L-1;C:plasma sample from a rat1 h after oral administration of amfebutamone 15 mg·kg-1and midazolam 10 mg·kg-1.All analysis was performed with a 1200 Series liquid chromatograph and a Bruker Esquire HCT mass spectrometer equipped with an electrospray ion source.Chromatographic separation was achieved on a 150 mm×2.1 mm,5μm particle,Agilent Zorbax SB-C18 column at30℃.The mobile phase was water(containing 0.1%formic acid)and acetonitrile in a gradient mode.The flow rate was 0.4 m L·m in-1.Peak 1:atropine;peak 2:midazolam;peak 3:amfebutamone.
2.3.2 标准曲线
以探针药的色谱峰面积与内标峰面积比为纵坐标(Y),以探针药的质量浓度与内标质量浓度比为横坐标(X),权重因子为1/X2,进行线性回归,得安非他酮和咪达唑仑的标准曲线回归方程分别为Y=0.0017X+0.0251(r=0.9998);Y=0.0025X+0.0835(r=0.9992),最低定量下线均为5μg·L-1。
2.3.3 准确度与精密度
由表2可见,安非他酮和咪达唑仑的准确度在92.50%~111.88%之间,日内精密度均<8.53%,日间精密度均<8.94%,方法的准确度和精密度均符合生物样品血药浓度分析的要求。
2.3.4 回收率、基质效应和稳定性
分别用空白血浆和空白基质配制安非他酮和咪达唑仑10,200和1600μg·L-1的质控样品,每个浓度进行5样本分析,根据基质加入前后和样品提取前后质谱信号响应的色谱峰面积比,计算基质效应与提取回收率。结果表明,基质效应均在90%~110%之间,提取回收率均>86.67%。
分别考察安非他酮和咪达唑仑10,200和1600μg·L-1的质控样品在不同保存条件下的稳定性,结果表明其在室温放置12 h、预处理后室温放置24 h、反复冻融3次和-40℃冰箱内冷冻保存14 d,血浆样品测定结果稳定。
2.3.5 药动学参数
图3和表3结果显示,4种不同因素诱导大鼠肝硬化模型后,与正常对照组相比,CCl4组和TAA组的2个探针药AUC均显著性升高(P<0.05),清除率Cl/F均显著性下降(P<0.05),cmax显著性升高(P<0.01),V/F降低(P>0.05);复合法组2个探针药cmax均显著性下降(P<0.05),C l/F显著升高(P<0.05);免疫组2个探针药的药代参数均无统计学意义(P>0.05)。与正常对照组相比,4个探针药的半衰期t1/2变化均不明显。
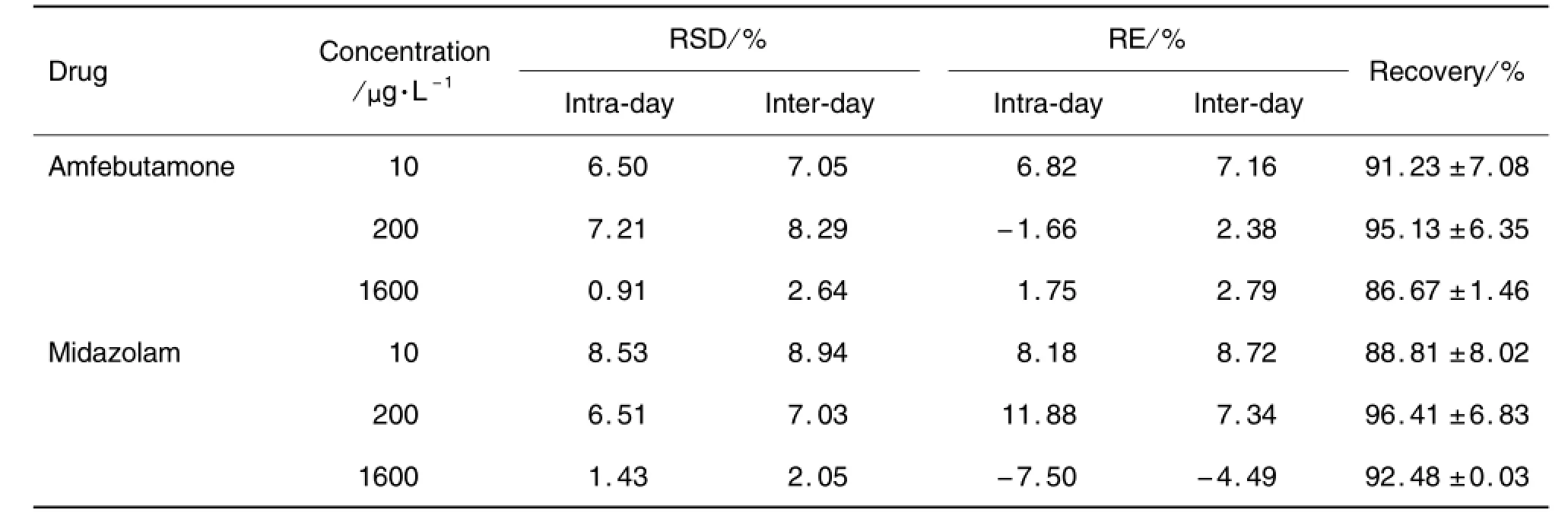
Tab.2 Accuracy,precision and recovery of amfebutamone and midazolam in rat plasma by LC-MS
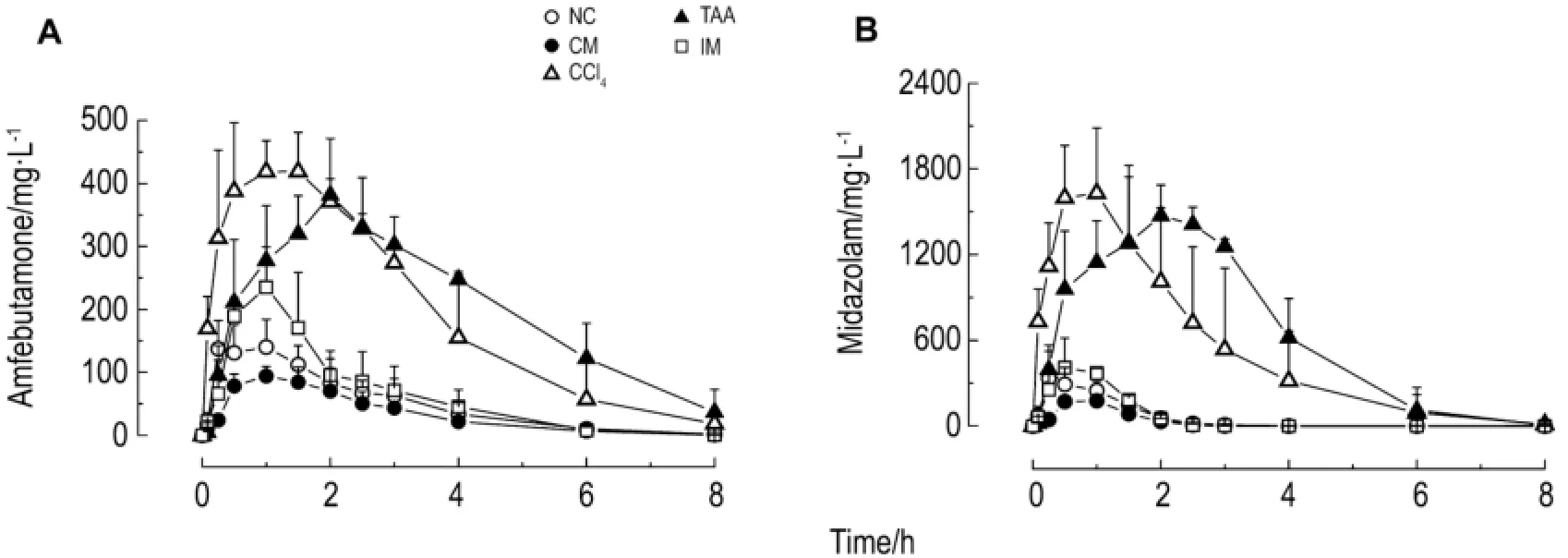
Fig.3 Concentration-time curves of amfebutamone(A)and midazolam(B)in rats with liver cirrhosis.All rats of the five groups were ig administered with amfebutamone 15 mg·kg-1and midazolam 10 mg·kg-1.Then the blood samples(0.3 m L)were collected from the tail vein into heparinized 1.5 m L polythene tubes at0.083,0.25,0.5,1,1.5,2,2.5,3,4,6,8,12 and 24 h after administration.,n=6-10.
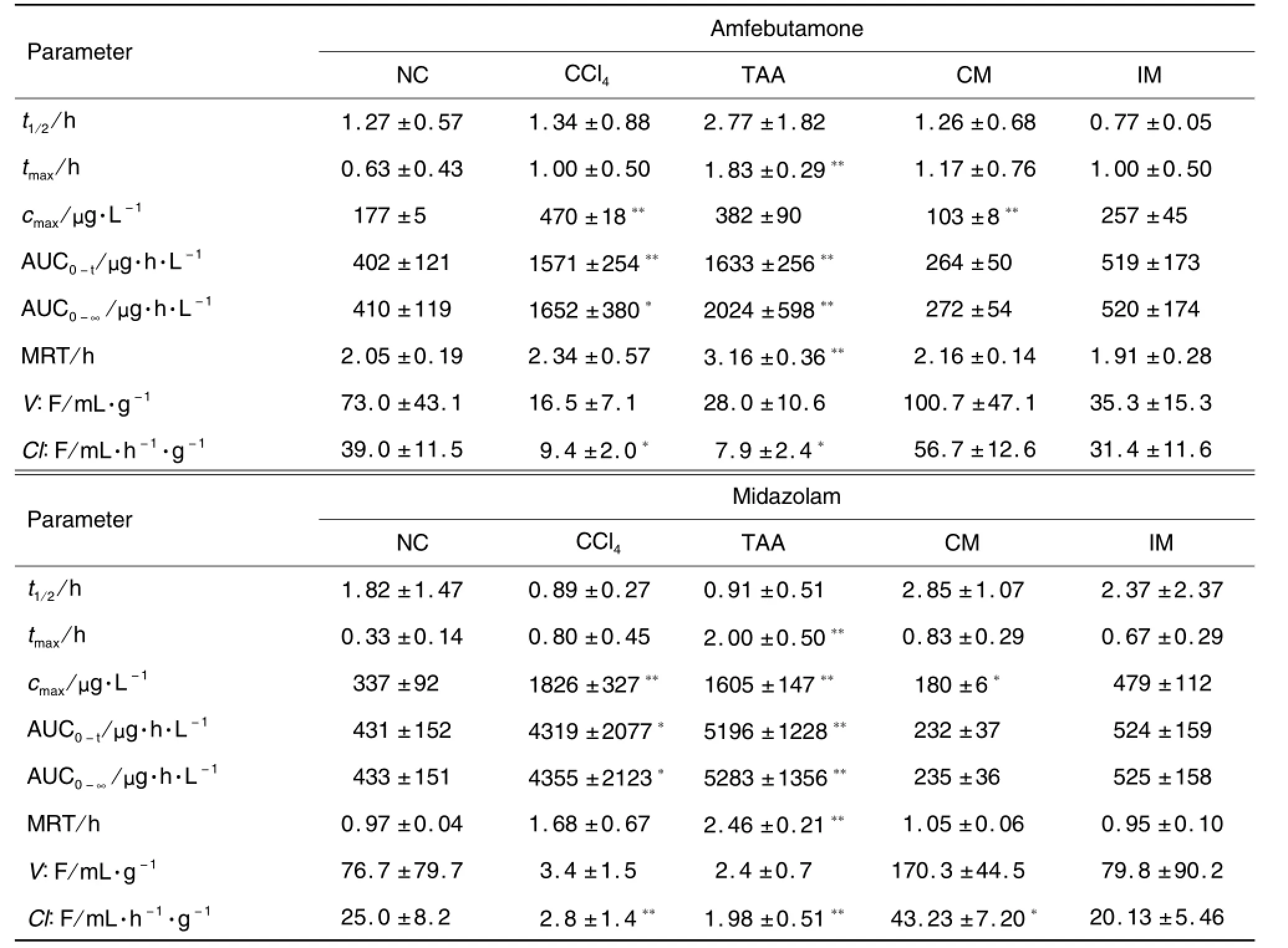
Tab.3 Pharmacokinetic parameters of amfebutamone and midazolam in rat plasm
3 讨论
肝硬化是严重威胁人类健康的常见疾病,以肝纤维化和肝细胞结节性增生为基本病变特征[7]。肝损伤时产生的炎症因子能通过各种促纤维化因子促进HSC的活化,分泌多种细胞因子并产生活性氧,使HSC转变为分泌胶原能力更强的肌成纤维细胞(myofibroblast,MFB),致使ECM大量沉积,形成肝纤维化。肝纤维化和肝硬化时,肝脏药物代谢和抗氧化功能降低。作为参与内、外源性化合物Ⅰ相代谢反应的重要超家族酶系,肝硬化大鼠体内CYP的研究对于肝损伤患者的临床用药具有一定的参考价值。
CYP超家族包括14个家族,26个亚家族,50多种具有催化功能的亚型。CYP1,CYP2和CYP3是参与药物代谢的主要家族,其中CYP3A代谢约50%的临床药物和内源性物质,CYP3A与CYP2B共同参与了约75%的经CYP代谢的临床药物的代谢。胡小玲等[8]采用小肠黏膜上皮细胞微粒体体外实验,结果表明肝硬化时大鼠的小肠CYP3A活性明显升高,达到正常对照组的3.4倍。本研究发现肝硬化大鼠的肝微粒体蛋白含量明显降低,表明大鼠肝CYP酶活性很可能降低。这可能与机体对肝硬化时口服药物经肝代谢能力降低的代偿作用有关。
CCl4组2个探针药的AUC与cmax均显著升高,说明探针药在体内血药浓度升高。肠道吸收增加与体内消除变慢均能引起血药浓度升高。由于药物的消除半衰期主要与代谢药物的肝药酶活性有关,而半衰期无显著性差异,因此Cl/F的下降可能与CCl4反复作用于肝脏引起急、慢性肝脏损害,使肝代谢下降相关。表明CCl4组大鼠肝CYP3A与CYP2B活性降低,CCl4引起肝损害与CCl4被肝微粒体内依赖于CYP的混合功能酶的激活,产生自由基CCl3及Cl-1有关。
TAA组2个探针药的AUC,cmax,tmax与MRT均显著升高,而清除率C l/F均显著性下降,这表明TAA组肝硬化大鼠体内CYP3A与CYP2B酶活性也降低。TAA能延长肝细胞有丝分裂过程,并阻碍RNA从胞核到胞质的转移,进而影响依赖酶CYP的代谢过程,最终形成肝细胞坏死。
复合法组cmax均显著降低,Cl/F均升高,这可能与复合法组大鼠在给予CCl4的同时饮酒高脂喂饲有关。乙醇可使小鼠肝组织NF-κB表达升高,激活炎症反应,使HSC活化并伴有NF-κB等转录因子的激活及c-myb基因表达的增强,而c-MYB蛋白可结合α-SMA基因调控区表达α-SMA[9]。
与正常对照组相比,免疫组大鼠探针药的药代参数均无统计学意义。这可能是由于BSA引发机体免疫应答反应,在肝门脉汇管区形成免疫复合物沉积,从而引起局部炎症反应,并刺激胶原增生而造成肝组织纤维化,以致于不影响CYP酶活性。
模型组探针药的半衰期t1/2变化均无显著性差异,这可能与肝硬化大鼠的小肠黏膜上皮细胞抗氧化功能和膜流动性明显降低有关。由于小肠CYP活性升高,使氧化代谢过程中产生过多的氧自由基,引起膜结构与功能的改变,并进一步影响膜通透性、酶蛋白活性,降低机体抗氧化功能[10]。
实验过程中,大鼠死亡的主要原因可能为对药物的耐受性比较差和急性肝坏死,而复合法组大鼠死亡率偏高,可能与大鼠厌酒以及高脂喂饲有关。
总之,CCl4和TAA诱导的肝硬化模型大鼠体内CYP2B6和CYP3A酶活性降低,易造成某些主要经肝代谢的药物蓄积。以肝硬化动物模型进行药物代谢方面研究时,应当注意到CYP的变化情况。
[1] Pinzani M.Foreword to liver fibrosis[J].Best Pract Res Clin Gastroenterol,2011,25(2):193-194.
[2] Zhang XL,Yue J.Progress in selection of tool drugs and species differences of cytochrome P450[J].Chin J Pharmacol Toxicol(中国药理学与毒理学杂志),2012,26(5):697-701.
[3] Walsh JS,Miwa GT.Bioactivation of d rugs:risk and drug design[J].Annu Rev Pharmacol Toxicol,2011,51:145-167.
[4] Zhou J,Wang CX,Pan DY,Zhou T,Hou LB.Effects ofyinning tablet on gene expression of cytochrome P450 in liver tissue of rats with hyperthyroidism liver damage[J].China Pharm(中国药房),2012,23(39):3667-3669.
[5] Wang X,Bai KH,Sun K,Zhang SQ.Inductive effects of artemisinin-based antimalarials on nuclear receptor CAR and CYP2B in rats liver[J].Chin Rem Clin(中国药物与临床),2010,10(8):849-851.
[6] W ang H,Chen M,Liao ZX.Changes of liver xenobiotic-me tabolizing function a t different status of hepatic in jury[J].Chin Pharmacol Bull(中国药理学通报),2004,20(7):772-775.
[7] Hauso O,Gustafsson BI,Nordrum IS,Waldum HL.The effect of terguride in carbon tetrachlorideinduced liver fibrosis in rat[J].Exp Biol Med(Maywood),2008,233(11):1385-1388.
[8] Hu XL,Wang H,Wu JL,Liao ZX.Changes of drug-metabolizing function of small intestinal mucosal epithelial cells in hepatic fibrosis rats[J].Chin J Phatmacol Toxicol(中国药理学与毒理学杂志),2004,18(5):379-384.
[9] Guan TM,Liu DC,Wang JF,Cai S,Lin MJ,Lu RR2,et al.Protective effect of extract from fruit of Clausena lansium(Lour.)Skeels against acute alcohol-induced hepatotoxicity in mice[J].Chin J Pharmacol Toxicol(中国药理学与毒理学杂志),2012,26(6):829-834.
[10] Murugan RS,Uchida K,Hara Y,Nagini S.Black tea polyphenols modulate xenobiotic-metabolizing enzymes,oxidative stress and adduct formation in a rat hepatocarcinogenesis model[J].Free Radic Res,2008,42(10):873-884.
(本文编辑:付良青)
欢迎订阅2014年《中国药理学与毒理学杂志》
《中国药理学与毒理学杂志》是由中国药理学会、中国毒理学会和军事医学科学院毒物药物研究所共同主办的高级学术性刊物,1986年创刊,双月刊。被北大图书馆评为药学专业中文核心期刊(中文核心期刊要目总览),同时还是中国核心科技期刊、中国学术核心期刊和中国生物医学核心期刊等。本刊被美国《生物学文摘(预评)》(BAP)和美国《化学文摘》(CA)等十余家数据库收录。
《中国药理学与毒理学杂志》设有前言论坛、论著、实验方法和综述栏目。读者对象主要为从事药理学、毒理学、药学、医学和生物基础科学研究的工作者。本刊中英文稿件兼收,更欢迎投英文稿件。
本刊全年6期,每期定价20.00元。国内外公开发行,国内邮发代号:82-140,国外邮发代号:BM-1051。本刊主要通过邮局订阅,也可以联系编辑部商谈杂志订阅事宜。
地址:北京市海淀区太平路27号六所《中国药理学与毒理学杂志》编辑部
邮编:100850
电话:(010)68276743,(010)66931617
E-mail:cjpt@nic.bm i.ac.cn
杂志网址:http://www.cjpt.ac.cn
Changes in enzyme activity of CYP2B6 and CYP3A in rats with liver cirrhosis
ZHU Jia-yin1,WANG Xian-qin2,ZHU Zi-hua2,HU Lu-feng3,CHEN Xi-wen1
(1.Laboratory Animal Center,2.School of Pharmacy,3.the First Affiliated Hospital,Wenzhou Medica l University,Wenzhou 325035,China)
OBJECTlVETo study the changes of enzyme activity of CYP2B6 and CYP3A in rats with liver cirrhosis.METHODSFifty male SD rats were random ly divided into five groups(n=10):normal control(NC)group,carbon tetrachloride(CCl4)group(the rats were ip given 30%CCl42 m L·kg-1twice weekly for 7 weeks),thioacetamide(TAA)group(the rats were given 0.03%TAA in drinking water for 5 weeks and then 0.04%TAA for another5 weeks),composite method(CM)group(the rats were sc given 40%CCl4once every 3 d and high-fat with 15% alcoholdiet)and immune method(IM)group(the rats were sc given bovine serum album in 20-40 mg·kg-1for11 weeks).All these rats were ig administered with amfebutamone 15 mg·kg-1and midazolam 10 mg·kg-1.Then,the blood samples(0.3 m L)were collected from the tail vein into heparinized 1.5 m L polythene tubes at 0.083,0.25,0.5,1,1.5,2,2.5,3,4,6,8,12 and 24 h after administration.The plasma concentrations of amfebutamone and midazolam were measured by LC-MS.RESULTSThere was obvious difference in plasma concentrations and corresponding pharmacokinetic parameters of amfebutamone and midazolam in rats after administration.Com pared with the NC group,the AUC of two probe d rugs increased significantly(P<0.05),so did the cmax(P<0.01),while the Cl/F decreased significantly(P<0.05)in CCl4and TAA groups.In CM group,the cmaxof two probe drugs decreased significantly(P<0.05).However,pharmacokinetic parameters of two probe drugs in IM group hardly changed compared with the control group.CONCLUSlONIn CCl4and TAA groups,the enzyme activity of CYP2B6 and CYP3A decreases in rats with liver cirrhosis.
probe;liver cirrhosis;pharmacokinetic;CYP2B6;CYP3A
CHEN Xi-wen,E-mail:chenxiwen7115@163.com,Tel:(0577)86689908
R969.1
A
1000-3002(2014)01-0081-07
Foundation item:The project supported by Laboratory Animal Science and Technology Prog ram of Zhejiang Province(2012C37101);Fund of Zhejiang Education Burean(Y201119284);Technological Research Program of Wenzhou City(Y20110160);and Technological Research Program of Wenzhou City(Y20110134)
2013-02-01 接受日期:2013-08-25)
浙江省科技厅实验动物科技计划项目(2012C37101);浙江省教育厅科研基金(Y201119284);温州市科技局科研基金(Y20110160);温州市科技局科研基金(Y20110134)
朱加银(1983-),男,实验师,硕士,主要从事医学实验动物学研究,E-mail:zjiayin@163.com。
陈锡文,E-mail:chenxiwen7115@163.com,Tel:(0577)86689908

