表没食子儿茶精的小鼠急性肝损伤和代谢动力学的性别差异
葛 建,刘 洋,王梦馨,崔 林,韩宝瑜
(中国计量学院1.生命科学学院,2.浙江省生物计量及检验检疫技术重点实验室,浙江杭州 310018)
表没食子儿茶精的小鼠急性肝损伤和代谢动力学的性别差异
葛 建1,2,刘 洋1,王梦馨1,崔 林1,韩宝瑜2
(中国计量学院1.生命科学学院,2.浙江省生物计量及检验检疫技术重点实验室,浙江杭州 310018)
目的从对表没食子儿茶精(EGCG)药物代谢动力学差异性角度,探索EGCG导致小鼠急性肝损伤的性别差异。方法小鼠ip给予EGCG 300 m g·kg-1后,采用试剂盒检测小鼠血清酶谷丙转氨酶(GPT)、乳酸脱氢酶(LDH)、琥珀酸脱氢酶(SDH)和鸟氨酸氨基甲酰转移酶(OCT)的活性变化,荧光酶标仪检测肝线粒体膜电位变化,反相高效液相色谱法分析EGCG的血药浓度,荧光免疫组织化学法检测小鼠肝细胞中羧酸酯酶Ⅱ含量。结果小鼠ip给予EGCG后,雌雄小鼠血清中GPT和LDH均显著升高(P<0.05),雌性较雄性小鼠升高显著(P<0.01),SDH和OCT活性变化均不显著。雌性小鼠肝细胞线粒体膜电位变化较雄性小鼠显著(P<0.05)。HE肝组织学观察显示,雌性和雄性小鼠肝组织形态变化均不明显。但电子显微镜组织学观察表明,雌性小鼠肝细胞线粒体溶胀、裂解及电子密度增加均较雄性显著。雄性小鼠较雌性对EGCG代谢迅速,消除半衰期较短。代谢酶鉴定结果表明,羧酸酯酶Ⅱ为EGCG发生水解反应的主要酶类。荧光免疫组织化学法研究表明,羧酸酯酶Ⅱ在雄性小鼠体内含量较雌性高。结论EGCG导致雌性小鼠急性肝损伤比雄性小鼠严重。
表没食子儿茶精;急性肝毒性;毒物代谢动力学;性别差异
DO l:10.3867/j.issn.1000-3002.2014.01.012
茶多酚为茶叶中的主要成分,占茶叶干重的18%~36%[1]。茶多酚的主要成分是儿茶素类化合物,其中以酯型表没食子儿茶精(epigallocatechin gallate,EGCG)含量最高,占儿茶素的50%~60%。国内外大量研究表明,EGCG具有抗癌、抗突变、预防和治疗心脑血管系统疾病以及调理内分泌、免疫系统和干预化学毒物引起的肝损伤和肝纤维化等生物活性[2-8]。EGCG对外源性化学毒物的解毒机制很可能通过调节核受体2介导的抗氧化和解毒作用[9]。体外研究表明,EGCG对细胞色素酶(CYP)类具有较强烈的抑制作用,从而导致部分药物体内药物代谢动力学过程的改变[10]。研究表明,EGCG能够抑制卵巢芳香化酶活性,同时增强CYP3A和CYP2E1活性,但对雄性小鼠前列腺中芳香化酶未表现出明显抑制作用[11]。
近年来研究表明,ip给予大剂量EGCG对肝损伤毒性较强,而且具有性别和种属差异性[11]。因此,本研究在前人的基础上,采用单剂量ip给予EGCG,进一步探索EGCG肝损伤机制,同时观察EGCG在不同性别小鼠体内的药代动力学差异性,鉴定EGCG在体内代谢酶以及酶活性的性别差异,从体内药代动力学和代谢酶差异性的角度深入揭示儿茶素引起急性肝损伤性别差异性的机制,以期为儿茶素类化合物在医药领域的深层次应用和保健品研发提供理论依据和安全性参考。
1 材料与方法
1.1 试剂和仪器
EGCG标准品,购自杭州和田生物技术有限公司,批号:20101012,纯度>98%;色谱甲醇和色谱乙腈,均购自杭州米克化工仪器有限公司,其他试剂为分析纯。罗丹明123,美国Sigm a公司。谷丙转氨酶(glutamic pyruvic transaminase,GPT)、乳酸脱氢酶(lactate dehydrogenase,LDH)、琥珀酸脱氢酶(succinic dehydrogenase,SDH)和鸟氨酸氨基甲酰转移酶(ornithine carbamyl transferase,OCT)试剂盒,购自南京建成生物工程有限公司。TECNAI10型透射电子显微镜,荷兰FEI公司;MK-3台式荧光检测仪,荷兰雷勃生物医学有限公司;Shim adazu 20AT高效液相色谱系统,日本岛津公司;N2000色谱工作站,浙江大学智达公司。
1.2 酶活性及线粒体膜电位的测定
雌性和雄性ICR小鼠300只,体质量23~27 g,由浙江省医学科学院实验动物中心提供,动物许可证号:SCXK(浙)20080033,于本实验室IVC独立通气笼中适应性饲养1周。将不同性别小鼠随机分组,每组6只,分别ip给予EGCG 300 m g·kg-1,于注射前、注射后1和8 h采集血清,按照试剂盒说明书分别检测GPT,LDH,SDH和OCT酶活性,生理盐水为对照组。同时按照文献[12]方法制备肝细胞线粒体悬液,罗丹明染色后,荧光酶标仪检测荧光强度值,根据荧光强度值的变化判断EGCG对小鼠线粒体膜电位损伤。
1.3 肝组织病理学检查
切除小鼠肝左侧叶边缘部分,于10%甲醛溶液中固定48 h,石蜡包埋,制备5μm厚切片,HE染色后光学显微镜下观察细胞结构变化。将小鼠肝组织(≤1 mm3)于2.5%戊二醛水溶液中固定2 h,PBS 0.1 m ol·L-1漂洗2次,1%锇酸溶液染色1 h后,PBS再次漂洗,2%醋酸铀漂洗,梯度乙醇溶液脱水,然后分别用无水乙醇和无水丙酮浸泡脱水,环氧树脂包埋、聚合、切片、染色后于电子显微镜下观察。
1.4 EGCG高效液相色谱分析法建立
参照文献[13]EGCG定量检测方法,采用色谱柱为大连伊利特Hypersil BDS C18柱(250 mm× 4.6 mm,5μm),流动相为乙腈∶0.1%枸橼酸水溶液=10∶90;柱温30℃,波长280 nm;流速为1.0 m L·m in-1;进样量为20μL,外标法定量。
精密吸取0.3 m L正常小鼠血浆,分别加入含EGCG系列工作液10μL,混匀后制成含EGCG浓度范围0.1~200.0 m g·L-1的对照品血浆,分别向其中加入20%维生素C水溶液30μL,混匀后加入乙酸乙酯3 m L,涡漩1 m in,低温离心5 m in后取出有机相于尖底玻璃离心管中,按上述方法重复萃取1次,合并有机相于氮气流下40℃水浴挥干,向残渣中加入0.1 m L 20%乙腈水溶液,3 181×g高速离心后取20μL行HPLC分析。按上述方法制备分别含EGCG 0.2,10.0和50.0 m g·L-1质控样品,按照上述方法处理后进样分析,每个浓度重复5次,以样品中药物与直接溶于流动相下峰面积比值,计算EGCG 0.2,10.0和50 m g·L-1浓度下提取回收率。比较以上样品于日内5次和日间5次测定的峰面积变化,计算日内和日间精密度。同时将峰面积代入标准曲线方程,计算EGCG浓度,与加入浓度比较,求得方法回收率,用以表示分析方法准确度。
制备含EGCG 10.0和50.0 m g·L-1的血浆样品,室温保存,按照上述处理方法分别于0,1,3和7 h各一式3份进行测定;同时按照上述相同方法配制含EGCG 10.0和50.0 m g·L-1的血浆样品于-20℃保存,分别于0,5,10和30 d各一式3份进行处理测定,计算不同保存条件和放置时间下EGCG浓度变化来反映样品稳定性。
1.5 计算EGCG血药浓度和药物代谢动力学参数
雌性和雄性ICR小鼠随机分组,每组5只,单次ip给予EGCG 150 m g·kg-1,分别于注射后2,15,30 m in,1,2,4,8,12和18 h眼球取血,分离血浆,根据文献[14]方法处理血浆样品,按照1.4方法检测不同时间点血浆中EGCG含量,绘制血药浓度时间曲线,利用药代动力学计算公式,计算药代动力学参数。
1.6 EGCG代谢酶的鉴定
制备正常小鼠血浆,设生理盐水组、毒扁豆碱组、普鲁卡因胺组、辛硫磷组和洛哌丁胺组,分别向血浆中加入上述不同水解酶特异性抑制剂,终浓度为30 m g·L-1,混匀后向每组血浆中加入EGCG标准液,使得终浓度为50 m g·L-1,放入37℃水浴中反应0,5,10和30 m in,于不同时间点取样检测其中EGCG含量,根据EGCG浓度变化速率鉴定EGCG体内的主要代谢酶。
1.7 不同性别小鼠EGCG代谢酶活性的测定
向雌性和雄性小鼠血浆中加入一定浓度的EGCG,分别于37℃水浴中反应0,5,10和30 m in,于不同时间点取样检测其中EGCG含量,根据EGCG浓度变化速率来判断不同性别小鼠血浆中代谢酶活性差异。
1.8 荧光免疫组织化学染色法检测CES-Ⅱ蛋白表达
雌性和雄性小鼠的肝组织经约5%甲醛,常规石蜡包埋,切片厚度为6μm。切片脱蜡水化,枸橼酸盐缓冲液抗原修复,加入一抗(CES-Ⅱ抗体),4℃冷藏2 h,室温放置30 m in,PBS缓冲液冲洗后加入FITC标记的二抗,室温孵育15 m in,PBS缓冲液洗片,封片,荧光显微镜观察,出现绿色荧光者记为阳性细胞。
1.9 统计学分析
2 结果
2.1EGCG对不同性别小鼠的急性肝损伤作用
小鼠大剂量单次ip给予EGCG后1和8 h,雌性和雄性小鼠血清中GPT,LDH,SDH和OCT活性与对照组相比均有所改变,其中雌性和雄性小鼠血清中GPT含量变化具有显著性差异(P<0.05),与文献[11]报道结果相一致(表1)。同时肝细胞线粒体膜电位损伤研究结果显示,ip给予EGCG后雌雄小鼠线粒体均受到显著破坏,其中雌性小鼠损伤较雄性严重(图1)。
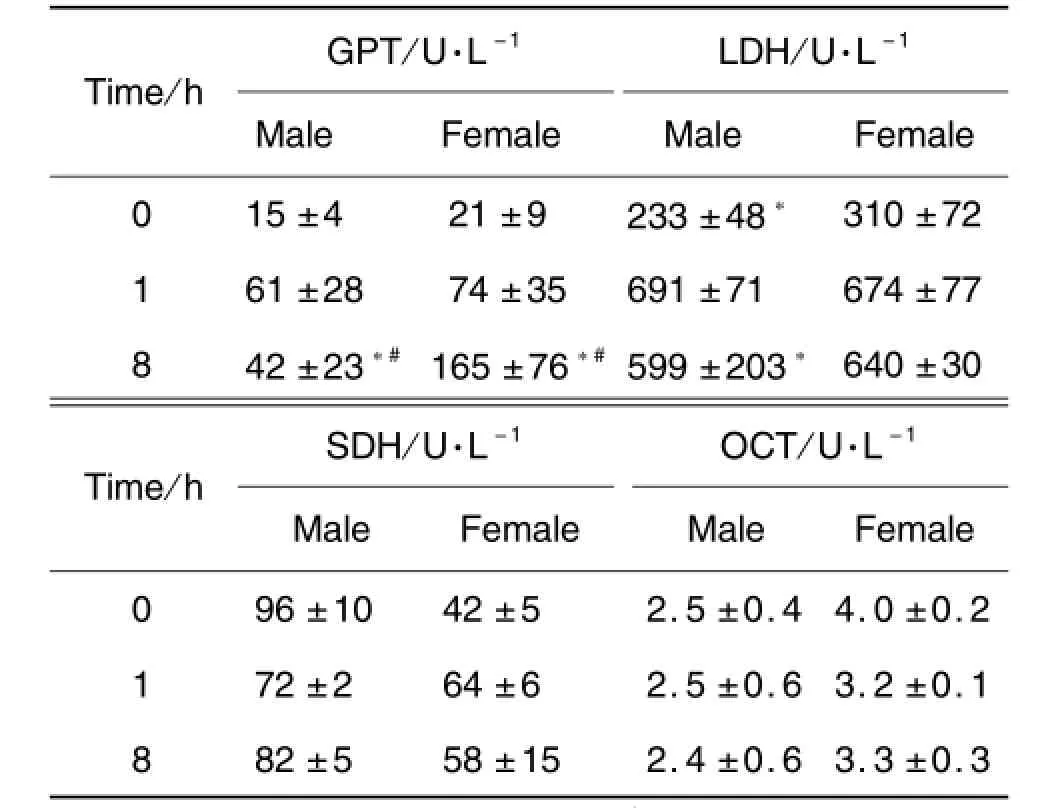
Tab.1 Effect of epigallocatechin gallate(EGCG)on GPT,LDH,SDH and OCT activity in male and female lCR mice
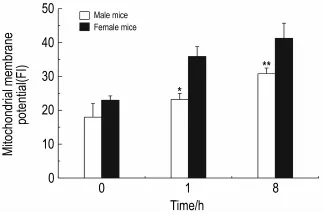
Fig.1 Effect of EGCG on mitochondrial membrane potential in livers of male and female mice.See Tab.1 for mouse treatment.,n=6.*P<0.05,**P<0.01,compared with female mice at the same time.
组织学检查结果表明,EGCG所致急性毒性肝细胞结构未见明显的肝坏死,肝索和肝血窦清晰可见(图2)。电子显微镜观察显示,雌性小鼠肝细胞中线粒体明显溶胀和溶解(图3B),雄性小鼠线粒体损伤较雌性轻(图3C)。
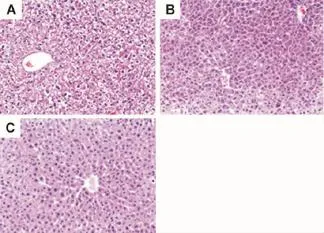
Fig.2 Effect of EGCG on liver morphological changes of male and female mice(HE×200).See Tab.1 for the mouse treatment.A:normal control;B:male mice,8 h after administration of EGCG;C:female mice,8 h after administration of EGCG.
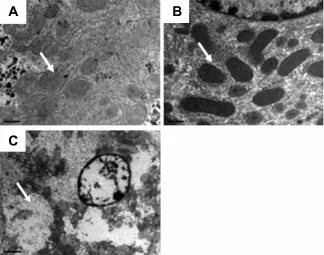
Fig.3 Effect of EGCG on subcellular structure of livers of male and female mice(×15 000).See Tab.1 for the treatment.A:normal control;B:male mice,8 h after administration of EGCG;C:female m ice,8 h after administration of EGCG.Arrows show mitochondria in hepatocytes.
2.2 血浆中EGCG检测方法
在本研究样品的处理方法和色谱条件下,血浆在EGCG 0.1~200.0 m g·L-1范围内,线性关系良好,在EGCG保留时间处无干扰峰出现(图4)。利用线性回归方程计算出斜率、截距以及相关系数。标准曲线方程为y=12037x+560.33(r=0.9999)。EGCG在血浆中的回收率>85.0%,日内和日间变异系数均<10%,准确度>95%,说明EGCG在小鼠血浆中回收率较好,精密度和准确度符合检测要求(表2)。同时稳定性检测显示EGCG 10.0和50.0 m g·L-1室温保存的相对浓度分别为100.0%,98.5%,97.6%和96.9%以及100.0%,98.0%,96.6%和95.6%。-20℃保存的相对浓度分别为100.0%,100.2%,100.5%,99.5%和100.0%,99.8%,98.7%和97.0%。结果表明,室温下样品至少可以稳定7 h,-20℃样品至少可以稳定30 d。

Fig.4 Chromatographs of EGCG in serum.A:EGCG standard;B:blank plasma;C:blank plasma spiked with EGCG;D:plasma chromatogram after administration;Peak 1:EGCG.
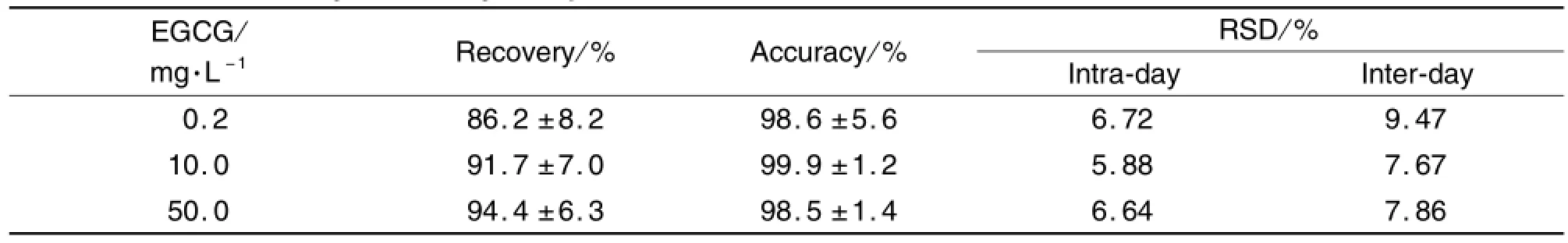
Tab.2 Plasm a recovery,accuracy and precision of EGCG in serum of mice
2.3 EGCG在雄性和雌性小鼠的药代动力学的比较
图5为血药浓度和时间曲线图。根据药代动力学计算公式得出EGCG药代动力学参数见表3。
结果显示,EGCG在雄性小鼠体内半衰期较雌性短,清除率较雌性大,说明其在雄性小鼠体内代谢清除较雌性快。
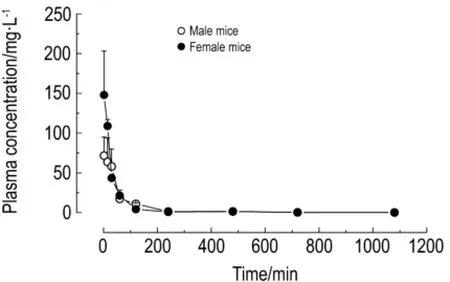
Fig.5 Concentration-time curve of plasma EGCG in male and female mice.Mice were ip given EGCG 150 mg·kg-1,plasma was collected at0,2,15,30 min and 1,2,4,8,12,18 h,and plasma concentrations were determined by high performance liquid chromatography.,n=5.
2.4 EGCG血清中的代谢酶
图6结果表明,生理盐水对照组代谢较迅速,毒扁豆碱组代谢与对照组相似,普鲁卡因胺和洛哌丁胺组EGCG代谢曲线变化较平缓,说明可不同程度地抑制EGCG的代谢,辛硫磷组抑制最强烈,由于辛硫磷为酯酶类非特异性强烈抑制剂,普鲁卡因胺和洛哌丁胺分别为羧酸酯酶Ⅰ和Ⅱ的特异性抑制剂。因此提示,EGCG在血浆中主要为羧酸酯酶Ⅰ和Ⅱ所代谢。
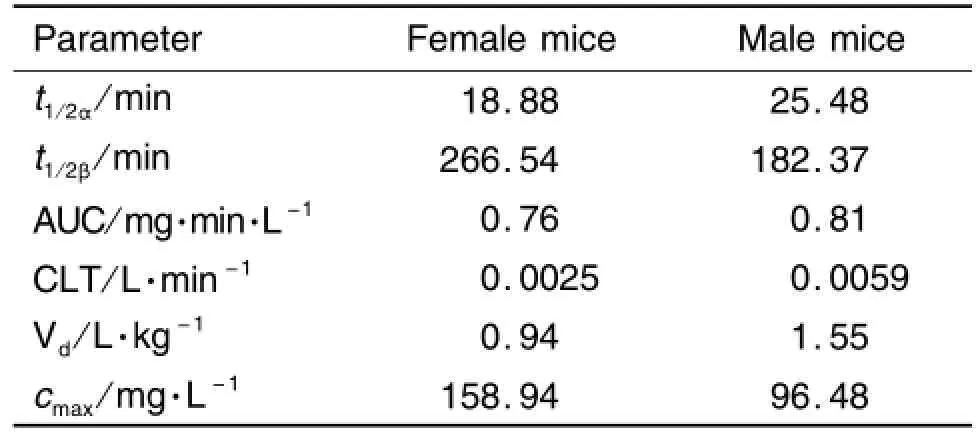
Tab.3 Pharmacokinetic parameters of EGCG 300 m g·kg-1in m ale and fem ale m ice

Fig.6 Metabolic inhibition of EGCG by different inhibitors.,n=5.
2.5 不同性别小鼠EGCG代谢酶活性差异
图7结果表明,EGCG在雄性小鼠血浆中代谢较雌性小鼠迅速。
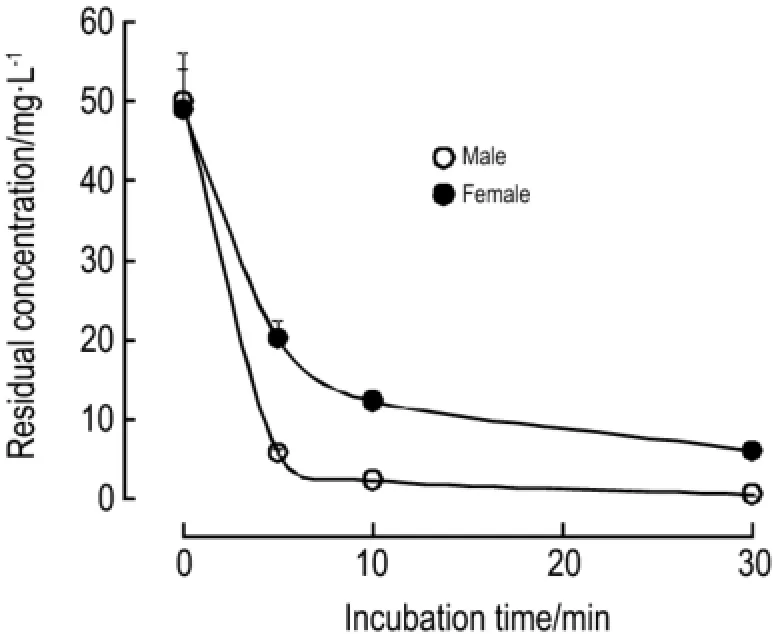
Fig.7 In vitro metabolism of EGCG in plasma of male and female mice,n=5.
2.6 不同性别小鼠肝细胞CES-Ⅱ蛋白表达差异
荧光免疫组织化学染色结果显示,雌雄小鼠肝细胞中CES-Ⅱ表达量均较高(图8),尤以肝小叶中央静脉处含量最高。雌雄肝组织表达量比较表明,雄鼠肝组织中CES-Ⅱ的表达量明显高于雌鼠肝组织,并与代谢酶活性检测结果相一致。
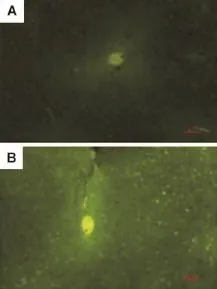
Fig.8 Effect of EGCG on CES-Ⅱexpression in livers of male(A)and female(B)mice(×400).
3 讨论
本研究结果显示,单剂量ip给予EGCG表现出明显急性肝损伤,同时也具有明显的性别差异性,与文献研究结果相一致。本研究发现,EGCG引起肝损伤的主要部位为线粒体损伤,可能是EGCG作用于线粒体膜转换蛋白,从而引起线粒体膜电位的显著改变,进而表现出肝细胞损伤。至于EGCG导致线粒体膜转换蛋白发生改变的机制有待进一步研究,根据文献推断有可能为EGCG干扰了肝细胞内钙离子流的变化,从而导致细胞内离子泵的开放紊乱,引起肝细胞损伤[4]。
儿茶素类化合物药代动力学研究结果也显示,此类物质在体内生物利用度较低,主要表现在EGCG难以通过小肠上皮细胞进入循环系统[15],而且进入血液中的EGCG又较易被水解代谢,从而使得经口服未见明显毒性。然而,腹腔注射EGCG,其生物利用度较高,与静脉注射相当,因此大剂量、长期腹腔或静脉注射EGCG均能表现出明显的毒性反应。本研究发现,EGCG在小鼠体内的主要代谢部位为血液,代谢反应主要为水解反应,由于EGCG为内酯型儿茶素,因此推断血浆中酯酶可能为EGCG代谢的主要酶类,它们包括胆碱酯酶和羧酸酯酶两大类。据文献报道,肟硫磷为酯酶的非特异性抑制剂,毒扁豆碱为胆碱酯酶的特异性抑制剂,而普鲁卡因胺和洛哌丁胺分别为羧酸酯酶Ⅰ和Ⅱ的特异性抑制剂[16-17],本研究发现EGCG主要被羧酸酯酶所代谢,羧酸酯酶Ⅱ较酯酶Ⅰ对EGCG代谢强。根据EGCG结构可知,EGCG属于“小酰基大羟基”酯型化合物,此类化合物在体内主要为CES-Ⅱ水解,与抗癌药伊立替康体内代谢结果相一致[18]。将此类抑制剂与儿茶素联用,可降低EGCG在体内的水解代谢速率,从而延长其在体内的驻留时间,增加其药理活性。
雌雄动物由于生理生化机制不同,往往表现在对外源性化合物的药代动力学过程也明显不同。有文献报道,雷公藤甲素在雌雄大鼠体内表现出明显的毒性差异,原因主要是它们对雷公藤甲素的代谢过程有差异[19]。研究EGCG体内药代动力学的文献大多限于体内吸收、分布、代谢和排泄过程,对不同性别代谢差异性研究未见报道,其差异性机制的研究更少。本研究在雌雄小鼠发现EGCG药代动力学差异性可以解释EGCG对雌雄小鼠肝损伤差异性机制。
[1] Chen Y,Wang XG,Wan XC.A new technology of preparation for EGCG[J].J Anhui Agric Univ(安徽农业大学学报),2007,34(3):364-368.
[2] Miao XQ,Na WL,Zhao D,Shi ZL,Yu Y,Jiang FQ,et al.Effects of tea polyphenol on proliferation inhibition and apoptosis in human prostate cancer PC-3M cells[J].Chin J Lab Diagn(中国实验诊断学),2010,14(2):170-173.
[3] Fu Y,MeiS,Chen JG,LaiWQ,Wang Y.Effectof tea polyphenol on high-lipid weight and serum levels of lipid metabolism in rats[J].Chin J Health Lab Technol(中国卫生检验杂志),2009,19(11):2506-2508.
[4] Chen Y,Liu QH.Effects of tea polyphenols on calcium electricity and action potential in guinea pig myocardial cells[J].Chin Pharm J(中国药学杂志),2010,45(3):190-192.
[5] Zaveri NT.Green tea and its polyphenolic catechins:medicinal uses in cancer and noncancer applications[J].Life Sci,2006,78(18):2073-2080.
[6] Nagle DG,Ferreira D,Zhou YD.Epigallocatechin-3-gallate(EGCG):chemical and biomedical perspectives[J].Phytochemistry,2006,67(17):1849-1855.
[7] Zhen MC,Wang Q,Huang XH,Cao LQ,Chen XL,Sun K,et al.Green tea polyphenol epigallocatechin-3-gallate inhibits oxidative damage and preventive effects on carbon tetrachloride-induced hepatic fibrosis[J].J Nutr Biochem,2007,18(12):795-805.
[8] Tipoe GL,Leung TM,Liong EC,Lau TY,Fung ML,NanjiAA.Epigallocatechin-3-gallate(EGCG)reduces liver inflammation,oxidative stress and fibrosis in carbon tetrachloride(CCl4)-induced liver injury in m ice[J].Toxicology,2010,273(1-3):45-52.
[9] Na HK,Surh YJ.Modulation of Nrf2-mediated antioxidant and detoxifying enzyme induction by the green tea polypheno lEGCG[J].Food Chem Toxicol,2008,46(4):1271-1278.
[10] Lin LC,Wang MN,Tsai TH.Food-drug interaction of(-)-epigallocatechin-3-gallate on the pharmacokinetics of irinotecan and the me tabolite SN-38[J].Chem Biol Interact,2008,174(3):177-182.
[11] Goodin MG,Bray BJ,Rosengren RJ.Sex-and strain-dependent effects of epigallocatechin gallate(EGCG)and epicatechin gallate(ECG)in the mouse[J].Food Chem Toxicol,2006,44(9):1496-1504.
[12] Yan LF,Tang XH,Lin N,Gao J,Xu LZ,Tang YH.Mechanism study on liver mitochondrial damage in APAP-intoxicited m ice[J].West China J Pharm Sci(华西药学杂志),2010,25(6):682-684.
[13] Liang J,Fu T,Han GZ,Lyu L,Li N.Sim ultaneous HPLC determ ination of themain active ingredients EGCG and ECG of TP in ra t p lasma[J].Chin J Pha rm Anal(药物分析杂志),2009,29(1):39-43.
[14] Fu T,Liang J,Han G,Lyu L,LiN.Simultaneous determination of the major active components of tea polyphenols in rat plasma by a simple and specific HPLC assay[J].J Chromatogr B Analyt Technol Biomed Life Sci,2008,875(2):363-367.
[15] Vaidyanathan JB,Walle T.Cellular uptake and efflux of the tea flavonoid(-)epicatechin-3-gallate in the human intestinal cell line Caco-2[J].J Pharmacol Exp Ther,2003,307(2):745-752.
[16] Takahashi S,Katoh M,Saitoh T,Nakajima M,Yokoi T.Different inhibitory effects in rat and human carboxylesterases[J].Drug Metab Dispos,2009,37(5):956-961.
[17] Kobayashi Y,Fukami T,Shimizu M,Nakajima M,Yokoi T.Contributions of arylacetamide deacetylase and carboxylesterase 2 to flutamide hydrolysis in human liver[J].Drug Metab Dispos,2012,40(6):1080-1084.
[18] Hosokawa M.Structure and catalytic properties of carboxylesterase isozymes involved in metabolic activation of prodrugs[J].Molecules,2008,13(2):412-431.
[19] Liu L,Jiang Z,Liu J,Huang X,W ang T,Liu J,et al.Sex differences in subacute toxicity and hepatic microsomal metabolism of triptolide in rats[J].Toxicology,2010,271(1-2):57-63.
(本文编辑:付良青)
文献类型标志符号含义及统计表的书写原则
1.文献类型标志如下:普通图书M,会议录C,汇编G,报纸N,期刊J,学位论文D,报告R,标准S,专利P,数据库DB,计算机程序CP,电子公告EB。会议录包括座谈会、研讨会、学术年会等会议的文集;汇编包括多著者或个人著者的论文集,也可标注为M。
电子文献载体类型标志如下:磁带MT,磁盘DK,光盘CD,联机网络OL。
2.统计表内不应空格,若使用符号表示“未测”或“未做”,可用“…”或“ND”表示;如果表示“未测到”或数值小于有效数字,可用“-”或“0.0”“0.00”(据有效数字位数而定)。
Gender role in acute hepatotoxicity and pharmacokinetics of epigallocatechin gallate in mice
GE Jian1,2,LIU Yang1,WANG Meng-xin1,CUILin1,HAN Bao-yu2
(1.College of Life Sciences,2.Zhejiang Provincial Key Laboratory of Biometrology and Inspection&Quarantine,China Jiliang University,Hangzhou 310018,China)
OBJECTlVETo investigate the possible mechanism and sex-dependence of hepatotoxicity induced by epigallocatechin gallate(EGCG)after administration by intraperitoneal injection.METHODSICR mice were ip given EGCG 300 m g·kg-1.Their plasma enzyme activity and mitochondrial membrane potential(MMP)were detected and used as indicators of hepatic dam age.Liver histology was examined by light and electron microscopy.Then,the sex-dependent toxicokinetics and expression of carboxylesteraseⅡwere both determined.RESULTSGlutamic-pyruvic transaminase(GPT)and lactate dehydrogenase(LDH)values significantly increased in serum of mice.GPT increased more significantly in female mice than in male mice.However,the succinic dehydrogenase(SDH)and ornithine carbamyl transferase(OCT)values in serum did not increase significantly between female and male mice.EGCG also contributed to the changes in MMP in the livers of female and male mice after intraperitoneal injection.MMP increased m ore in female mice than in male mice.Although liver slices stained with hematoxylin and eosin revealed few necrotic cells in male and female mice,liver his to logy examined by an electron microscope demonstrated that EGCG produced severe hepatic damage at the subcellular level.Sex-different toxicokinetics showed faster elimination of EGCG in male m ice than in female ones.EGCG was mainly metabolized by hydrolysis and carboxylesteraseⅡwas determined to be the main metabolic enzyme in m ice.Immunohistochemistry detection showed that the protein expression of carboxylesteraseⅡwas very lower in female mice than in male ones.CONCLUSlONEGCG produces more severe hepatotoxicity in female mice than in male ones.
epigallocatechin gallate;acute hepatotoxicity;toxicokinetics;sex difference
HAN Bao-yu,E-mail:hanbaoyu@cjlu.edu.cn,Tel:(0571)86835706
R969.1
A
1000-3002(2014)01-0074-07
Foundation item:The project supported by National Natural Science Foundation of China(31100499);National Natural Science Foundation of China(31071744);and Zhejiang Provincial Innovative Research Team Project of Undergraduate in 2012
2013-03-18 接受日期:2013-08-21)
国家自然科学基金(31100499);国家自然科学基金(31071744);2012年浙江省大学生科研创新团队资助(新苗人才项目)
葛 建(1979-),男,博士,副教授,从事天然产物毒理学及代谢动力学研究,E-mail:gejian16888@163.com。
韩宝瑜,E-mail:hanbaoyu@cjlu.edu.cn,Tel:(0571)86835706

