脑利钠肽激活环鸟苷酸/蛋白激酶G信号通路对线粒体通透性转换孔开放和糖原合成激酶-3β磷酸化的影响
潘国焰 林荣 吴兵 洪美满 陈乘波 黄雪娥
.基础研究.
脑利钠肽激活环鸟苷酸/蛋白激酶G信号通路对线粒体通透性转换孔开放和糖原合成激酶-3β磷酸化的影响
潘国焰 林荣 吴兵 洪美满 陈乘波 黄雪娥
目的 观察脑利钠肽(BNP)激活环鸟苷酸/蛋白激酶G(cGMP/PKG)信号通路对线粒体通透性转换孔(mPTP)开放和糖原合成激酶-3β(GSK-3β)磷酸化的影响。方法 将48只新西兰兔随机分为4组(12只):假手术组;对照组;BNP组;BNP+KT5823组(KT5823为蛋白激酶G抑制剂)。除了假手术组,其余3组均于结扎左回旋支45 min后恢复左回旋支血流,进行再灌注180 min。全程观察血流动力学及心电变化;实验终末,各组随机抽取6只兔子,采用伊文思蓝和氯化三苯基四氮唑双染色法测定左心室心肌梗死面积;每组另外6只兔子心脏取梗死边缘区组织,用TUNEL法检测缺血再灌注心肌细胞的凋亡,Western blotting方法测定P-GSK-3β/GSK-3β、细胞质细胞色素C/线粒体细胞色素C的表达。结果 各组之间HR、MABP差异无统计学意义(均为P>0.05);与对照组相比,BNP组心律失常发生率明显减少(8.3%比83.3%,P<0.0125)。与BNP组比较,BNP+KT5823组心律失常明显增加(75.0%比8.3%,P<0.0125);假手术组无心肌梗死。与对照组比较,BNP组心肌梗死范围明显减少(26.02%±2.17%比40.99%±1.23%,P<0.05)。与BNP组比较,BNP+KT5823组梗死面积明显增加(38.94%±2.04%比26.02%±2.17%,P<0.05);与对照组比较,BNP组GSK-3β的磷酸化水平显著增加(0.7800±0.0506比0.3610±0.0570,P<0.05),细胞质细胞色素C/线粒体细胞色素C明显减少(0.3420±0.0921比0.9530±0.2054,P<0.05)。与BNP组相比,BNP+ KT5823组GSK-3β的磷酸化水平明显降低(0.4037±0.0437比0.7800±0.0506,P<0.05),细胞质细胞色素C/线粒体细胞色素C显著增加(0.8037±0.1001比0.3420±0.0921,P<0.05)。与对照组比较,BNP组心肌细胞凋亡数明显减少(4.6%±2.0%比13.1%±2.7%,P<0.05),与BNP组相比,BNP+KT5823组心肌细胞凋亡数显著增加(12.8%±2.3%比4.6%±2.0%,P<0.05)。结论 BNP激活cGMP/PKG信号通路所产生的心肌保护作用与抑制mPTP的开放有关,cGMP/PKG信号通路的激活可以促进GSK-3β磷酸化。
心肌缺血再灌注损伤; 细胞凋亡; 环鸟苷酸/蛋白激酶G信号通路; 线粒体通透性转换孔; 糖原合成激酶-3β
研究显示,抑制心肌细胞凋亡可明显缩小缺血再灌注心肌梗死的面积[1]。细胞凋亡是主动的有序的细胞死亡的过程,其终末阶段依赖于半胱天冬氨酸蛋白酶(caspase)活化,及其对核内和胞浆内蛋白底物的修饰完成[2]。线粒体通透性转换孔(mitochondrial permeability transition pore,mPTP)[3-4]、糖原合成激酶-3β(glycogen synthase kinase-3β,GSK-3β)[5]在细胞凋亡调控上扮演着重要的角色。已有研究表明,环鸟苷酸/蛋白激酶G(cyclic guanosine monophosphate/ protein kinase G,cGMP/PKG)信号通路[6]产生抗再灌注损伤作用,但cGMP/PKG信号通路的下游底物的分子机制仍未完全阐明。本研究拟观察脑利钠肽(brain natriuretic peptide,BNP)激活cGMP/PKG信号通路对mPTP开放的影响以及对凋亡调控因素GSK-3β的作用,探讨其可能的机制。
1 材料和方法
1.1 实验动物及主要试剂
清洁级3~4月龄新西兰大耳白兔48只,雌雄不拘,体质量1.8~2.0 kg[许可证号:SCXK(沪) 2012-0011],由上海市松江区松联实验动物中心提供,BNP(批号:20120802,西藏药业公司),氯化三苯基四氮唑(TTC)染色剂、Evans Blue(上海圆创生物科技有限公司),KT5823(批号:1205006,美国Sigma公司),线粒体和胞浆蛋白制备试剂盒(北京普利莱基因技术有限公司),二喹啉甲酸(BCA)蛋白检测试剂盒(厦门鹭隆生物科技发展有限公司),P-GSK-3β、GSK-3β、细胞质细胞色素C、线粒体细胞色素C抗体(美国Santa Cruz公司),细胞凋亡试剂盒(瑞士Roche公司)。
1.2 在体兔心肌缺血/再灌注模型制备
参照文献[7]报道制作模型:兔子称重,20%乌拉坦溶液按4 ml/kg麻醉。分离左颈总动脉插入导管至左心室,连接压力换能器,全程记录Ⅱ导联心电图及监测平均动脉压。右侧耳缘静脉置管作为药物输液通道。气管插管连接人工呼吸机作机械通气,沿胸骨左缘第3~5肋间隙开胸,在左心耳与心尖中下1/3左回旋支下方用5-0带线缝合针结扎以阻断左回旋支血流,阻断45 min后,恢复冠状动脉血流180 min。模型成功判断标准:结扎左回旋支后心电图Ⅱ导联ST段呈弓背向上抬高,T波高耸等为缺血成功;放松结扎线后,抬高的ST段回落1/2以上为再灌注成功。实验动物排除的标准:(1)严重的低血压(缺血/再灌注期间平均动脉压不能维持在50 mmHg以上);(2)不可逆的心室颤动。
1.3 实验分组
将48只兔子随机均分为以下4组,每组12只: (1)假手术组:只开胸,不结扎左冠回旋支;(2)对照组(缺血/再灌注组):再灌注前5 min静脉泵入生理盐水,按0.l ml/min,持续整个再灌注期;(3)BNP组:再灌注前5 min经耳缘静脉泵入BNP,浓度0.01 μg.kg-1.min-1,按0.l m l/min速度泵入,持续整个再灌注期;(4)BNP+KT5823组:再灌注前5 min经颈静脉注射KT5823(1 mg/kg),并同时经耳缘静脉泵入BNP,浓度0.01 μg.kg-1.min-1,按0.l ml/min速度泵入,持续整个再灌注期。
1.4 观察指标
1.4.1 血流动力学检测及心律失常发生情况LEAD2000-32多道生理记录仪系统连续监测血流动力学指标:心率(HR)、平均动脉压(MABP)。于缺血前,缺血45 min,再灌注60、120、180 min记录HR、MABP,并观察各组实验动物缺血45 min至再灌注180 min内发生的各种心律失常情况。
1.4.2 心肌缺血和梗死面积测定 再灌注180 min结束后,重新结扎阻断左回旋支血流,先于颈内静脉注入1%伊文思蓝2 ml,待2~3 min后兔子嘴舌均呈蓝色后,再静脉推注10%氯化钾3 ml,使心脏停于舒张期,开胸迅速取心脏,除去大血管、心房及右心室,用磷酸盐缓冲溶液(PBS)液冲洗后,留左心室立即置于-20℃冰箱速冻25 min。取出左心室,沿平行于房室沟的方向均匀横切成约2 mm厚的薄块,置于1%TTC PBS中,37℃避光恒温孵育15 min,此时出现3种颜色:蓝色为非缺血区心肌,砖红色为缺血区内的非梗死区心肌,白色为梗死区心肌。孵育15 min结束后,取出心肌组织置于4%多聚甲醛中固定12 h,分离各种颜色区,电子天平称重,测定左心室、缺血区及梗死区心肌重量。计算缺血区范围=缺血区心肌重量/左心室心肌重量×100%,梗死区范围=梗死区心肌重量/左心室心肌重量× 100%。
1.4.3 Western blotting法检测 再灌注180 min结束后,迅速剪下左心室缺血区,PBS液洗涤干净后,称取100 mg心肌组织,加入1 ml细胞裂解液,机械匀浆,4℃裂解30 min,4℃12 000 r/min离心15 min,收集上清液,分装后保存于-80℃备用。另外称取100 mg心肌组织,按线粒体和胞浆蛋白制备试剂盒说明操作,分别制备细胞质和线粒体蛋白提取物,分装后保存于-80℃备用。用BCA法进行心肌组织蛋白定量,按试剂盒说明操作,562 nm测定吸光度。根据标准曲线计算心肌组织蛋白含量(mg/L)。心肌组织蛋白先进行SDS-聚丙烯酰胺凝胶电泳,然后转移至PDVF膜上,用含10%脱脂奶粉的TBST室温封闭40 min,与1∶1000稀释的GSK-3β、P-GSK-3β、细胞质细胞色素C、线粒体细胞色素C一抗(按1 ml/cm2加入)4℃孵育过夜,1∶2500稀释的二抗室温孵育1 h,最后ECL显影。用Leica图像分析软件将图片上每个特异性条带进行灰度测定。
1.4.4 TUNEL检测缺血心肌细胞凋亡 取梗死边缘区心肌组织,制作石蜡切片,每张厚度5 μm。采用细胞凋亡原位检测试剂盒,DNA末端标记凋亡检测试剂盒检测缺血心肌凋亡细胞。根据凋亡细胞的分布情况,每张切片拍摄5个阳性视野,每份标本的切片随机选取10个200倍不重叠视野,计算凋亡阳性细胞及凋亡指数(apoptotic index,AI=凋亡阳性细胞数/所有心肌细胞数×100%)。
1.5 统计学方法
2 结果
表1 各组缺血再灌注时期的血流动力学参数(±s)

表1 各组缺血再灌注时期的血流动力学参数(±s)
注:与基线水平比较,aP<0.05;与本组缺血45 min比较,bP<0.05
组别兔(只)血流动力学参数基线缺血45 min再灌注60 min再灌注120 min再灌注180 min假手术组12 HR(次/min)255±10对照组12 253±11 230±10a215±11ab212±9ab208±8abBNP组12 251±11 225±9a210±8ab208±10ab211±9abBNP+KT5823组12 249±12 221±12a205±9ab204±11ab207±9ab假手术组12 MABP(mmHg)103±11对照组12 104±8 93±7a81±8ab80±5ab77±6abBNP组12 109±9 94±5a78±6ab76±7ab74±8abBNP+KT5823组12 106±9 92±8a83±9ab80±8ab78±6ab
2.1 血流动力学指标
HR和MABP在基线水平上无明显差异(均为P>0.05)。与基线水平相比,HR和MABP在缺血以及再灌注时期有明显下降(均为P<0.05),而在再灌注时期维持较稳定的水平。各组之间HR、MABP差异无统计学意义(均为P>0.05,表1)。
2.2 心律失常发生率
缺血再灌注导致出现多种类型的心律失常,以室性期前收缩、室性心动过速多见。再灌注期间,兔子可出现心律失常,但多可自行恢复。假手术组无心律失常发生。与对照组相比,BNP组心律失常发生率明显减少(P<0.0125)。与BNP组比较,BNP+KT5823组心律失常明显增加(P<0.0125,表2)。
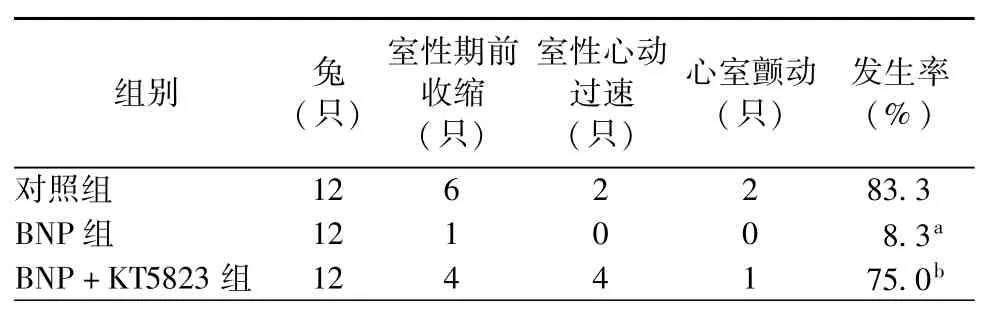
表2 各组心律失常情况
2.3 左心室心肌缺血和梗死面积的大小
各组心肌缺血区和梗死区范围见表3。假手术组无心肌缺血及梗死。各组之间缺血区范围差异无统计学意义(P>0.05)。与对照组比较,BNP组心肌梗死范围明显减少(P<0.05)。与BNP组比较,BNP+KT5823组梗死面积明显增加(P<0.05)。
表3 各组心肌缺血区范围和梗死区范围(±s)
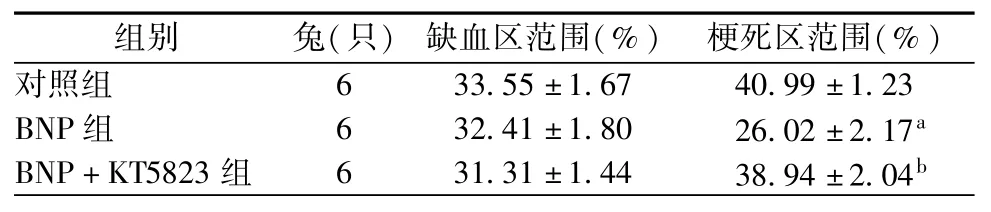
表3 各组心肌缺血区范围和梗死区范围(±s)
注:与对照组比较,aP<0.05;与BNP组比较,bP<0.05
组别兔(只)缺血区范围(%)梗死区范围(%)对照组6 33.55±1.67 40.99±1.23 BNP组6 32.41±1.80 26.02±2.17aBNP+KT5823组6 31.31±1.44 38.94±2.04b
2.4 GSK-3β、P-GSK-3β、细胞质细胞色素C及线粒体细胞色素C蛋白的表达
与对照组比较,BNP组GSK-3β磷酸化水平显著增加,细胞质细胞色素C/线粒体细胞色素C明显减少(P<0.05)。与BNP组相比,BNP+KT5823组GSK-3β磷酸化水平明显降低,细胞质细胞色素C/线粒体细胞色素C显著增加(P<0.05,图1、表4)。

图1 A Western blotting检测P-GSK-3β、GSK-3β表达;图1B Western blotting检测细胞质细胞色素C、线粒体细胞色素C表达
表4 各组P-GSK-3β/GSK-3β、细胞质细胞色素C/线粒体细胞色素C比值(±s)

表4 各组P-GSK-3β/GSK-3β、细胞质细胞色素C/线粒体细胞色素C比值(±s)
注:与对照组比较,aP<0.05;与BNP组比较,bP<0.05
组别兔(只) P-GSK-3β/ GSK-3β细胞质细胞色素C/线粒体细胞色素C假手术组6 0.0308±0.0062 0.0915±0.0396对照组6 0.3610±0.0570 0.9530±0.2054 BNP组6 0.7800±0.0506a0.3420±0.0921aBNP+KT5823组6 0.4037±0.0437b0.8037±0.1001b
2.5 心肌细胞凋亡改变
与对照组(13.1%±2.7%)比较,BNP组心肌细胞凋亡数(4.6%±2.0%)明显减少(P<0.05)。与BNP组相比,BNP+KT5823组心肌细胞凋亡数(12.8%±2.3%)显著增加(P<0.05)。
3 讨论
mPTP的开放是缺血再灌注过程中发生的一个关键的环节,在细胞凋亡中发挥着重要的作用[3]。mPTP是跨越线粒体外膜和内膜的蛋白复合体,生理情况下呈低通透或关闭状态,仅允许相对分子量小于1500的物质通过。再灌注诱发mPTP开放,引起线粒体内物质释放入胞浆,包括Cytc、促细胞凋亡因子等。Cytc释放到胞浆,在dATP/ATP存在下,Cytc与凋亡蛋白活化因子1(APaf-1)形成凋亡复合体,通过Apaf-1氨基端的Caspase募集结构域募集细胞中的Caspase-9前体,一个活化的APaf-1可募集多个Caspase-9,并使其自我剪切和活化,启动Caspase的级联反应,激活下游的Caspase-3和Caspase-7,完成对相应底物的切割,引起细胞凋亡[4]。
研究表明,BNP与BNP受体A结合后,活化鸟苷酸环化酶,促使细胞内cGMP生成增加,cGMP进一步作用于下游底物PKG。cGMP/PKG信号通路参与减轻心肌缺血再灌注损伤的重要作用机制之一就是抑制细胞凋亡[6]。在兔子、大鼠完整心脏中,再灌注即刻给予外源性BNP有利于抑制心肌细胞凋亡,考虑与激活cGMP/PKG信号通路,增加抗凋亡蛋白bcl-2表达,抑制促凋亡蛋白Bax表达及Caspase-3活化有关[7]。
本实验通过测定细胞质/线粒体细胞色素C蛋白水平的变化来判断对mPTP开放的程度。已知心肌梗死面积测定是目前评价心肌缺血再灌注损伤保护效应的金标准,抑制再灌注心律失常的发生,也是对再灌注损伤心肌的一种保护作用。本研究结果显示,与对照组相比,BNP组的心肌梗死面积、心律失常发生率、细胞质/线粒体细胞色素C蛋白水平、心肌细胞凋亡指数明显减少,而给予蛋白激酶G抑制剂KT5823后,与BNP组相比,心肌梗死面积明显增大,心律失常发生率明显增加,细胞质/线粒体细胞色素C蛋白水平明显增高,心肌细胞凋亡指数显著增高,提示BNP激活cGMP/PKG信号通路所产生的心肌保护作用与抑制mPTP的开放有关。
GSK-3β是一种多功能的丝氨酸/苏氨酸类蛋白激酶,其在静息时保持激活状态,而当丝氨酸9位点被磷酸化时,其活性显著降低。研究表明,GSK-3β在控制细胞凋亡信号通路上有重要作用,激活GSK-3β可以诱导细胞发生凋亡,抑制GSK-3β的活性可以减轻心肌缺血/再灌注损伤,其可能的作用机制是通过抑制mPTP的开放,减少Caspase-9和Caspase-3的激活,降低核蛋白的分解与DNA链的剪裂,从而抑制细胞凋亡[5]。目前发现,蛋白激酶B(PKB/ Akt)是GSK-3β的上游调节因子,而PKB/Akt是磷脂酰肌醇-3-激酶(PI3K)下游的主要激酶,许多激活PI3K的刺激通过PKB/Akt的介导而抑制GSK-3β的活性[8]。研究表明,cGMP/PKG信号通路的激活与PI3K/Akt通路的激活有关[6],而GSK-3β是PI3K/Akt的下游底物,因此,推测GSK-3β也可能是cGMP/PKG信号通路的作用底物。本研究结果显示,与对照组相比,BNP组的GSK-3β磷酸化水平明显增高,而给予KT5823后,与BNP组相比,GSK-3β磷酸化水平明显降低,提示cGMP/PKG信号通路的激活可以促进GSK-3β磷酸化,GSK-3β可能为该信号通路成员之一。
综上所述,BNP激活cGMP/PKG信号通路提高了GSK-3β的磷酸化水平,抑制mPTP的开放,最终抑制细胞凋亡而产生心肌保护作用。本研究为BNP作为抗心肌缺血再灌注损伤的药物应用于临床,治疗急性冠脉综合征提供了动物实验基础。
[1]Yu L,Lu M,Wang P,et al.Trichostatin A ameliorates myocardial ischemia/reperfusion injury through inhibition of endoplasmic reticulum stress-induced apoptosis[J].Arch Med Res,2012,43: 190-196.
[2]Pollack M,Leeuwenburgh C.Apoptosis and aging:role of the mitochondria[J].J Gerontol A Biol Sci Med Sci,2001,56: B475-482.
[3]Hausenloy DJ,Ong SB,Yellon DM.The mitochondrial permeability transition pore as a target for preconditioning and postconditioning[J].Basic Res Cardiol,2009,104:189-202.
[4]Crompton M.The mitochondrial permeability transition pore and its role in cell death[J].Biochem J,1999,341:233-249.
[5]Hong L,Xi J,Zhang Y,et al.Atrial natriuretic peptide prevents the mitochondrial permeability transition pore opening by inactivating glycogen synthase kinase 3β via PKG and PI3K in cardiac H9c2 cells[J].Eur J Pharmacol,2012,695:13-19.
[6]Burley DS,Ferdinandy P,Baxter GF.Cyclic GMP and protein kinase-G in myocardial ischaemia-reperfusion:opportunities and obstacles for survival signaling[J].Br J Pharm acol,2007,152: 855-869.
[7]Wu B,Jiang H,Lin R,et al.Pretreatment with B-type natriuretic peptide protects the heart from ischemia-reperfusion injury by inhibiting myocardial apoptosis[J].Tohoku J Exp Med,2009,219:107-114.
[8]Wu QL,Shen T,Ma H,et al.Sufentanil postconditioning protects the myocardium from ischemia-reperfusion via PI3K/Akt-GSK-3β pathway[J].J Surg Res,2012,178:563-570.
Impact of brain natriuretic peptide activated cyclic guanosine monophosphate/protein kinase G signaling pathway on open of m itochondrial perm eability transition pore and phosphorylation of glycogen synthase kinase-3β
Pan Guoyan1,Lin Rong2,Wu Bing2,Hong Meiman2,Chen Chengbo2,Huang Xuee2.
1 Department of Cardiology,Putian First Hospital,Putian 351100,China;2 Department of Cardiology,Quanzhou First Affiliated Hospital of Fujian Medical University
Lin Rong,Email:qzlinrong@163.com
Objective To observe the impact of brain natriuretic peptide(BNP)activated cyclic guanosine monophosphate/protein kinase G(cGMP/PKG)signaling pathway on open of mitochondrialpermeability transition pore(mPTP)and phosphorylation of glycogen synthase kinase-3β(GSK-3β). M ethods Totally 48 New Zealand white rabbits were randomly divided into four groups(12 in each group):sham group,control group,BNP group and BNP+KT5823 group(KT5823 is protein kinase G inhibitor).Occlusion of left circumflex artery for 45 min followed by 180 min reperfusion was performed on rabbits in all groups except those in sham group.Rabbits in sham group underwent open thoracotomy without ligating the left circumflex artery.Hemodynamics and ECG were obtained.At the end of experiment,6 rabbit hearts were stained by Evan's blue/triphenyltetrazolium chloride methods to test the area of infarction. The apoptosis of myocardial cell was determined by terminal deoxynucleotidyl transferase mediated dUTP-biotin nick end-labeling(TUNEL)method.Expression of P-GSK-3β/GSK-3β and cytoplasmic cytochrome C/mitochondrial cytochrome C proteins in the rest hearts were analyzed using western blot assay.Results There was no significant difference in HR and MABP among four groups during I/R period(P>0.05). Rate of arrhythmia was significantly reduced in BNP group than in control group(8.3%vs.83.3%,P<0.0125).Rate of arrhythmia was significantly increased in BNP+KT5823group than in BNP group(75.0% vs.8.3%,P<0.0125).Myocardial infarction did not occur in sham group.Myocardial infarct size was significantly smaller in BNP group than in control group(26.02%±2.17%vs.40.99%±1.23%,P<0.05),and was significantly increased in BNP+KT5823 group than in BNP group(38.94%±2.04%vs. 26.02%±2.17%,P<0.05).Level of GSK-3β phosphorylation was increased significantly and cytoplasm cytochrome C/mitochondrial cytochrome C reduced significantly in BNP group than in control group(0.7800 ±0.0506 vs.0.3610±0.0570,0.3420±0.0921 vs.0.9530±0.2054,both P<0.05).Level of GSK-3β phosphorylation was significantly lower and cytoplasm cytochrome C/mitochondrial cytochrome C increased significantly in BNP+KT5823 group than in BNP group(0.4037±0.0437 vs.0.7800±0.0506,0.8037± 0.1001 vs.0.3420±0.0921,both P<0.05).The apoptotic indices of myocardial cell was significantly smaller in BNP group than in control group(4.6%±2.0%vs.13.1%±2.7%,P<0.05).The apoptotic indices of myocardial cell was significantly increased in BNP+KT5823 group than in BNP group(12.8%± 2.3%vs.4.6%±2.0%,P<0.05).Conclusions The myocardial protective effect of BNP which activate cGMP/PKG signaling pathway is associated with inhibition of mPTP,and activation of cGMP/PKG signaling pathway can promote phosphorylation of GSK-3β.
Myocardial ischemia-reperfusion injury; Apoptosis; Cyclic guanosine monophosphate/protein kinase G signaling pathway; Mitochondrial permeability transition pore; Glycogen synthase kinase-3β
2013-08-10)
(本文编辑:周白瑜)
This work was supported by Quanzhou Technology Plan Funded Project(No.2011Z56)
10.3969/j.issn.1007-5410.2014.02.014
泉州市科技计划项目(2011Z56)
351100福建医科大学教学医院莆田市第一医院心内科(潘国焰);福建医科大学附属泉州第一医院心内科(林荣、吴兵、洪美满、陈乘波、黄雪娥)
林荣,电子信箱:qzlinrong@163.com

