不同脂肪源对管角螺生长和体成分的影响
罗 江, 蒋霞敏, 杜学星
(宁波大学 海洋学院, 浙江 宁波 315211)
脂肪不仅是水产动物重要的能源物质,还能为其提供生长发育所需的必需脂肪酸,不同油脂的脂肪酸组成有较大差异,不同水产动物对脂肪酸的需求也不同,选择恰当的脂肪源不仅能促进水产动物的生长,还能降低饲料成本。对配合饲料中脂肪源的研究多集中于鱼类,如大西洋鲑Salmonsalar[1],斑点叉尾鮰Ictaluruspunctatus[2,3],吉富罗非鱼Oreochromisniloticus[4],异育银鲫Carassiusauratusgibelio[5,6]等,甲壳类,如中国对虾Penaeuschinensis[7],斑节对虾Penaeusmonodon[8],凡纳滨对虾Litopenaeusvannamei[9],罗氏沼虾Macrobrachiumrosenbergii[10]等,对软体动物的研究还未见报道。
管角螺(HemifusustubaGmelin)隶属于软体动物门(Mollusca),腹足纲(Gastropoda)、新腹足目(Neogastropoda)、盔螺科(Galeodidae),角螺属(Hemifusus),为浅海经济型腹足类,主要分布在中国浙江、福建、广西、广东和海南各省的沿海,其个体大、味美、营养丰富,属名贵海鲜[11]。近年来,中国沿海的管角螺资源量日益减少,供不应求,市场价格昂贵,具有较大的养殖开发前景[12,13]。管角螺为肉食性动物,在人工养殖条件下,常以菲律宾蛤(Ruditapesphilippinarum)、缢蛏(Sinonovaculaconstrzcta)等鲜活饵料为主,饲养成本较高,而且容易引发疾病,以人工配合饲料替代天然饵料精养管角螺已成为必然趋势。关于管角螺配合饲料的研究仅见姜小敏[14],迄今为止,未见关于其配合饲料中脂肪源的研究报道。本研究探讨了不同脂肪源对管角螺生长和体成分的影响,以评价不同脂肪源的利用效果和差异,筛选出合适的脂肪源,为管角螺配合饲料生产提供理论依据。
1 材料和方法
1.1 试验管角螺
2012年6月于宁波市象山县石浦渔港购得成体管角螺,经培育、产卵和孵化得到幼螺,选择壳高(3.05±0.2) cm,壳宽(2.25±0.2) cm,螺重(2.23±0.05) g的健康管角螺共500只,暂养于水泥池(4 m×3 m×1.2 m)中备用。
1.2 试验饲料
饲料配方见表1,以白鱼粉、红鱼粉、豆粕、花生粕为蛋白源,分别以优质鱼油(FO)、猪油(LO)、豆油(SO)、花生油(PO)、混合油Ⅰ(MOⅠ) (鱼油∶豆油=1∶ 1)和混合油Ⅱ(MOⅡ) (鱼油∶猪油∶豆油∶花生油=1∶1∶1∶1)为脂肪源。饲料原料经粉碎过60目筛,充分混匀后,用手动小型绞肉机制成直径2 mm,长10 mm的圆柱形饲料,60℃烘干,保存于-20℃冰箱中备用。各组饲料的脂肪酸组成见表2。
1.3 试验设计和饲养管理
实验在泡沫箱 (60 cm×45 cm×30 cm) 内进行,每箱放20只,每组设3个平行,共进行60 d。投饵2次/d (7:00、16:00),日投喂量为总重的6%,每15 d称重1次,调整投喂量,每次投饵前换水,并收集残饵,烘干称重。实验条件:水温22.5~26.5℃,盐度25~28,pH值6.8~8.0,溶解氧>5 mg/L。
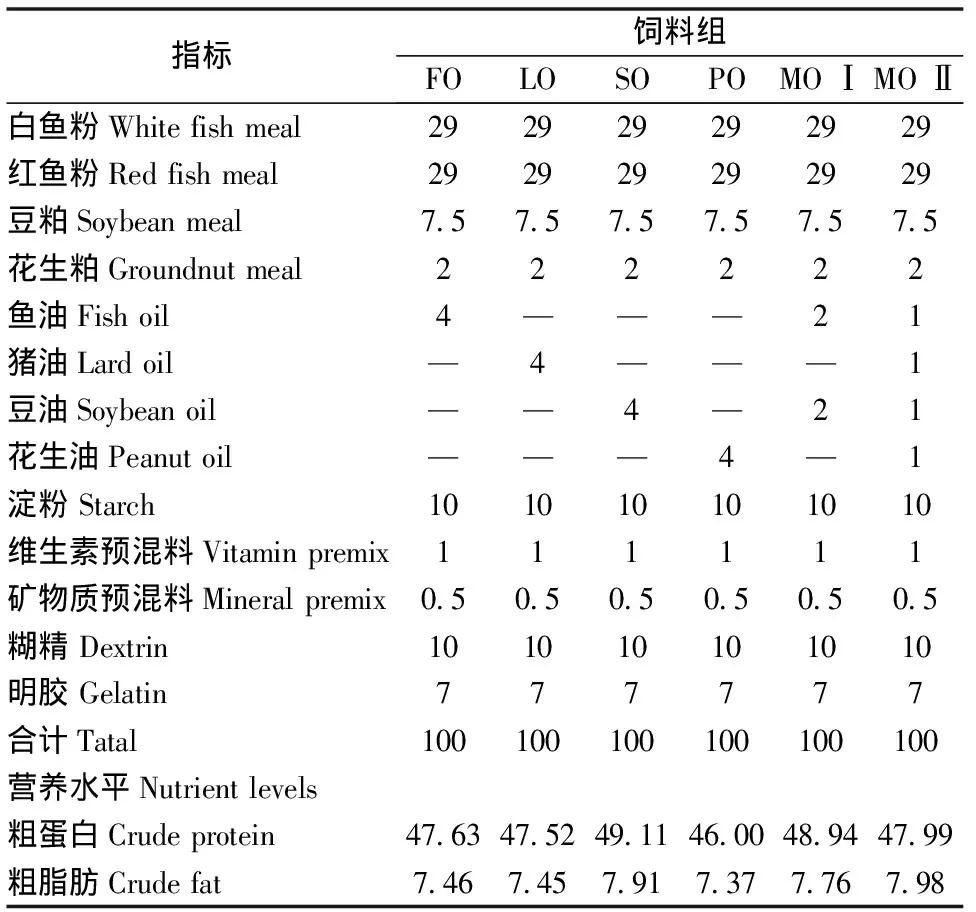
表1 试验饲料配方及营养水平 (%, 干重)
白鱼粉为进口鱼粉,红鱼粉为国产鱼粉均购于宁波天邦股份有限公司;矿物质预混料主要成分含量(每千克含量)∶铁≥2.00g;铜≥0.25g;锰≥1.60g;锌≥3.00g;维生素预混料主要成分含量(每千克含量)∶A(万IU)≥250;D3(万IU)≥50;E(万IU)≥2.5;K3(g)≥5;B1(g)≥10;B2(g)≥9;B6(g)≥8;烟酸(g)≥37;D-泛酸(g)≥20;叶酸(g)≥2;B12(mg)≥20;“—”表示未添加。

表 2 试验饲料脂肪酸组成 (% 总脂肪酸)
续表2 table 2(continued)

FOLOSOPOMOⅠMO Ⅱ2-He-CPA2.510.080.14trtrtr∑SFA33.6422.5426.1133.7121.8728.177-Me,C16:n-60.30.110.21trtrtrC16:n-76.763.995.274.583.844.62C18:n-914.2419.8315.7321.0518.2919.68C20:n-93.534.195.234.564.214.53C22:n-90.113.184.233.21tr3.22C24:n-90.520.270.020.380.270.32∑MUFA25.4631.5730.6933.7726.6132.37C18:2n-7trtrtr0.220.13trC16:3n-30.640.390.510.400.360.36C18:3n-32.423.573.422.654.032.87C20:4n-30.21trtrtr0.31trC20:5n-3(EPA)18.459.468.929.6911.236.08C22:6n-3(DHA)5.21tr5.83tr4.134.55C18:2n-64.9820.3817.3413.8719.6120.16C18:3n-62.42trtrtr3.81trC20:2n-60.15tr0.170.360.310.81C20:4n-60.790.320.750.550.75tr∑PUFA35.2734.1236.9227.7438.6634.83∑n-326.9313.4218.6612.7414.0613.86∑n-68.3426.718.2614.7834.4720.97n-3/n-63.23 0.50 1.02 0.86 0.41 0.66 EPA+DHA23.669.4614.759.699.3610.63
2-He-CPA为2-己基-环丙烷辛酸;7-Me,C16: n-6为7-甲基-十六烷-9-烯酸;tr表示微量<0.05;SFA,饱和脂肪酸;MUFA,单不饱和脂肪酸;PUFA,多不饱和脂肪酸;表5,表6同。
1.4 样品采集和分析
试验结束时停止投喂24 h,称重后,进行解剖取肌肉和肝脏,于-20℃冰箱保存备用。水分采用GB/T 5009.3-2003干燥法测定;粗蛋白采用GB/T 5009.5-2003凯氏定氮法测定,粗脂肪采用GB/T 5009.6-2003索氏抽提法测定;灰分采用GB/T 5009.4-2003高温灼烧法测定;脂肪酸组成根据NBFMS/XZ043-2005甲酯化法采用岛津气象色谱-质谱联用仪(GCMS-QP2010)测定。
1.5 数据处理和分析
Excel 2003对数据进行初步整理,SPSS 17.0进行单因素方差分析(One-way ANOVA ),用Duncan氏多重比较分析组间差异显著性程度。参照以下公式计算增重率(WGR)、特定生长率(SGR)、摄食率(FR)、饲料转化率(FCR)、存活率(SR)和肝体比(HSI):
WGR(%)= (Wt-W0)/W0×100
SGR(%/d)= (LnWt-LnW0)/t×100
FR(g·d-1·ind-1) = ∑(Mfd/N) /t
FCR(%) = (Wt-W0) /Mf×100
SR(%) =Ht/H0×100
其中,Wt—终末平均体重(g),W0—初始平均体重(g),Mf—总饵料摄入量(g),Mfd—每个泡沫箱每天饵料摄入量(g),N—每个泡沫箱管角螺数量(ind),t—实验天数(d),H0—初始数量(ind),Ht—终末数量(ind)。
2 结果与分析
2.1 对生长和饲料利用的影响
由表3可知,鱼油组管角螺的摄食率、增重率和特定生长率均最高,其次为混合油Ⅰ组,二者没有显著差异(P>0.05),但均显著高于其他各组(P<0.05),最低的为猪油组;各组中肝体比没有显著的差异(P>0.05),最高的为猪油组,其次为鱼油组,最低的为混合油Ⅰ组;不同脂肪源对管角螺成活率和饲料转化率没有显著影响(P>0.05)。可认为鱼油组管角螺的增重效果最好,其次为混合油Ⅰ组。

表3 不同脂肪源对管角螺生长和饲料利用的影响
同行上标不同小写字母表示差异显著(P<0.05)。
2.2 对肌肉和肝脏营养成分的影响
管角螺肌肉和肝脏营养组成见表4。与初样相比,试验后管角螺肌肉和肝脏的粗蛋白、粗脂肪含量均有增加,水分和粗灰分含量均减少。不同脂肪源对管角螺肌肉和肝脏的水分和灰分含量没有显著影响(P>0.05)。肌肉和肝脏的粗蛋白含量均以鱼油组最高,混合油Ⅰ组次之,二者没有显著差异(P>0.05),但均显著高于其他各组(P<0.05)。肌肉中粗脂肪含量没有显著差异(P>0.05),肝脏中粗脂肪含量以猪油组最高,与鱼油组差异不显著(P>0.05),但显著高于其他各组(P<0.05)。鱼油组和混合油Ⅰ组均对管角螺营养水平有较好的提升效果。

表4 不同脂肪源对管角螺肌肉和肝脏成分的影响(%,湿重)
同行上标不同小写字母表示差异显著(P<0.05)。

表 5 摄食不同脂肪源配合饲料的管角螺肌肉脂肪酸组成(% 总脂肪酸)
2.3 对肌肉脂肪酸的影响
从表5中可以看出,与初样相比,试验组肌肉中SFA和MUFA均有下降,而PUFA有所上升。C18:0含量与初样相比都有不同程度的降低,鱼油组和猪油组的C18:0含量与其他组差异显著(P<0.05);油酸(C18:n-9)含量也有不同程度的下降,鱼油组的油酸含量与其他组差异显著(P<0.05);亚油酸(C20:2n-6)含量除了猪油组含量有所下降其他组含量都不同程度的增加,但是各组之间的亚油酸含量没有显著差异(P>0.05);花生四烯酸(C20:4n-6)含量与初样相比都有所增加,鱼油组花生四烯酸含量最高,但各组之间没有显著差异(P>0.05);鱼油组n-3/n-6最高(1.57)并显著高于其他组(P<0.05);鱼油组EPA+DHA含量(8.97%)最高,与混合油Ⅰ组没有显著差异(P>0.05),并显著高于其他各组(P<0.05)。
2.4对肝脏脂肪酸的影响
从表6中可知,与初样相比,各组管角螺肝脏中SFA、PUFA含量均有下降,但MUFA含量有所增加。花生油组和混合油Ⅱ组的C18:0含量高于初样,其他几组都低于初样;猪油组和花生油组的油酸(C18:n-9)含量高于初样,其他几组都有不同程度的下降,鱼油组含量最低并与其他组有显著差异(P<0.05);猪油组和混合油Ⅱ组的亚油酸(C18:2n-6)含量显著高于其他组(P<0.05);混合油Ⅰ组的花生四烯酸(C20:4n-6)含量最高,并与其他组有显著差异(P<0.05)。

表6 摄食不同脂肪源配合饲料的管角螺肝脏脂肪酸组成(% 总脂肪酸)
3 讨论
从管角螺体内组成来看,不同脂肪源对管角螺的粗蛋白含量有显著的影响(P<0.05),鱼油组对管角螺肌肉粗蛋白(18.35%)水平的提升效果最佳,其次为混合油Ⅰ组,二者没有显著差异(P>0.05)。王煜恒等[5]、王道尊等[15]研究也发现鱼油组对鱼体粗蛋白水平提升效果最好,可见鱼油的摄入有利于水产动物体内蛋白质的合成和积累。各组管角螺肌肉中粗脂肪含量没有显著差异(P>0.05),而猪油组和鱼油组肝脏表现出了较高的粗脂肪含量和肝体比,说明猪油和鱼油对于肝脏脂肪沉积的能力较高,增加了患脂肪肝的风险,而混合油Ⅰ组肝脏的粗脂肪含量和肝体比均最低,说明单一的鱼油对肝脏有损害,而鱼油和豆油混合后对肝脏有保护作用,这与王煜恒等[5]认为鱼油对肝脏有保护作用的观点不一致。
配合饲料中脂肪酸的组成影响水产动物体内脂肪酸的组成。本试验中,各组饲料中均含有大量的C16:0和C18: n-9,在各试验组肌肉和肝脏中含量也较高,鱼油组和混合油Ⅰ组饲料中EPA含量较高,这两组的肌肉和肝脏EPA含量也显著高于其他各组(P<0.05),在一定程度上,管角螺体内脂肪酸组成反映了饲料的脂肪酸组成,这与Nematipour等[16]认为鱼类肌肉脂肪酸组成受饲料脂肪酸组成的直接影响的结论相似。
Sargent等[18]发现淡水鱼类可将C18: 2n-6转化成DHA,但这个过程在海水鱼类中很难发生,所以在海水鱼类配合饲料中添加一定量的DHA是必要的。鱼油富含PUFA,特别是EPA和DHA,这在植物油中含量较少,Sargent等[17]认为只有摄入足够的鱼油才能满足水产动物对EPA和DHA的需求,而Hardy等[18]、Bell等19]、Turchini等[20]认为只要配合饲料中n-3系列不饱和脂肪酸能够满足水产动物的需求,植物油和陆生动物脂肪在一定程度上是可以取代鱼油的。本试验中,鱼油组和混合油Ⅰ组均有较高的EPA和DHA含量,猪油组表现出了较高的C18: 2n-6含量,但其EPA和DHA含量显著低于鱼油组和混合油Ⅰ组,可见管角螺将C18: 2n-6转化成DHA的能力较差。除鱼油组和混合油Ⅰ组外,其他各组也检测到EPA和DHA的存在,这可能与基础饲料中鱼粉含量高达58%有关,这与王煜恒等[6]对异育银鲫的研究结果类似。
从试验结果可以得出,鱼油作为管角螺脂肪源可以得到较好的增重和营养提升效果,但增加了消费者患脂肪肝的风险,而且鱼油价格昂贵,难以获得,从人体健康和饲料成本的角度来考虑,以部分豆油代替鱼油,添加混合油作为管角螺的脂肪源是更好的选择。
参考文献:
[1]Thomassen M S, Rosjo C. Different fats in feed for salmon: influence on sensory parameters, growth rate and fatty acids in muscle and heart [J]. Aquaculture, 1989, 79(1-4): 129-135.
[2]Stickney R R, Andrews J W. Effects of dietary lipids on growth, food conversion, lipid and fatty acid composition of channel catfish [J]. Journal of Nutrition, 1972, 102(2): 249-257.
[3]Yingst W L, Stickney R R. Effects of dietary lipids on fatty acid composition of channel catfish fry [J]. Transactions of the American Fisheries Society, 1979, 108(6): 620-625.
[4]王爱民, 韩光明, 封功能, 等. 饲料脂肪水平对吉富罗非鱼生产性能、营养物质消化及血液生化指标的影响[J]. 水生生物学报, 2011, 35(1): 80-88.
[5]陈家林, 韩 冬, 朱晓明, 等. 不同脂肪源对异育银鲫的生长、体组成和肌肉脂肪酸的影响[J]. 水生生物学报, 2011, 35(6): 988-997.
[6]张媛媛, 刘 波, 戈贤平, 等. 不同脂肪源对异育银鲫生长性能、机体成分、血清生化指标、体组织脂肪酸组成及脂质代谢的影响[J]. 水产学报, 2012, 36(7): 1111-1118.
[7]Xu X, Ji W, Castell J D, et al. The nutritional value of dietary n-3 and n-6 fatty acids for the Chinese prawn (Penaeuschinensis)[J]. Aquaculture, 1993, 118(3-4): 277-285.
[8]Deering M J, Fielder D R, Hewitt D R. Growth and fatty acid composition of juvenile leader,Penaeusmonodon, fed different lipids [J]. Aquaculture, 1997, 151(1-4): 131-141.
[9]Lim C, Ako H, Brown C L, et al. Growth response and fatty acid composition of juvenilePenaeusvannameifed different sources of dietary lipid [J]. Aquaculture, 1997, 151(1-4): 143-153.
[10]王 恒, 曹维维, 孙龙生, 等. 不同脂肪源对罗氏沼虾生长及体组织常见组分的影响[J]. 淡水渔业, 2009, 39 (2): 37-41.
[11]潘 英, 庞有萍, 罗福广, 等. 管角螺的繁殖生物学[J]. 水产学报, 2008, 32(2): 217-222.
[12]潘 英, 王强哲, 庞有萍, 等. 管角螺全人工育苗试验[J]. 水产科技情报, 2007, 34(2): 84-85.
[13]林志华, 王铁杆, 夏彩国. 管角螺生态及繁殖习性观察[J]. 海洋科学, 1998(5): 11-12.
[14]姜小敏. 管角螺的营养需求及配合饲料的研究[D]. 宁波:宁波大学, 2012.
[15]王道尊, 潘兆龙, 梅志平. 不同脂肪源饲料对青鱼生长的影响[J].水产学报, 1989, 13 (4): 370-374.
[16]Nematipour G R, Gatlin D M. Effects of different kinds of dietary lipid on growth and fatty acid composition of juvenile sunshine bass,Moronechrysops♀×M.saxatilis♂[J]. Aquaculture, 1993, 141(1-2): 141-154.
[17]Sargent J R, Tocher D R, Bell J G. The lipids [A]. In: Halver J E, Hardy R W (Eds.), Fish Nutrition. 3rdedn. [C]. San Diego: Academic Press, 2002, 181-257.
[18]Hardy R W, Scott T M, Harrell L W. Replacement of herring oil with menhaden oil, soybean oil, or tallow in the diets of Atlantic salmon raised in marine net-pens [J]. Aquaculture, 1987, 65(3-4): 267-277.
[19]Bell J G, McEvoy J, Tocher D R, et al. Replacement of fish oil with rapeseed oil in diets of Atlantic salmon (Salmosalar) affects tissue lipid compositions and hepatocyte fatty acid metabolism[J]. Journal of Nutrition, 2001, 131(5): 1535-1543.
[20]Takeuchi T, Toyato M, Satoh S. Requirement of juvenile red sea bream Pagurs major for eicosapent aenoic and docosahexaenoic acids [J]. Nippon Suisan Gakkaishi, 1990, 56(8): 1263-1269.

