β⁃榄香烯对肿瘤细胞上清液诱导的大鼠骨髓来源内皮祖细胞VEGF及VEGFR⁃2表达的影响
宋颖,孟晓,刘云鹏,杨向红
(1.中国医科大学附属盛京医院病理科,沈阳110004;2.新乡医学院病理学教研室,河南新乡453000;3.中国医科大学附属一院肿瘤内科,沈阳110004)
β⁃榄香烯对肿瘤细胞上清液诱导的大鼠骨髓来源内皮祖细胞VEGF及VEGFR⁃2表达的影响
宋颖1,2,孟晓1,刘云鹏3,杨向红1
(1.中国医科大学附属盛京医院病理科,沈阳110004;2.新乡医学院病理学教研室,河南新乡453000;3.中国医科大学附属一院肿瘤内科,沈阳110004)
目的观察β-榄香烯对肿瘤细胞上清液诱导的大鼠骨髓来源内皮祖细胞(EPCs)血管内皮生长因子(VEGF)及其受体mRNA表达的影响,进一步探讨β-榄香烯在抑制肿瘤血管形成过程中的作用。方法原代培养大鼠EPCs。胃腺癌细胞株SGC-7901培养上清液诱导EPCs 12 h后,分别用0、5、10、20 μg/mL β-榄香烯干预48 h,用20 μg/mL β-榄香烯干预0、12、24、48 h。采用RT-PCR法检测各组EPCsVEGF和VEGFR-2的mRNA表达水平。结果随着β-榄香烯浓度及作用时间的增加,EPCsVEGFR-2的表达明显下降;当β-榄香烯浓度增加至10 μg/mL及作用时间延长至24 h,EPCsVEGF的表达水平较对照组明显降低(P<0.05)。结论β-榄香烯可降低EPCsVEGF及VEGFR-2mRNA的表达水平,从而减少EPCs的动员,进一步抑制EPCs参与肿瘤血管的形成。
内皮祖细胞;肿瘤细胞上清液;β-榄香烯;血管内皮生长因子;血管内皮生长因子受体2
榄香烯是从中药温郁金挥发油中提取的倍半萜类化合物,含β、γ、δ 3种成分,其中β-榄香烯是最主要的抗癌活性成分[1]。研究显示,β-榄香烯对胃癌、肺癌、卵巢癌及肾癌等肿瘤具有很好的抗肿瘤性及放疗增敏性[2~4]。
肿瘤细胞可分泌多种细胞因子动员内皮祖细胞(endothelial progenitor cells,EPCs)从骨髓进入外周血,并增殖形成血管网,对肿瘤细胞的生长及转移起关键作用。而血管内皮生长因子(vascular endothelial growth factor,VEGF)及其受体参与EPCs的动员。
本研究拟探讨β-榄香烯对EPCs VEGF及血管内皮生长因子受体2(vascular endothelial growth factor receptor-2,VEGFR-2)表达的影响,研究其能否部分抑制EPCs参与的肿瘤血管的形成。
1 材料与方法
1.1 EPCs的提取及鉴定
取4周龄Wistar大鼠(中国医科大学动物部提供,雌雄不限),无菌条件下抽取PBS液冲洗骨髓腔,收集细胞悬液,将细胞悬液缓慢加至5 mL大鼠淋巴细胞分离液,保持两者界面清晰,差速离心(2 000 r/min,25 min)后,吸取交界处云雾状灰白色单核细胞层;用含20%胎牛血清DMEM培养液制成细胞悬液,接种于25 mL培养瓶中,37℃、5%CO2孵育箱内培养。24 h后观察细胞贴壁状态,弃贴壁细胞,将剩余细胞换新培养瓶继续培养。24 h后,将EPCs接种于铺有0.2%明胶的玻片上,加入含胎牛血清的培养液培养3 d后,4%多聚甲醛固定30 min;滴加0.2% Triton,置室温20 min;滴加一抗AC133和vWF,4℃过夜;PBS冲洗3遍,分别加入FITC和罗丹明,避光37℃孵育1 h;PBS冲洗后封片,检测。
1.2 肿瘤细胞上清液的收集
用含5%FBS培养液培养胃腺癌细胞株SGC-7901,当细胞融合达80%时,更换为无血清DMEM培养液,24 h后收集上清液,0.22 μ m滤膜过滤,-70℃保存备用。
1.3 实验分组
EPCs培养3 d后,加入40%体积分数肿瘤细胞上清液诱导12 h,将细胞随机分为:(1)浓度效应组:不同浓度的β-榄香烯(0、5、10、20 μg/mL)作用48 h;(2)时间效应组:20 μg/mL β-榄香烯作用不同时间(0、12、24、48 h)。
1.4 RT-PCR法检测EPCsVEGF及VEGFR-2mRNA的表达
用TaKaRa公司Trizol试剂盒提取细胞总RNA,反转录合成cDNA,设计引物(表1),行RT-PCR:95℃5 min;95℃30 s,54℃30 s,72℃30 s,共35个循环;最后72℃5 min。反应结束后取5 μL PCR产物进行琼脂糖凝胶电泳。采用凝胶成像分析系统进行半定量分析。

表1 引物序列Tab.1 Primer sequences
1.5 统计学分析
2 结果
2.1 EPCs的培养和鉴定
EPCs贴壁后3 d,细胞呈梭形,7 d形成细胞集落,14 d呈铺路石样形态。免疫荧光鉴定:AC133阳性细胞被标记上绿色荧光,vWF阳性细胞被标记上红色荧光,vWF和AC133双重标记染色阳性为黄色荧光,为正在分化的EPCs(图1)。
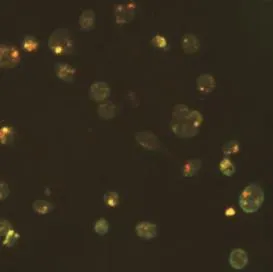
图1 AC133、vWF双重荧光染色阳性的正在分化的EPCs×400Fig.1 Double positive staining of AC133 and vWF in differentiating EPCs×400
2.2 β-榄香烯对肿瘤细胞上清液诱导的EPCsVEGFmRNA表达的影响
RT-PCR检测结果如图2所示:当5 μg/mL β-榄香烯作用48 h及20 μg/mL β-榄香烯作用12 h时,VEGF的表达水平与对照组相比,差异无统计学意义;当β-榄香烯浓度增加到10 μg/mL,作用时间延长至24 h时,VEGFmRNA表达明显下降,与对照组相比,差异有统计学意义(P<0.01)。
2.3 β-榄香烯对肿瘤细胞上清液诱导的EPCsVEGFR-2mRNA表达的影响
RT-PCR检测结果如图3所示:随着β-榄香烯浓度及作用时间的增加,EPCsVEGFR-2mRNA的表达明显下降,与对照组相比,差异有统计学意义(P<0.05)。

图2 β⁃榄香烯对肿瘤细胞上清液诱导的EPCs VEGF mRNA表达的影响Fig.2 The effect of β⁃elemene on the VEGF mRNA expression of EPCs induced by tumor cells supernatant

图3 β⁃榄香烯对肿瘤细胞上清液诱导的EPCs VEGFR⁃2mRNA表达的影响Fig.3 The effect of β⁃elemene on the VEGFR⁃2mRNA expression of EPCs induced by tumor cells supernatant
3 讨论
EPCs又称为内皮前体细胞,可分化成为血管内皮细胞,具有游走特性。目前认为表达CD34、VEGFR-2及AC133的细胞为EPCs。研究发现,在大鼠、家兔和人的骨髓、脐带血及外周血中均能提取到EPCs。生理情况下,EPCs可以参与胚胎血管形成。在机体缺血或血管损伤时,EPCs可从骨髓被动员至相应部位参与血管新生,研究发现新生血管中约25%的内皮细胞由EPCs分化而来[5]。随着对EPCs在缺血性疾病中作用研究的深入,越来越多的研究者发现EPCs除对动脉粥样硬化以及某些缺血性疾病具有良好的治疗作用外,还参与了肿瘤新生血管的形成[6~8]。
肿瘤在生长过程中,会以自分泌和旁分泌的方式分泌多种细胞因子如:血小板源性生长因子(platelet-derived growth factor,PDGF)、促血管生成素和VEGF等,这些细胞因子均可动员EPCs从骨髓迁至外周血并参与肿瘤血管的生成,为肿瘤细胞的生长提供营养。其中,VEGF对肿瘤血管的生成起重要的作用,通过与受体的结合可激活RAS/Raf/MAPK和PI3K/Akt等途径调控细胞的增殖及生长、凋亡和侵袭等生物学行为[9~11]。肿瘤组织中VEGF的表达水平与肿瘤微血管密度、恶性程度及转移情况呈正相关,与患者预后呈负相关,以VEGF和VEGFR为靶点治疗恶性肿瘤是现在研究的热点。EPCs与成熟的内皮细胞具有部分相同的表面标志,如VEGFR-2、CD34、钙黏素等,VEGF通过与EPCs表面的VEGFR-2结合可动员EPCs从骨髓进入外周血参与血管新生。本研究采用RT-PCR方法通过检测β-榄香烯作用下肿瘤上清液诱导的EPCsVEGF及VEGFR-2mRNA表达的变化情况,明确β-榄香烯对EPCs参与的肿瘤血管形成的影响的部分机制。结果显示,随着β-榄香烯浓度及作用时间的增加,EPCsVEGFR-2的表达明显下降;当β-榄香烯浓度增加至10 μg/mL及作用时间延长至24 h,EPCsVEGF的表达与对照组相比明显下降(P<0.05)。因此,可以推测β-榄香烯通过下调EPCsVEGF及VEGFR-2mRNA的表达减少EPCs的动员,从而抑制EPCs在肿瘤血管形成中的作用。
β-榄香烯是一种新型的抗肿瘤中药,具有广谱抗肿瘤作用,而且毒性反应轻微,对热化疗和放疗具有协同增敏作用,因其效果好、不良反应小,被作为恶性肿瘤治疗中的重要辅助手段应用于临床[12]。本研究为β-榄香烯的抗肿瘤机制又提供了一个有力的依据,但是与EPCs被动员的具体信号通路还有待进一步研究。
[1]Li Q,Wang G,Zhang M,et al.β-Elemene,a novel plant-derived antineoplastic agent,increases cisplatin chemosensitivity of lung tumor cells by triggering apoptosis[J].Oncol Rep,2009,22(1):161-170.
[2]Li X,Wang G,Zhao J,et al.Antiproliferative effect of beta-elemene in chemoresistant ovarian carcinoma cells is mediated through arrest of the cell cycle at the G2-M phase[J].Cell Mol Life Sci,2005,62(7-8):894-904.
[3]周昆,崔黎,闫焱,等.榄香烯对人肺腺癌SPC-A-1细胞VEGF-C及VEGFR-3表达的影响[J].中国老年学杂志,2008,28(6):551-553.
[4]程伟,李建平,王子明,等.β-榄香烯对肾癌放疗增敏相关基因表达谱的影响[J].中华泌尿外科杂志,2007,28(2):87-90.
[5]Peichev M,Naiyer AJ,Pereira D,et al.Expression of VEGFR-2 and AC133 by circulating human CD34+cells identifies a population of functional endothelial precursors[J].Blood,2000,95(3):952-958.
[6]Gao D,Nolan D,Mcdonnell K,et al.Bone marrow-derived endothelial progenitor cells contribute to the angiogenic switch in tumor growth and metastatic progression[J].Biochem Biophys Acta,2009,1796(1):33-40.
[7]Sun X,Yuan X,Zhu H,et al.Endothelial precursor cells promote angiogenesis in hepatocellular carcinoma[J].World J Gastroenterol,2012,21(35):4925-4933.
[8]Yu D,Sun X,Qiu Y,et al.Identification and clinical significance of mobilized endothelial progenitor cells in tumor vasculogenesis of hepatocellular carcinoma[J].Clin Cancer Res,2007,13(13):3814-3824.
[9]Lu K,Chang J,Parachonlak C,et al.VEGF inhibits tumor cell invasion and mesenchymal transition through a MET/VEGFR2 complex[J].Cancer Cell,2012,10(1):21-35.
[10]Martelli AM,Tazzari PL,Evandelisti C,et al.Targeting the phosphatidylinositol 3-kinase/Akt/mammalian target of rapamycinmodule for acutemyelogenous leukemia therapy:from bench to bedside[J].Curr Med Chem,2007,14(19):2009-2023.
[11]Xu C,Wu X,Zhu J.VEGF promotes proliferation of human glioblastoma multiforme stem-like cells through VEGF receptor 2[J].Scientific World Journal,2013,2013:417413.
[12]周蕾,刘福全,张红梅,等.榄香烯联合化疗治疗中晚期非小细胞肺癌的临床疗效观察[J].中药药理与临床,2009,25(2):113-115.
(编辑 王又冬)
2008年8月8日不应表示为2008-8-8
GB/T 15835-2011《出版物上数字用法》5.1.4中,对示例2008年8月8日说:“‘年’‘月’可按GB/T 7408-2005的5.2.1.1中的扩展格式,用‘-’替代”,写成“2008-8-8”。虽然后文中说“月和日是一位数时,可在数字前补‘0’”,但这里用了助动词“可”,仍暗示不补“0”也正确。很遗憾,这种表示法和说法都是不正确的,完全不符合GB/T 7408-2005的5.2.1.1中的规定:日历日期表达式,“其完全表示法应该为8位数字组成的一个纯数字型数据元,其中[YYYY]表示一个日历年,[MM]表示日历年中日历月的顺序数,[DD]表示日月中日历日的顺序数”,“扩展格式:YYYY-MM-DD”,“举例1985-04-12”。敬请编辑同人注意:务必执行专项国家标准GB/T7408-2005的规定,不要将“2008年8月8日”写成“2008-8-8”。
(陈浩元)
Effectofβ-elemene on the Expression of VEGF and VEGFR-2 in Rat Bone Marrow Derived Endothelial Progenitor Cells Induced by SupernatantofTumor CellCultures
SONG Ying1,2,MENGXiao1,LIUYun-peng3,YANGXiang-hong1
(1.DepartmentofPathology,Shengjing Hospital,China MedicalUniversity,Shenyang 110004,China;2.DepartmentofPathology,Xinxiang MedicalUniversity,Xinxiang 453000,China;3.DepartmentofOncology,The FirstHospital,China MedicalUniversity,Shenyang 110004,China)
ObjectiveTo investigate the effectofβ-elemene on the mRNAexpression ofVEGFin endothelialprogenitorcells(EPCs)induced by tumor cells supernatant,and discuss the effects of β-elemene on EPCs mobilization participated in tumor angiogenesis.MethodsEPCs were primarily cultured.EPCs were pretreated with SGC-7901 tumor cell supernatant for 12 h and then administrated with different concentration of β-elemene(0 μg/mL,5 μg/mL,10 μg/mL,20 μg/mL)for 48 h,or treated with 20 μg/mL β-elemene for different time(0 h,12 h,24 h,48 h).TheVEGFandVEGFR-2mRNAexpression ofEPCs were determined by RT-PCR.ResultsWith the increasing ofthe dose and the extension oftime,the expression of EPCsVEGFR-2mRNA were decreased obviously;when the dose increased to 10 μg/mL or the time extended to 12 h,the expression ofEPCsVEGFmRNA were decreased(compare to the controlgroup,P<0.05).Conclusionβ-elemene can decrease the expression ofEPCsVEGFandVEGFR-2mRNA,and reduce the mobilization ofEPCs,and restrain participation ofEPCs in tumorangiogenesis.
endothelial progenitor cells;tumor cells supernatant;β-elemene;VEGF;VEGFR-2
R329.2
A
0258-4646(2014)10-0917-04
宋颖(1985-),女,助教,硕士.
杨向红,E-mail:xhyang4933@vip.sina.com
2013-04-19
网络出版时间:

