RO3306与AZD2281对BRCA1WT乳腺癌协同抑制作用的体外研究
夏青,史艳侠,姜文奇
(1.上海市第一人民医院,上海交通大学附属第一人民医院肿瘤科,上海200080;2.中山大学附属肿瘤医院肿瘤内科,广州510060)
RO3306与AZD2281对BRCA1WT乳腺癌协同抑制作用的体外研究
夏青1,史艳侠2,姜文奇2
(1.上海市第一人民医院,上海交通大学附属第一人民医院肿瘤科,上海200080;2.中山大学附属肿瘤医院肿瘤内科,广州510060)
目的研究CDK1抑制剂RO3306联合PARP1抑制剂AZD2281对BRCA野生型(BRCA1WT)乳腺癌是否具有协同抑制作用及其机理。方法选取乳腺癌细胞株MCF-7、SKBR3、MDA-MB-231和HCC-1937,应用MTT实验检测PARP1抑制剂AZD2281、CDK1抑制剂RO3306、联合应用AZD2281与RO3306对乳腺癌细胞的生长抑制作用。通过基因转染、流式细胞分析、免疫蛋白印迹等,进一步了解AZD2281、RO3306抗肿瘤作用机理。结果联合应用CDK1和PARP1抑制剂显著抑制了BRCA1野生型乳腺癌细胞MDA-MB-231细胞生长,导致细胞发生持续DNA损伤、细胞凋亡。结论RO3306与AZD2281联合对BRCA1野生型乳腺癌细胞有效。两药联合具有协同抑制作用。
CDK1;BRCA1;PARP1;乳腺癌
乳腺癌中三阴乳腺癌占15%[1],这类病人不能从靶向治疗获益。BRCA1是DNA修复的一个重要组成部分,DNA双链损伤修复(doublestrand breaks,DSB)包括同源重组修复(homologous recombination,HR)[2],核苷酸切除修复(nucleotide-excision repair,NER)[3]以及碱基切除修复(base-excision repair,BER)[4]。部分三阴乳腺癌存在HR,如BRCA1/ BRCA2基因突变等,肿瘤对PARP抑制剂敏感[5~8]。目前,以PARP1为分子靶点的药物已经进入Ⅲ期临床。由于BRCA突变率只占乳腺癌的2%~3%[9]和三阴乳腺癌的12.5%[1],这限制了PARP抑制剂的临床应用。细胞周期依赖性激酶1(cyclin-dependent kinase 1,CDK1)是哺乳动物细胞凋亡起始和转换途径一个非常重要的调节因子[10]。肿瘤的细胞周期阻滞与CDK1活性异常或丧失有关[11],抑制CDK1导致细胞凋亡[12,13]。此外,CDK1磷酸化BRCA1,影响BRCA1蛋白集聚,干扰BRCA1发挥作用[14]。我们猜想:抑制CDK1增敏PARP1抑制剂对BRCA野生型乳腺癌的抗肿瘤作用。选取BRCA1野生型三阴乳腺癌细胞株MDA-MB-231,我们通过体外实验证实AZD2281联合RO3306,与单用AZD2281相比,能显著抑制肿瘤细胞生长,诱导其DNA损伤,G2/M期阻滞及细胞凋亡。RO3306与AZD2281联合具有协同抗肿瘤作用。抑制CDK1是PARP1抑制剂应用于BRCA野生型乳腺癌的一个有效途径。
1 材料与方法
1.1 材料
细胞株和药物:乳腺癌细胞株HCC-1937,SKBR3,MCF-7及MDA-MB-231均购自中国科学院细胞库上海保藏中心。AZD2281购置于美国Selleck公司,RO3306购置于EMD公司。
1.2 方法
1.2.1BRCA1基因突变检测:对MDA-MB-231,HCC -1937进行了BRCA1全基因组测序。
1.2.2 细胞增殖检测:MTT法计算生长抑制率及协同指数。
1.2.3 细胞凋亡与周期检测:细胞接种于6孔板,贴壁后加入不同浓度的药物继续培养24 h或48 h。PBS洗涤,无EDTA的胰酶消化细胞。离心收集(1~5)×105细胞并悬浮细胞,加入5 μL的Annexin VFITC混匀后,加入5 μL的Propidium Iodide,混匀。进行流式细胞仪检测和分析。对于细胞周期检测,消化细胞后加入预冷的70%乙醇,4℃固定过夜。离心收集细胞,上机检测。
1.2.4 免疫蛋白印迹:提取细胞蛋白,配制不同浓度分离胶,灌胶后加样。转膜后用5%脱脂奶粉室温封闭1 h,后加一抗二抗。0.05%Tween/PBS洗膜3次。曝光洗片,分析实验结果。
1.2.5 RNA转染:通过BRCA1siRNA(5′-GCAGUG AAGAGAUAAAGAATT-3′Shanghai GenePharma Co.,Ltd,#1304)和CDK1siRNA(5′-GGGGUUCCU AGUACUGCAA dTdT-3′Ribo Bio Co.,Ltd,#2012)转染MDA-MB-231。
1.3 统计学方法
2 结果
2.1 乳腺癌细胞株分子亚型
免疫蛋白印迹(图1A)示:MCF-7为Luminal型,SKBR3为HER2阳性亚型,MDA-MB-231和HCC-1937为三阴型。4株细胞均表达CDK1。对三阴型细胞株进行BRCA1全基因组正反向测序结果如图1B:HCC-1937为BRCA1突变型:外显子73-74插入C突变,MDA-MB-231为BRCA1野生型。
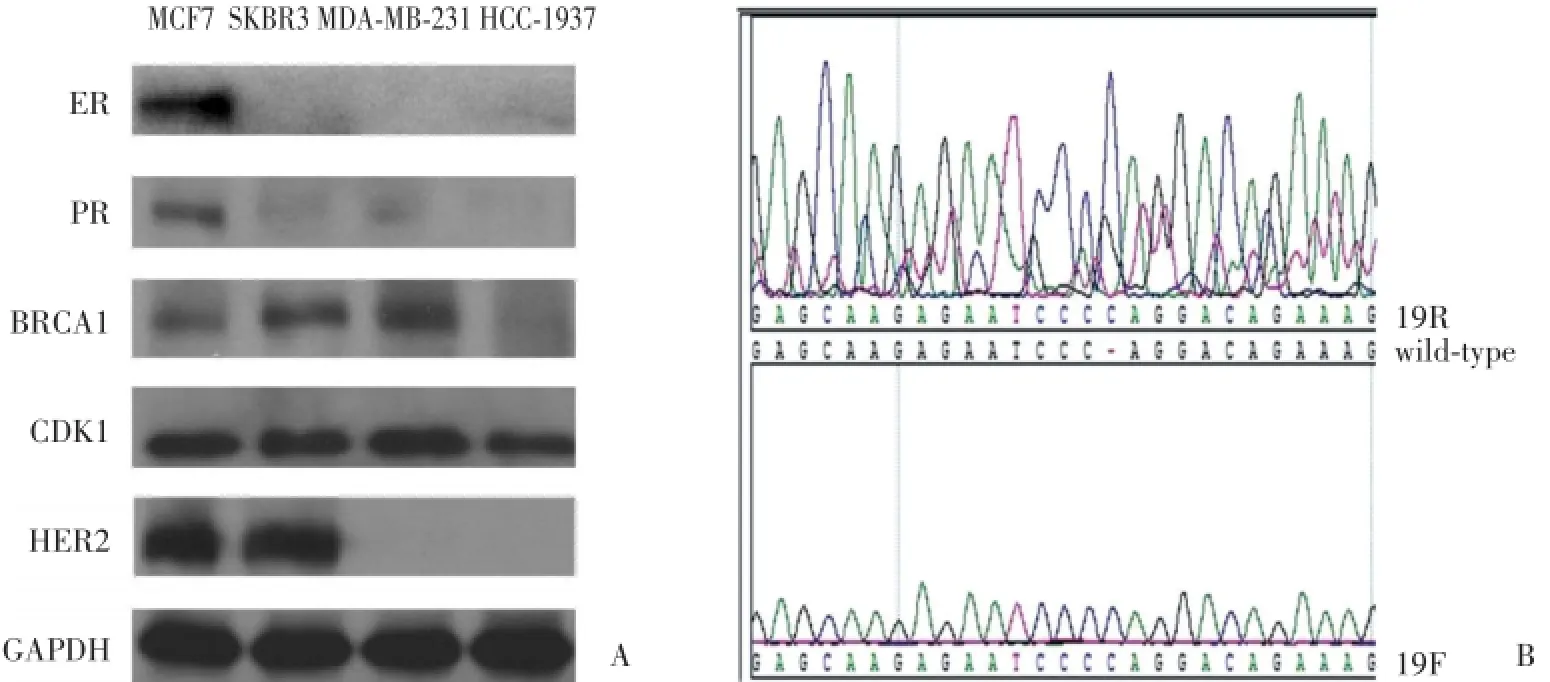
图1 乳腺癌细胞株分子亚型。Fig.1 Characteristics of breast cancer cell lines
2.2 细胞株对PARP1抑制剂的敏感性
如图2A所示:BRCA1突变细胞株HCC-1937对AZD2281最敏感,作用72 h的IC50为68.19 mol/L。通过对MDA-MB-231细胞进行BRCA1-siRNA转染,AZD2281的抗肿瘤效应明显增强(P=0.047)(图2B)。对于HCC-1937细胞,无论AZD2281单用还是联合RO3306,细胞生长抑制率差异无统计学意义(P=0.547)(图2C)。
2.3 细胞株对CDK1抑制剂的敏感性
我们检测了RO3306的IC50,在48 h,72 h分别为55.72 mol/L、7.11 mol/L(图3A)。图3B证实RO3306能显著降低BRCA1蛋白Ser1524磷酸化,该作用具有时间及剂量依赖效应。

图2 AZD2281对乳腺癌细胞的抑制作用Fig.2 Effects of AZD2281 on MDA⁃MB⁃231 cell viability

图3 RO3306对MDA⁃MB⁃231细胞的抑制作用Fig.3 Effects of RO3306 on MDA⁃MB⁃231 viability
2.4 抑制CDK1与PARP1抑制剂联合具有协同抗肿瘤作用
如图4A所示,首先,我们计算了AZD2281:RO3306在不同浓度配比下作用于MDA-MB-231的协同指数(combined index,CI)。结果显示:AZD2281∶RO3306为10∶1时协同抗肿瘤作用最强,CI为0.077。随后,选取两个RO3306的作用浓度(均≤IC50):2.5 mol/L和5 mol/L作为联合AZD2281时的浓度。结果提示:联合用药降低了AZD2281的IC50(图4B)。与单用AZD2281相比,干扰CDK1后AZD2281对MDA-MB-231细胞作用更明显(P= 0.046,图4C)。
2.5 抑制CDK1和PARP1诱导细胞凋亡和细胞周期阻滞
联合用药组较AZD2281,RO3306,均显著增加MDA-MB-231细胞G2/M期所占比例(P均<0.001)(图5A)。对照组的凋亡比例为(1.80±1.08)%,AZD2281、RO3306、RO3306序贯AZD2281组分别为(12.70±2.26)%、(20.40±1.71)%和(29.83±2.34)%(P<0.001)。亚组分析提示:与AZD2281,RO3306相比,联合用药组的细胞凋亡比例更高(P均<0.05)。

图4 药物对MDA⁃MB⁃231的抑制作用Fig.4 Effects of drugs on MDA⁃MB⁃231 viability
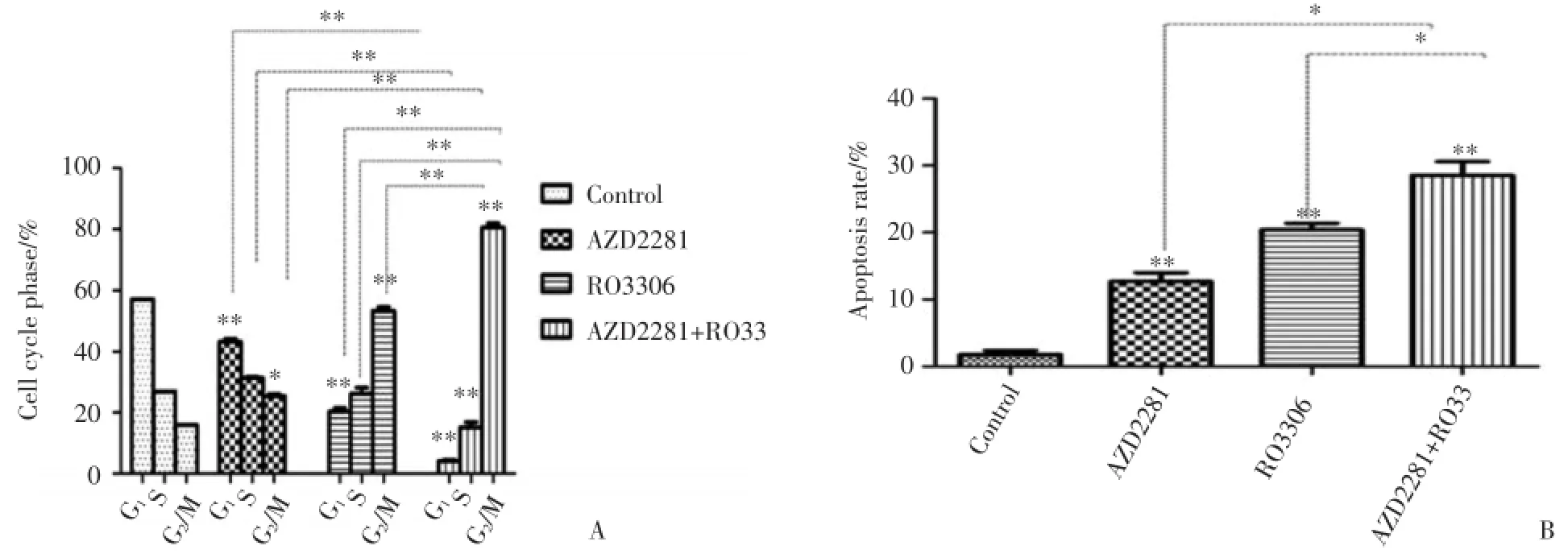
图5 药物引起MDA⁃MB⁃231细胞周期阻滞和细胞凋亡Fig.5 Drugs induced change of cell cycle distribution and apoptosis
3 讨论
BRCA1是一类乳腺癌抑癌基因,BRCA1蛋白具有非常多的功能,其中最特征的就是参与DNA损伤同源重组修复[15,16]。PARPs是一类多功能蛋白大家族,通过介导碱基切除修复,在DNA单链损伤修复中起了非常重要的作用[17]。CDK1是酵母同源重组修复过程一个非常重要的蛋白[18],CDK1还能和周期素形成复合物,是调控细胞周期一个非常核心的作用元件。CDK1基因敲除会导致细胞周期阻滞,阻碍胚胎发育[19]。
我们观察到,对于MDA-MB-231细胞,单用PARP1抑制剂AZD2281,其IC50>100 mol/L,这和Lehmann等[20]的研究类似。CDK1抑制剂RO3306作用4 h,序贯PARP1抑制剂AZD2281联合应用,能显著降低细胞的IC50,该联合作用具有协同性。
证实PARP1抑制剂AZD2281联合CDK1抑制剂RO3306能诱导凋亡,两药联合导致细胞周期阻滞在G2/M期。
应用CDK1抑制剂干扰BRCA1功能,影响DNA重组修复,选择性地提高PARP1抑制剂对BRCA1野生型细胞株MDA-MB-231的生长抑制作用。这种作用机制待体内实验进一步研究。
[1]Gucalp A,Traina TA.Triple-negative breast cancer:adjuvant therapeutic options[J].Chemother Res Pract,2011,2011(13):1-12.
[2]Zhang J,Powell SN.The role of the BRCA1 tumor suppressor in DNA double-strand break repair[J].Mol Cancer Res,2005,3(10):531-539.
[3]Hartman AR,Ford JM.BRCA1 induces DNA damage recognition factors and enhances nucleotide excision repair[J].Nat Genet,2002,32(1):180-184.
[4]Alli E,Sharma VB,Sunderesakumar P,et al.Defective repair of oxidative DNA damage in triple-negative breast cancer confers sensitivity to inhibition of poly(ADP-ribose)polymerase[J].Cancer Res,2009,69(8):3589-3596.
[5]McCabe N,Turner NC,Lord CJ,et al.Deficiency in the repair of DNA damage by homologous recombination and sensitivity to poly(ADP-ribose)polymerase inhibition[J].Cancer Res,2006,66(16):8109-8115.
[6]Ashworth A.A synthetic lethal therapeutic approach:poly(ADP)ribose polymerase inhibitors for the treatment of cancers deficient in DNA double-strand break repair[J].J Clin Oncol,2008,26(22):3785-3790.
[7]Tutt A,Robson M,Garber JE,et al.Oral poly(ADP-ribose)polymerase inhibitor olaparib in patients with BRCA1 or BRCA2 mutations and advanced breast cancer:a proof-of-concept trial[J].Lancet,2010,376(9737):235-244.
[8]Fong PC,Boss DS,Yap TA,et al.Inhibition of poly(ADP-ribose)polymerase in tumors from BRCA mutation carriers[J].N Engl J Med,2009,361(2):123-134.
[9]Wooster R,Weber BL.Breast and ovarian cancer[J].N Engl J Med,2003,348(23):2339-2347.
[10]Malumbres M,Barbacid M.Cell cycle,CDKs and cancer:a changing paradigm[J].Nat Rev Cancer,2009,9(3):153-166.
[11]Vassilev LT,Tovar C,Chen S,et al.Selective small-molecule inhibitor reveals critical mitotic functions of human CDK1[J].Proc Natl Acad Sci U S A,2006,103(28):10660-10665.
[12]Goga A,Yang D,Tward AD,et al.Inhibition of CDK1 as a potential therapy for tumors over-expressing MYC[J].Nat Med,2007,13(7):820-827.
[13]Kojima K,Shimanuki M,Shikami M,et al.Cyclin-dependent kinase 1 inhibitor RO-3306 enhances p53-mediated Bax activation and mitochondrial apoptosis in AML[J].Cancer Sci,2009,100(6):1128-1136.
[14]Johnson N,Cai D,Kennedy RD,et al.Cdk1 participates in BRCA1 -dependent S phase checkpoint control in response to DNA damage[J].Mol Cell,2009,35(3):327-339.
[15]Turner NC,Reis-Filho JS.Basal-like breast cancer and the BRCA1 phenotype[J].Oncogene,2006,25(43):5846-5853.
[16]Gudmundsdottir K,Ashworth A.The roles of BRCA1 and BRCA2 and associated proteins in the maintenance of genomic stability[J].Oncogene,2006,25(43):5864-5874.
[17]Amé JC,Spenlehauer C,de Murcia G.The PARP superfamily[J]. Bioessays,2004,26(8):882-893.
[18]Turner N,Tutt A,Ashworth A.Hallmarks of‘BRCAness′in sporadic cancers[J].Nat Rev Cancer,2004,4(10):814-819.
[19]Ira G,Pellicioli A,Balijja A,et al.DNA end resection,homologous recombination and DNA damage checkpoint activation require CDK1[J].Nature,2004,431(7011):1011-1017.
[20]Lehmann BD,Bauer JA,Chen X,et al.Identification of human triple-negative breastcancer subtypes and preclinical models for selection of targeted therapies[J].J Clin Invest,2011,121(7):2750-2767.
(编辑 裘孝琦)
The Cooperation Effectof RO3306 and AZD2281 in the TreatmentofBRCA1WTBreastCancer in vitro
XIAQing1,SHIYan-xia2,JIANGWen-qi2
(1.Department of Oncology,Shanghai First People′s Hospital,Shanghai Jiao Tong University School of Medicine,Shanghai 200080,China;2.Department of Oncology,Sun Yat-sen University CancerCenter,Guangzhou 510060,China)
ObjectiveTo investigate whether reduced CDK1 activity can sensitize BRCA1-proficient(BRCA1WT)tumor cells to PARP1 inhibition,and explore the related mechanism.MethodsMDA-MB-231,HCC-1937,SKBR3,and MCF-7 human breast cancer cell lines were selected.MTT was used to examine the inhibitor effect of PARP1 inhibitor AZD2281,CDK1 inhibitor RO3306,AZD2281 combined with RO3306 in breast cancer cell lines.RNA interference,cell cycle and apoptosis analysis,western blot analysis were performed to illustrate the mechanism of AZD2281 and RO3306.ResultsThe combined inhibition of CDK1 and PARP1 in BRCA1-proficient MDA-MB-231 breast cancer cells resulted in dramatically reduced cell growth compared to PARP1 inhibition alone.Mechanistic investigations revealed that this sensitivity was mediated by sustained DNA damage and inefficient DNA repair,triggering apoptosis.ConclusionRO3306 improves the sensitivity of BRCA1-proficient breast cancercells MDA-MB-231 to AZD2281.
CDK1;BRCA1;PARP1;breast cancer
R730.5
A
0258-4646(2014)11-0973-05
国家十一五计划重大科技专项基金(2008ZX09312-002)
夏青(1985-)女,医师,博士.
姜文奇,E-mail:jiangwenqi2009@126.com
2014-06-24
网络出版时间:

