TUNEL法和SCGE法评价奶牛性控冻精DNA损伤
郑 飞 骆新荣 贾发青 高庆华, 韩春梅,*
(1 塔里木大学动物科学学院, 新疆 阿拉尔 843300)(2 新疆生产建设兵团塔里木畜牧科技重点实验室, 新疆 阿拉尔 843300)
前言
性控冻精的产业化应用对畜牧业发展,特别是奶牛业的发展产生了重大而深远的影响。随着性控冻精生产技术的日渐成熟,性控冻精也逐步向茸鹿、奶山羊等限性性状家畜广泛推广。在未来的现代化畜牧业,性控冻精将有可能替代常规冻精,使家畜品种改良,品系化杂交繁育进入一个全新的时代。
在性控冻精在制作过程中,精液的处理会对精子产生各种影响,从而造成精子DNA的较大程度损伤[1,2],由于受精时不完全依赖于精子DNA完整性,即便是DNA受损的精子仍可保持受精潜能,产生表型健康的性控后代,但性控冻精DNA损伤会对后代的遗传稳定性的产生远期影响,即使受精后损伤的DNA有一定的自修复能力[1]。因此,性控冻精的生物安全性应被关注。
TUNEL法(terminal deoxynucleotidyl transferase (TdT)-mediated dUTP nick end labeling, 脱氧核糖核苷酸末端转移酶介导的缺口末端标记法)是检测细胞凋亡早期过程中细胞核DNA完整性的有效方法。单细胞凝胶电泳(single single-cell gel electropherosis,SCGE)又称彗星法,是一种比较灵敏简便的检测DNA损伤程度的方法。本实验通过TUNEL法和SCGE法分别对性控冻精DNA的完整性进行检测,对比两种方法检测结果对性控冻精DNA的损伤程度的评价。
1 材料与方法
1.1 实验材料
X/Y种畜(天津)有限公司生产规格为0.25 mL的性控奶牛细管冻精,种公牛号分别为12200145、12200171、12200176,精子数约230万,活率40~45%。三头公牛常规冻精每管精子数2 000万,活率35~40% 。
1.2 试剂
TUNEL试剂盒购自罗氏公司;低熔点琼脂糖,十二烷基肌氨酸钠,蛋白酶K,DAPI购自Promege公司,其它试剂购自南京化学试剂公司。DYY-6B型电泳仪为北京六一仪器厂,TS100-F型荧光显微镜产自日本。
1.3 方法
1.3.1 TUNEL法
严格按照试剂盒说明书进行检测,DAPI染色后在蓝色背景下观察。若为蓝色,则为阴性,DNA无损伤;若有绿色荧光,则为阳性,DNA受损。采用双盲法进行计数,随机观察100个细胞,每个样本重复5次,取平均值作为检测结果。
1.3.2 SCGE法
采用实验室已建立的SCGE法[3],将精子密度调至2×106个/ ml左右,与1%的低熔点琼脂糖混匀,铺于被常熔点琼脂糖包被的载玻片上,4 ℃裂解1.5 h,加入预冷的DTT 4 ℃作用1 h后,用含有蛋白酶K的细胞缓冲液消化过夜。4 ℃,15 V,150 mA电泳30 min,加入Tris-HCl,4 ℃中和2次,每次10 min。-20 ℃预冷的无水乙醇作用10 min后,吖啶橙染色,荧光显微镜下观察,观察到彗星形状为阳性,反之为阴性。采用双盲法进行计数,随机观察50个细胞,每个样本重复5次,取平均值作为检测。
1.4 统计学分析
所有数据均采用SPSS 13.0统计分析,以平均数±标准差表示。对性控冻精和常规冻精的DNA损伤率进行配对t检验,P<0.05为差异显著,P<0.01为差异极显著。
2 结果
由表1可知TUNEL法检测所得性控冻精DNA损伤阳性率高出常规冻精约32个百分点,差异极显著。SCGE法对性控冻精DNA损伤的检测结果相对于常规冻精比较高出约31个百分点,差异极显著。故性控冻精的DNA损伤程度极显著高于常规冻精。

表1 TUNEL法与SCGE法对性控冻精DNA损伤的检测
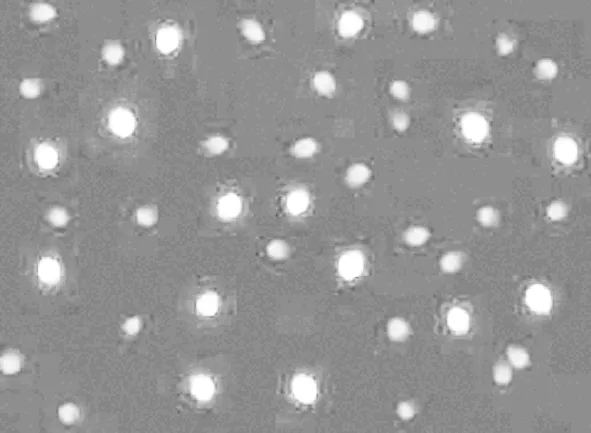
A常规冻精

B性控冻精

A常规冻精

B性控冻精
3 讨论
3.1 DNA损伤检测结果
本实验成功的用TUNEL法和SCGE法检测了性控冻精DNA的损伤程度,结果与常规冻精相比均出现了差异极显著的阳性率,说明精子核DNA受到损伤。结果与骆新荣等研究结果相符[3]。
相对于常规冻精,流式细胞仪分离得到的奶牛精子会受到更大程度的损伤,其功能和受精力也受到非常大的影响[4-5]。在使用流式细胞仪分选精子时,精子受到高度稀释、高压、电场等的影响[6-7],尤其是核染色后,被激光照射会对精子DNA产生很大的损伤[8]。分选后的单性精子会处于极活跃状态,其兴奋性、运动力极强,故导致其存活时间相对较短。同时,在制作冷冻精液的过程中,精液的稀释、离心、冷冻和保护剂的添加量等都能使精子DNA的完整性受到影响。赵宏远等研究发现冷冻后的山羊精子DNA损伤程度较新鲜精液的有明显升高,差异极显著[9]。刘奕等人研究发现染色对精子DNA的完整性有一定的影响,但与正常精子相比差异不显著[10]。闫永健等人发现UVB照射对斑马鱼的早期胚胎发育有明显影响,同时随着照射时间的增加,胚胎对UVB的耐受力也增强[11]。虽然染色,激光照射等单个因素对精子的作用可能不明显,但同时作用后精子的DNA损伤就会大幅提升。有研究表明细胞的自身修复能力很强[12-13],不严重影响受精率、出生重等指标,但我们实验室研究发现性控冻精的后代的初生重、受胎率等相对于常规冻精还是有所降低[14]。这可能与精子细胞受损伤的程度和自身修复能力有一定关系[1]。如果使用常规精液的冷冻程序(慢速降温、中性稀释液),相当数量的精子会在冷冻前死亡,故通过改变分选后精液的冷冻程序,有望提高冻后精子的活率,降低当前每管冻精的精子数量,达到降低成本的目的。
3.2 TUNEL法和SCGE法对性控冻精DNA的损伤程度的评价
在人类男性不孕症的研究中,很多运用TUNEL法和SCGE法对精子DNA的完整性进行检验。Sergerie, M等比较了TUNEL法、SCSA法(精子染色质结构分析 sperm chromatin structure assay)和SCGE法三种方法的检测结果,认为TUNEL法和SCGE法能更好的检测出精子DNA单链及双链的断裂情况,而SCSA能检测精子DNA在组装压缩过程发生的变化[4]。O'Flaherty C等分别用TUNEL法、SCSA法和SCGE法检测睾丸癌和霍奇金淋巴瘤病人精子DNA的损伤情况,发现三种方法中SCGE法优于前两种,是检测睾丸癌病人精子DNA组装过程染色质的变化情况最好一种方法[15]。
本实验用SCGE法检测性控冻精DNA的损伤情况,结果与TUNEL法相似,说明SCGE法和TUNEL检测均可作为评价精子质量的有效方法。
[1] Agarwal A, Said T M. Role of Sperm Chromatin Abnormalities and DNA Damage in Male Infertility[J]. Human Reproduction Update, 2003, 9(4): 331-345.
[2] Wang C, Li Z L. ATM/H2AX and Repair of Sperm-DNA Damage During Cryopreservation[J]. Zhonghua Nan Ke Xu, 2011, 17(7): 634-638.
[3] 骆新荣, 马瑛, 孟浩等.奶牛性控与常规冻精DNA损伤的彗星检测[J]. 中国奶牛, 2011,20:6-9.
[4] Vazquez J M, Parrilla I, Gil MA, et al. Improving the Efficiency of Insemination with Sex-sorted Spermatozoa[J]. Reprod Domest Anim, 2008,43(4):1-8.
[5] Cordelli E, Eleuteri P, Leter G, et a1.Flow cytometry Applications in the Evaluation of Sperm Quality: Semen Analysis, Sperm Function and DNA Integrity[J].Contraception, 2005,72(4):273-279.
[6] Schenk J L, Suh T K, Cran DG, Seidel GE. Cryopreservation of Flow-sorted Bovine Spermatozoa[J]. Theriogenology, 1999,52(8):75-91.
[7] Gravance C G., Vishwanath R, Pitl C. Effects of Cryopreservation on Bull Sperm Head Morphometry[J]. Journal of Andrology, 1998, 19(6):704-709.
[8] Proshin S N, Stepanov G V, Kravtsov V Y. Study of DNA Integrity in Somatic Cells and Spermatozoa by Single-Cell Gel Electrophoresis with Silver-Nitrate Staining[J]. Cell and Tissue Biology, 2008,2(1):87-92.
[9] 赵宏远, 李俊杰, 桑润滋.单细胞电泳技术检测不同处理山羊精子DNA损伤[C]. 中国畜牧兽医学会动物繁殖学分会第十五届学术研讨会论文集. 北京:中国畜牧兽医学会,2010.
[10] 刘奕, 纪锋, 谷伟, 等. 荧光染色法检测虹鳟精子质量[J]. 水产学杂志, 2010,23(1):32-34.
[11] 闫永健, 赵海滨, 郭炳冉, 等. UVB辐射导致斑马鱼早期胚胎发育异常和DNA损伤的初步研究[J]. 中国水产科学, 2010,17(1):69-77.
[12] Fatehi A N, Bevers M M, Schoevers E, et al. DNA Damage in Bovine Sperm does Notblock Fertilization and Early Embryonic Development but Induces Apoptosis after the first Cleavages[J]. JAndro, 2006,27(2): 176-188.
[13] 刘艳美, 肖婉芬. 精子DNA损伤与受精后依赖于卵母细胞修复的研究[J]. 医学综述,2010,16(8):143-146.
[14] 骆新荣,廉德平,张承选, 等. 荷斯坦奶牛性控冻精应用效果的研究[J].畜牧与兽医, 2013,45(2):37-39.
[15] O'Flaherty C, Vaisheva F, Hales B F, et al. Characterization of Sperm Chromatin Qquality in Testicular Cancer and Hodgkin's Lymphoma Patients prior to Chemotherapy[J]. Hum Reprod. 2008, 23(5):1044-1052.

