小鼠实验性小花棘豆中毒的病理学观察
王 帅 贾琦珍 胡建军 陈根元 张 玲
(塔里木大学动物科学学院/新疆生产建设兵团塔里木畜牧科技重点实验室,新疆 阿拉尔 843300)
小花棘豆(OxytropisglabraDC)为豆科棘豆属植物,有醉马草、马绊肠、绊肠草、苦马豆等多种俗称,广泛分布于新疆和田、阿克苏等地区,具有根系发达,繁殖系数高,耐旱,耐贫瘠,返青早,多种籽,生命力强等特性[1]。据统计,阿克苏地区271. 97万hm2天然草场中广泛丛生小花棘豆的面积超过40万hm2,每年采食小花棘豆中毒的家畜占放牧家畜总数的10%左右,超过50%的中毒家畜死亡,小花棘豆的危害已严重影响了畜牧业生产[2]。近年来国内学者对小花棘豆毒性方面的研究较多,高超等[3],宋丽等[4],米克热木等[5]分别研究了小鼠小花棘豆急性中毒、亚急性中毒和亚慢性中毒的病理学变化,发现小花棘豆中毒可导致动物肝、肾、脾、心、脑等器官细胞空泡变性,尤以小脑浦肯野细胞、神经元细胞、肾脏近曲小管上皮细胞、肾上腺髓质部上皮细胞和肝细胞变性最为明显,从而使动物表现出以神经机能障碍为特点的中毒症状。但小花棘豆化学成分组成复杂,不同地区小花棘豆化学成分间存在较大差异[6],本试验通过对新疆南疆地区小花棘豆攻毒小鼠病理组织学指标的分析,为小花棘豆毒理学研究提供基础。
1 材料和方法
1.1 试验材料、试剂与仪器
小花棘豆由塔里木大学动物科学学院草业科学学科组提供,采自阿拉尔市托喀依乡,样品为风干样。
苏木精,伊红,盐酸,乙醇,二甲苯,石蜡,阿拉伯树胶等均为国产分析纯。
转轮切片机(Leica公司RM2126),数码互动光学显微镜(Motic DMBA300-B),智能型生物组织包埋机(浙江金华市益迪医疗设备厂YD-6D) 。
1.2 试验小鼠及小鼠日粮
试验动物选用6~8周龄昆明种小鼠,共40只,体重为(20±2)g,雌雄各半,由塔里木大学动物科学学院实验站提供。将小花棘豆粉分别按1 g/kg、5 g/kg、10 g/kg的比例与饲料混合。小鼠饲料组成为:面粉350 g/kg,玉米粉240 g/kg,豆饼200 g/kg,麸皮100 g/kg,鱼粉50 g/kg,酵母粉10 g/kg,植物油10 g/kg,鱼肝油10 g/kg,食盐10 g/kg,骨粉10 g/kg,矿物质添加剂9 g/kg。维生素添加剂1 g/kg[7]。利用颗粒饲料机将其制成颗粒料。
1.3 小鼠小花棘豆中毒模型的建立
将小鼠随机分为对照组、试验Ⅰ组、试验Ⅱ组和试验Ⅲ组,每组10只小鼠,分笼饲养,自由采食和饮水。对照组仅饲喂饲料,试验组分别饲喂含有小花棘豆1 g/kg、5 g/kg、10 g/kg的混合饲料。试验持续63 d。每天观察并记录各试验组小鼠的饮食状况、精神状态、行为活动等情况的变化,至小花棘豆中毒典型症状出现模型复制结束。
1.4 临床症状及病理学观察
待试验小鼠出现小花棘豆中毒典型症状后,先称其体重,然后断颈处死,剖检取心脏、肝脏、肺脏、脾脏、肾脏和脑,称量各脏器重量并计算脏器系数,脏器系数计算公式为脏器系数=(内脏重/体重)×100%[3]。然后将脏器置于10%中性福尔马林溶液中固定,常规石蜡包埋,间隔连续切片,HE染色,用Motic DMBA300-B数码互动显微系统进行观察分析,并拍照记录。
1.5 数据分析
试验数据使用SPSS 16.0软件中One-Way ANOVA方法进行单因素方差分析。
2 结果与分析
2.1 小鼠临床症状变化
对照小鼠试验期内未见任何异常。攻毒后7 d试验组小鼠出现被毛蓬乱干燥,部分小鼠轻微跛行,精神沉郁;第21 d时部分试验小鼠采食量与饮水量开始下降,其中试验Ⅲ组最为明显;第63 d时试验小鼠普遍消瘦,其中试验Ⅲ组尤为明显,具体表现为中毒小鼠对外界反应迟钝,运动协调性下降,头部和四肢均出现神经性震颤,其临床症状与高超等[3]的报道一致。
2.2 剖检变化
对照组小鼠无明显眼观病变。试验组小鼠表现为尸体消瘦,多处皮下结缔组织呈胶样浸润,内脏器官颜色与正常对照有明显差异,其中肝脏、肾脏均出现肿大、淤血等情况,肺脏与胸膜发生粘连,并有点状出血,心脏出现炎性水肿,心包增厚,腹腔内有少量腹水。
2.3 小鼠各脏器系数的变化
由表1可见,试验Ⅰ组、试验Ⅱ组和试验Ⅲ组肝脏系数和肾脏系数均极显著高于对照(P <0. 01);试验Ⅲ组肺脏系数极显著高于对照(P <0. 01),试验Ⅰ组和试验Ⅱ组肺脏系数均显著高于对照(P <0. 05);试验Ⅰ组、试验Ⅱ组和试验Ⅲ组脾脏系数和脑系数均极显著低于对照(P <0. 01);试验Ⅲ组心脏系数显著低于对照(P <0. 05),试验Ⅰ组和试验Ⅱ组心脏系数值低于对照组小鼠,但组间差异不显著(P>0. 05)。表明中毒小鼠脏器系数的变化与小花棘豆采食量呈现出一定的时间-剂量效应关系。
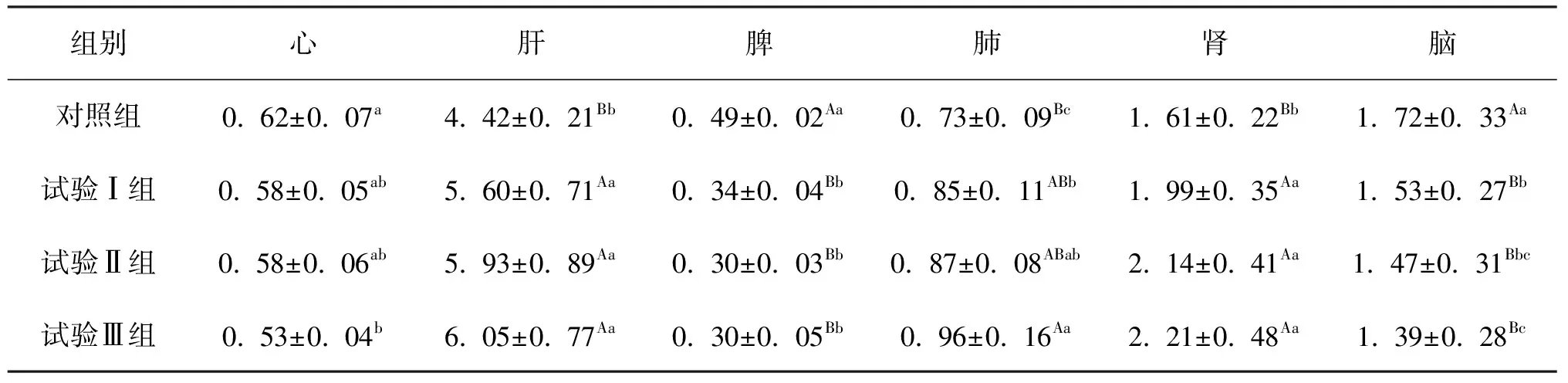
表1 小花棘豆对小鼠脏器系数的影响(X±S)
2.4 病理组织学变化
对照小鼠各脏器均未见明显的病理性变化。试验组小鼠肝脏有出血和炎性病灶,其中试验Ⅲ组小鼠肝细胞出现肿胀破裂和空泡变性,并且胞质染色变淡,部分细胞核有聚集现象。中毒小鼠肾小管和肾小球上皮细胞发生肿胀,并有不同程度坏死,细胞核脱落、溶解,胞质出现空泡化。试验组小鼠心外膜明显增厚,原有间质坏死崩解,出现炎症性变化,心肌纤维HE染不均匀,淡染部分纤维肌浆溶解,横纹消失,呈空泡化;肺泡壁和支气管黏膜上皮细胞空泡变性,胞核淡染,部分肺泡壁毛细血管充血,中毒严重小鼠出现肺泡壁断裂和肺泡增大。试验组小鼠脾窦中有色素沉积,脾小梁发生断裂、坏死,脾小结出现空泡化巨噬细胞。此外,试验组小鼠脑部病变极为明显,最显著的特征为小脑浦肯野细胞发生空泡变性,部分神经细胞出现典型大空泡,另有部分神经纤维消失,脑组织HE染色较正常组织变淡,还出现卫星现象和噬神经元现象,浦肯野细胞大小及染色不一,胞浆内出现细小颗粒,有典型空泡,海马区神经纤维变短。
3 讨论
将小花棘豆草粉分别按照1 g/kg、5 g/kg、10 g/kg的比例饲喂小鼠,攻毒小鼠陆续出现中毒症状,主要表现为精神沉郁,反应迟钝,步态不稳,后肢麻痹、抽搐等;剖检发现中毒小鼠脏器均发生不同程度的病变。试验表明,中毒小鼠的临床症状及剖检结果与高超等[3],宋丽等[4],米克热木等[5]和陈绍淑[7]等的研究一致,证明小花棘豆确有毒性能够引起小鼠中毒。
脏器系数可反映有毒物质对脏器组织的损害程度。从试验结果可知,小花棘豆中毒小鼠肝脏系数、肾脏系数和肺脏系数增大,脑系数、心脏系数和脾脏系数降低,与高超等[3],宋丽等[4]和米克热木等[5]的研究一致。其中肝脏系数增大可能是小花棘豆毒性成分诱导肝微粒体代谢酶所致;肾脏是机体极易受到损害的重要器官,其中肾脏肿大是中毒病的共同特征;中毒小鼠脾脏质量降低,说明小花棘豆中毒可导致小鼠脾脏萎缩,即中毒小鼠发生免疫力减退。通过对小鼠各脏器系数方差分析,表明小鼠脏器损伤程度与小花棘豆的采食量密切相关。但脏器系数的变化只能说明动物某个脏器受到损伤, 进一步的分析需要进行病理组织学方面的检查。

图1 小花棘豆致小鼠中毒的病理学变化
小花棘豆中毒的特征性病理变化为组织细胞的胞浆空泡变性[8]。试验结果表明,当小鼠发生小花棘豆中毒时,肝脏、肾脏、脾脏、神经系统等组织细胞均发生不同程度的空泡变性,其中脑组织最为严重,小脑中脑干网状结构和浦肯野细胞均发生明显的空泡变性[9,10]。Bryan等[11]认为脑干网状结构和浦肯野细胞与动物运动协调等功能有关,因而小花棘豆中毒导致的运动失调与脑组织受到伤害密切相关。王帅等[12,13]研究发现,小花棘豆中毒导致的细胞空泡变性与自由基引起的空泡变性相似,进一步研究证实小花棘豆中毒可显著降低小鼠机体抗氧化酶活性,导致机体自由基蓄积,致使中毒动物细胞出现线粒体肿胀、嵴断裂、溶解、严重时整个线粒体呈现大的空泡,与试验中小鼠小花棘豆中毒的病理学变化基本吻合;另外与肝脏、肾脏等器官相比,脑仅具有中等活性的抗氧化能力,极易受到自由基的影响,与试验中脑组织病变最为明显相吻合。Novikoff等[14]研究发现虽然小花棘豆的主要毒性成分苦马豆素代谢半衰期仅为20 h,但中毒动物停止采食有毒植物后,其神经系统的紊乱仍会持续数天乃至数周。这可能与动物脑组织的毒性物质蓄积有关,但目前未被相关研究所证实。
虽然中毒小鼠肝脏、肾脏等器官均发生以空泡变性为主的病理变化,但仍存在一定的差异。肝脏病变部位集中在肝小叶,极可能与代谢过程中的N-糖基化有关;肾脏中近曲小管的病理变化较远曲小管明显,可能与二者对钠、钾、氯等离子的不同吸收或排除程度有关;小花棘豆中毒可导致动物糖代谢发生紊乱,其中大量的α-甘露糖作为异常代谢产物进入脾脏,脾脏中的免疫细胞便对甘露糖发生捕获和吞噬,而边缘区是脾内免疫细胞捕获、识别、处理抗原和诱发免疫应答的主要部位,所以脾脏病变以边缘区和红髓为主,尤其以巨噬细胞最为显著,这也与Armien等[15]的报道一致。
从本试验结果来看,小花棘豆中毒可导致肝脏系数、肾脏系数和肺脏系数增大,脑系数、心脏系数和脾脏系数降低,中毒小鼠肝脏、脾脏、心脏、肺脏、肾脏、脑组织等发生以空泡变性为主要特征的病理学变化,而且随着小花棘豆摄入量的增加,其剂量效应也越明显。
[1] 中国科学院中国植物志编辑委员会.中国植物志(第四十二卷第一分册)[M].北京:科学出版社,1993:83-347.
[2] 王帅,贾琦珍,陈根元,等. 新疆小花棘豆的毒性危害与利用[J]. 新疆畜牧业, 2012,37(4):54-55.
[3] 高超, 斯坎达尔·买合木提, 米克热木·沙依不扎提, 等. 新疆小花棘豆饲喂小白鼠的急性毒性试验脏器系数分析[J].新疆农业大学学报,2008, 31(2):63-66.
[4] 宋丽, 米克热木·沙依不扎提, 斯坎达尔·买合木提,等. 新疆小花棘豆饲喂大鼠的亚慢性毒性试验及棘毒净解毒效果观察[J].新疆农业大学学报,2009, 32(1):26-30.
[5] 米克热木·沙依不扎提, 斯坎达尔·买合木提, 高超,等. 小花棘豆小鼠亚急性中毒脾脏组织结构观察及“棘毒净”效果初探[J].新疆农业大学学报,2010, 33(1):57-60.
[6] 王帅,陈根元,胡建军,等. 南疆地区小花棘豆化学成分的初步研究[J].江苏农业科学,2011, 39(2):453-454.
[7] 张玲,陈根元,吴书奇,等.小鼠日粮中添加小花棘豆黄酮的安全性试验[J].中国畜牧兽医,2013, 40(1):99-102.
[8] 陈绍淑,赵宝玉,何生虎,等.小鼠小花棘豆中毒的病理学观察[J].中国兽医科技,2004, 34(12):77-79.
[9] 王姗姗,路浩,荣杰, 等. 甘肃棘豆对SD大鼠组织损伤的病理学[J].中国兽医学报,2013, 33(2):246-249.
[10] 庞龙,路浩,赵宝玉,等. 苦马豆素对新生SD大鼠大脑皮质神经细胞形态学损伤作用的研究[J]. 中国兽医学报,2012, 32(10):1547-1550.
[11] Bryan L S, Russell J M, Naoki A, et al. The comparative pathology of the glycosidase inhibitors swainsonine, castanospermine and calystegines A3, B2 and C1 in mice[J].Toxicol patholt,2008,36(5):651-659.
[12] 王帅,张玲,陈根元,等.苦马豆素对小鼠肝脏抗氧化功能的影响[J]. 新疆农业科学, 2012,49(12):2304-2309.
[13] 王帅,张玲,陈根元,等. 苦马豆素对小鼠脑组织抗氧化功能的影响[J]. 西北农业学报, 2013,22(7):12-18.
[14] Novikoff P M, Touster O, Novikoff A B. Effects of swainsonine on rat liver and kidney: Biochemical and morphological studies[J]. J. Cell Biol, 1985,101(8):339-349.
[15] Armien A G, Tokarnia C H, Peixoto P V, et al. Clinical and morphologic changes in ewes and futuses poisoned by Ipomoea carnea subspecies fistulosa[J].J Vet Diagn Invest,2011,23(2):221-232.

