白细胞介素37在类风湿关节炎发病机制中的作用
陈欢雪,王晓非
(中国医科大学附属盛京医院风湿免疫科,沈阳110004)
白细胞介素37在类风湿关节炎发病机制中的作用
陈欢雪,王晓非
(中国医科大学附属盛京医院风湿免疫科,沈阳110004)
Role ofIL-37 in the Pathogenesisof Rheumatoid Arthritis
通过检测类风湿关节炎(RA)患者血清白细胞介素37(IL-37)水平,探讨其在RA的发生及发展过程中的作用。结果表明,RA患者血清IL-37水平明显升高,提示IL-37与疾病活动密切相关,作为一种抗炎性细胞因子,IL-37可能在RA的发生及发展过程中起保护性作用。
类风湿关节炎;白细胞介素37;肿瘤坏死因子α
类风湿关节炎(rheumatoid arthritis,RA)是一种以侵蚀性关节炎为特征的自身免疫性疾病,病理表现为关节滑膜的慢性炎症及血管翳形成。炎症持续存在可造成关节软骨和骨破坏,最终导致关节畸形和功能丧失。其发病机制尚未完全明确。细胞因子的介导作用在RA的发生及发展过程中起重要作用。白细胞介素(interleukin,IL)是最具影响力的细胞因子之一。IL-37属于IL-1家族,是近年来发现的抗炎性细胞因子[1]。研究证实,IL-37在多种炎性疾病和自身免疫性疾病的发生及发展过程中起保护性作用[2~5]。本研究通过酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)方法检测了RA患者及健康体检者的血清IL-37水平,并与其他临床数据及实验室检查指标相结合,初步探讨IL-37在RA的发生及发展过程中的作用。
1 材料与方法
1.1 研究对象及分组
收集2013年4月至8月在中国医科大学附属盛京医院风湿免疫科住院的RA患者68例作为RA组。均符合2009年美国风湿病学会/欧洲抗风湿病联盟(ACR/EULAR)RA分类诊断标准[6]。男11例,女57例。年龄21~79岁,平均(54.41±14.09)岁。病程1个月~50年,平均(6.62±9.38)年。根据RA疾病活动指数(disease activity score,DAS)评分[7]分为高度活动组(DAS28≥5.1)(n=39)和中度活动组(3.2≤DAS28<5.1)29例(n=29)。
选择我院体检中心的健康体检者20例作为对照组。男4例,女16例。年龄25~67岁,平均(53.50±10.55)岁。无RA或其他自身免疫性疾病及肿瘤病史。与RA组一般资料比较,差异无统计学意义(P>0.05)。
1.2 观察指标
详细记录RA患者的临床数据及实验室检查指标,包括压痛关节数、肿胀关节数、C反应蛋白(C-reactive protein,CRP)、红细胞沉降率(erythrocyte sedimentation rate,ESR)、类风湿因子(rheumatoid factor,RF)、抗环瓜氨酸肽(cyclic citrullinated peptide,CCP)抗体、DAS28评分等。
1.3 研究方法
采集受试者清晨空腹静脉血3 mL。离心后取上清,置于-20℃保存待测。全部标本一次性检测。血清IL-37、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)水平测定采用ELISA方法,试剂盒分别购自武汉优尔生科技股份有限公司、欣博盛生物科技有限公司,严格按照说明书进行操作。
1.4 统计学分析
采用SPSS统计软件进行分析。计量资料以x±s表示。组间比较采用t检验,相关性检验采用直线相关分析并计算Pearson相关系数r。P<0.05为差异有统计学意义。
2 结果
2.1 各组血清IL-37、TNF-α水平的比较
RA组血清IL-37、TNF-α水平显著高于对照组(P<0.01),高度活动组显著高于中度活动组及对照组(P<0.01),中度活动组显著高于对照组(P<0.01)。见表1。
2.2 RA患者血清IL-37、TNF-α水平与各项临床数据及实验室检查指标的相关性
RA患者血清IL-37、TNF-α水平与患者的压痛关节数、肿胀关节数、CRP、ESR、RF及DAS28评分呈正相关(P<0.05),而与病程及抗CCP抗体无相关性(P>0.05),且RA患者血清IL-37水平与血清TNF-α水平呈正相关(P<0.01)。见表2。
3 讨论
RA是一种临床常见的以侵蚀性关节炎为特征的由免疫、感染、内分泌、遗传、环境等多因素参与的自身免疫性疾病。主要表现为慢性对称性多关节炎,好发于手、腕、足等小关节,早期多为关节红肿热痛及功能障碍,晚期可出现不同程度的关节畸形,同时可伴有关节外多系统受累。RA世界平均患病率为0.5%~1%,我国为0.32%~0.36%[8],其发病机制至今尚未完全明确。研究表明,自身免疫性疾病与促炎、抗炎性细胞因子的失衡密切相关,细胞因子的异常产生及相互作用在RA的发生及发展过程中起重要作用。
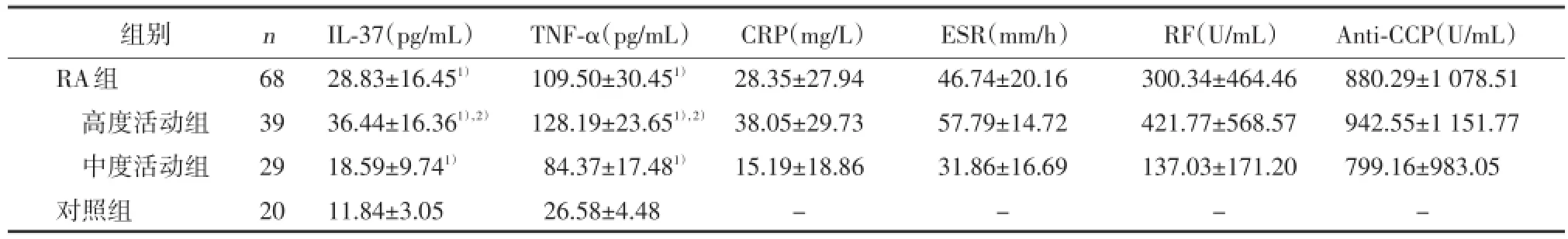
表1 各组血清IL⁃37、TNF⁃α水平的比较

表2 RA患者临床数据及实验室检查指标与血清IL⁃37、TNF⁃α的相关性
TNF-α是一种具有广泛生物学活性的细胞因子,对维持机体的正常功能具有重要作用。TNF-α主要由RA患者外周血单核细胞和关节滑膜巨噬细胞分泌,在一定条件下也可由淋巴细胞、平滑肌细胞、成纤维细胞等产生。在疾病活动期和进展期TNF-α呈现高水平分泌,并出现一系列临床症状和局部关节组织的破坏,缓解期RA患者TNF-α水平相对低且稳定,其浓度与RA患者疾病严重程度一致[9]。TNF-α已被公认是RA发病过程中重要的促炎性细胞因子,其促进RA发病的主要机制为:诱导内皮细胞表达黏附分子,促进白细胞和血管内皮黏附渗透,进而导致局部炎症[10];通过刺激滑膜成纤维细胞、软骨细胞产生前列腺素E2、胶原酶,促进骨破坏、骨吸收和成纤维细胞增生,抑制骨胶原的合成[11];增加滑膜、内皮细胞及成纤维细胞生长因子释放,导致血管翳形成[12];促进软骨细胞分泌纤维蛋白溶酶激活剂,使纤维蛋白酶原转变成纤维蛋白,加快关节损伤的过程[13]。动物实验证明,中和TNF-α能够降低关节炎的严重程度[14]。目前,TNF-α单克隆抗体已经成功应用于RA患者的治疗,并取得了良好效果[15,16]。本研究发现,血清TNF-α水平RA组显著高于对照组,高度活动组显著高于中度活动组及对照组,中度活动组水平显著高于对照组,且RA患者血清TNF-α水平与患者的压痛关节数、肿胀关节数、CRP、ESR、RF及DAS28评分呈正相关,与已有研究结果相符,说明血清TNF-α水平与RA疾病活动程度相关。
IL-37又称IL-1F7(IL-1 family member 7),是IL-1家族的第7个成员。2000年Kumar等[2]首次发现了这种与IL-1家族成员具有共同结构域的前体肽。IL-1家族绝大多数是促炎性细胞因子,通过刺激炎症和自身免疫性疾病相关基因的表达,诱导环氧化酶、磷脂酶A2、干扰素γ、黏附分子等效应蛋白的表达,在免疫性疾病的调节和炎症进程中扮演重要角色[17]。不同于其他IL-1家族成员,IL-37是一种天然的免疫应答抑制物,能够抑制多种炎性因子的表达。IL-37存在5种剪切变异体,即IL-37a、IL-37b、IL-37c、IL-37d和IL-37e,其中IL-37b是最大的,包含6个外显子中的5个,也是外周血中IL-37的主要形式[3]。IL-37b与IL-18具有相似的同源序列,前体或成熟的IL-37b均可与IL-18受体α链(IL-18Rα)结合,但IL-37b并不影响IL-18的活性。IL-37在健康人体的不同组织中呈低度表达,发生炎性反应时,其表达可显著升高。用siRNA干扰外周血单核细胞(peripheral blood mononuclear cell,PBMC)表达IL-37b,会使促炎性细胞因子的合成大幅增加,而IL-10等炎症抑制因子的表达未受到影响[5]。Nold等[5]通过动物实验证明IL-37可以抑制感染性休克的发生。Mc-Namee等[4]发现,IL-37对葡聚糖硫酸钠(dextran sulfate sodium,DSS)诱导的炎性肠病具有保护性作用。体外实验表明,TNF-α等促炎性细胞因子可上调IL-37的表达,免疫组化染色发现,IL-37在活动期RA患者的滑膜组织中呈高水平表达,提示IL-37可能具有炎症抑制作用,通过负反馈机制抑制过度的炎性反应[5]。本研究结果亦发现,RA患者血清IL-37水平较正常对照组升高,且随着疾病活动程度的增强,血清IL-37水平亦升高,同时,血清IL-37水平与患者的压痛关节数、肿胀关节数、CRP、ESR、RF、DAS28评分及TNF-α水平呈正相关。说明IL-37作为一种抗炎性细胞因子,随着炎性反应的增强和促炎性细胞因子TNF-α的升高而升高,与疾病活动密切相关,可能在RA的发生及发展过程中起保护性作用。
[1]Dunn E,Sims JE,Nicklin MJ,et al.Annotating genes with potential roles in the immune system:six new members of the IL-1 family[J].Trends Immunol,2001,22(10):533-536.
[2]Kumar S,McDonnell PC,Lehr R,et al.Identification and initial characterization of four novel members of the interieukin-1 family[J].J Biol Chem,2000,275(14):10308-10314.
[3]Banchereau J,Pascual V,O’Garra A.From IL-2 to IL-37:the expanding spectrum of anti-inflammatory cytokines[J].Nat Immunol,2012,13(10):925-931.
[4]McNamee EN,Masterson JC,Jedlicka P,et al.Interleukin 37 expression protects mice from colitis[J].Proc Natl Acad Sci USA,2011,108(40):16711-16716.
[5]Nold MF,Nold-Petry CA,Zepp JA,et al.IL-37 is a fundamental inhibitor of innate immunity[J].Nat Immunol,2010,11(11):1014-1022.
[6]中华医学会风湿病学分会.类风湿关节炎诊断及治疗指南[J].中华风湿病学杂志,2010,14(4):265-270.
[7]Prevoo ML,van't Hof MA,Kuper HH,et al.Modified disease activity scores that include twenty-eight-joint counts:development and validation in a prospective longitudinal study of patients with rheumatoid arthritis[J].Arthritis Rheum,1995,38(1):44-48.
[8]陆再英,钟南山.内科学[M].7版.北京:人民卫生出版社,2008:848-855.
[9]Robak T,Gladalska A,Stepień H.The tumour necrosis factor family of receptors/ligands in the serum of patients with rheumatoid arthritis[J].Eur Cytokine Netw,1998,9(2):145-154.
[10]Colmegna I,Ohata BR,Menard HA.Current understanding of rheumatoid arthritis therapy[J].Clin Pharmacol Ther,2012,91(4):607-620.
[11]Vinay DS,Kwon BS.Targeting TNF superfamily members for therapeutic intervention in rheumatoid arthritis[J].Cytokine,2012,57(3):305-312.
[12]Queiroz-Junior CM,Madeira MF,Coelho FM,et al.Experimental arthritis triggers periodontal disease in mice:involvement of TNF-α and the oral Microbiota[J].J Immunol,2011,187(7):3821-3830.
[13]Braun T,Zwerina J.Positive regulators of osteoclastogenesis and bone resorption in rheumatoid arthritis[J].Arthritis Res Ther,2011,13(4):235.
[14]Baumgartner SW.Tumor necrosis factor invactivation in the management of rheumatoid arthritis[J].South Med J,2000,93(8):753-759.
[15]Simsek I.TNF inhibitors-new and old agents for rheumatoid arthritis[J].Bull NYU Hosp Jt Dis,2010,68(3):204-210.
[16]Pease C,Pope JE,Truong D,et al.Comparison of anti-TNF treatment initiation in rheumatoid arthritis databases demonstrates wide countryvariability in patient parameters at initiation of anti-TNF therapy[J].Semin Arthritis Rheum,2011,41(1):81-99.
[17]Dinarello CA.The IL-1 family and inflammatory diseases[J].Clin Exp Rheumatol,2002,20(5 Suppl 27):S1-S13.
(编辑王又冬)
R593.22
A
0258-4646(2014)03-0275-02
辽宁省科学技术计划(2011225015);沈阳市科学技术计划(F12-277-1-85)
陈欢雪(1987-),女,硕士研究生.
王晓非,E-mail:wangxf@sj-hospital.org
2013-12-18
网络出版时间:

