SOX2在5⁃氟尿嘧啶处理的人喉癌Hep⁃2细胞中的表达及作用机制
杨宁,惠莲,杨会军,姜学钧
(中国医科大学附属第一医院耳鼻咽喉科,沈阳110001)
SOX2在5⁃氟尿嘧啶处理的人喉癌Hep⁃2细胞中的表达及作用机制
杨宁,惠莲,杨会军,姜学钧
(中国医科大学附属第一医院耳鼻咽喉科,沈阳110001)
目的探讨5-氟尿嘧啶(5-FU)对人喉癌Hep-2细胞中干细胞转录因子SOX2表达的影响及机制,并分析SOX2拮抗5-FU诱导的细胞凋亡作用。方法CCK-8法检测48 h内不同浓度5-FU对Hep-2细胞生长的抑制作用,统计抑制率和IC50值。Western blot法检测5-FU作用不同时间后SOX2的表达量,并检测PI3K/AKT信号活化情况。Hoechst染色法检测细胞凋亡。结果5-FU对Hep-2细胞生长抑制作用明显,IC50值为20.92 μg/mL。随着时间的延长SOX2表达增高,48 h达到最大值,磷酸化AKT活化也随着时间的延长逐渐增加。使用PI3K/AKT信号特异性抑制剂LY294002处理后,SOX2表达被下调;Hoechst染色法显示细胞凋亡数增多。同时检测凋亡相关蛋白表达变化,结果显示Survivin、Bcl-2、BAX在5-FU处理的Hep-2细胞中表达均上升,但PI3K/AKT信号抑制后抗凋亡蛋白Survivin、Bcl-2被显著下调,凋亡蛋白BAX表达继续上调。结论PI3K/AKT信号活化诱导SOX2表达在Hep-2细胞拮抗5-FU诱导的细胞凋亡中发挥了重要作用。
人喉癌;SOX2;5-氟尿嘧啶;PI3K/AKT
SOX是一类Y染色体性别决定区相关基因家族,编码一系列SOX家族的转录因子,参与胚胎发育和细胞分子调控。SOX2是干细胞转录因子,在干细胞表型维持、药物耐受中发挥重要作用[1]。近年来研究发现SOX2作为转录因子参与多种实体瘤的发生发展过程,在神经瘤、乳腺癌、下咽部鳞癌、肺腺癌、前列腺癌及卵巢癌中都伴有SOX2的异常表达,并参与肿瘤的耐药机制[2~4]。喉癌是我国十大肿瘤之一,目前我国主要的治疗手段仍是手术治疗,但国际上出于对功能学的考虑,近年来更加注重喉癌的化疗及放疗,随着经验的积累,越来越多的临床病例显示喉癌的多药耐药性严重影响了喉癌的治疗效果[5]。SOX2在人喉癌组织中高表达,并与喉癌的转移、病理等级、临床分期及不良预后高度相关[6,7]。我们的前期研究也发现SOX2在人喉癌上皮细胞Hep-2中过表达能显著增强Hep-2细胞的增殖、侵袭能力及细胞表型的改变,但SOX2在喉癌化疗敏感性中的作用还未见报道。本研究通过探讨5-氟尿嘧啶(5-fluorouracil,5-FU)作用前后SOX2的表达变化及诱导其表达的机制,分析SOX2在Hep-2细胞拮抗5-FU诱导的细胞凋亡中的作用,以期为喉癌的耐药治疗提供支持。
1 材料与方法
1.1 实验材料与试剂
5-FU购自美国Sigma公司(纯度>99%);ECL化学发光试剂盒为美国Pierce公司产品;DMEM培养基为美国Gibco公司产品;细胞培养所用胎牛血清、青霉素和链霉素均购自美国Hyclone公司;Hoechst凋亡检测试剂盒和CCK-8细胞增殖检测试剂盒购自碧云天生物技术研究所;兔抗人Survivin、Bcl-2、BAX、SOX2多克隆抗体和HRP标记羊抗兔IgG购自沈阳万类生物科技有限公司;其他生化试剂为国产分析纯。
1.2 细胞培养
人喉癌上皮细胞Hep-2常规培养于含20%胎牛血清、100 U/mL青霉素和100 mg/L链霉素的RPMI 1640培养基中,置于37℃、5%CO2、相对湿度95%的培养箱中培养。每2~3 d用0.05%胰蛋白酶-EDTA消化传代1次。取对数生长期的细胞进行实验。
1.3 Western blot法检测蛋白表达
根据实验要求处理细胞后,加入400 μL NP-40裂解液,置于冰上,用移液器将其吹散至单细胞悬液,然后继续置于冰上静置5 min。开启低温冷冻离心机,12 000 r/min、4℃离心10 min,分离上清为所得的蛋白质抽提物。BCA试剂盒检测蛋白浓度后,取20 μg蛋白制备成20 μL上样缓冲液,经电泳、转膜、抗体孵育后,ECL显影检测蛋白表达。依次分别使用兔抗人Survivin、Bcl-2、Bax、SOX2多克隆抗体和β-actin单克隆抗体作为一抗(抗体稀释比均为1∶1 000),HRP标记羊抗兔IgG为二抗(抗体稀释比均为1∶2 000)。所有实验独立重复3次。
1.4 CCK-8法检测细胞增殖
取对数生长期细胞消化、传代平铺到5块96孔细胞培养板,每孔加200 μL细胞悬液,使得每孔约含2×103个细胞,平行设置8个复孔。将培养板置于37℃、5%CO2培养箱内培养,细胞贴壁后即为0 h(规定为传代后12 h)时,依据实验设计加药处理48 h后,每孔加入10 μL CCK-8试剂,置37℃培养箱中孵育2 h,450 nm处检测各孔光密度(optical density,OD)值,计算增殖抑制率及50%抑制浓度(half maximal inhibitory concentration of a substance,IC50)。增殖抑制率=(对照组OD450值-实验组OD450值)/对照组OD450值,IC50值使用IC50值计算软件获得。
1.5 Hoechst染色法检测细胞凋亡
取对数生长期细胞消化,传代平铺到铺有载玻片的6孔板中,加入化疗药物处理48 h后弃去培养基,PBS洗2遍,加入0.5 mL固定液,4℃固定20 min;去固定液,用PBS洗2遍,每次3 min,洗涤期间手动晃动数次,吸尽液体;均匀滴上0.5 mL Hoechst33258染色液,染色5 min,去染色液,用PBS洗2遍,每次3 min,吸尽液体。滴一滴抗荧光淬灭封片液于载玻片上,盖上贴有细胞的盖玻片,让细胞接触封片液,尽量避免气泡;随即将玻片置荧光显微镜下观察,镜下(200×)进行图像采集。
1.6 统计学分析
采用SPSS 13.0统计学软件进行统计分析。各组实验指标经Shapiro-Wilk检验呈正态分布,以s表示。多组间比较采用单因素方差分析,组间的两两比较均采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 5-FU抑制Hep-2细胞增殖
为了论证5-FU对Hep-2细胞生长的抑制作用,本研究通过CCK-8法检测不同浓度(0、5、10、20、40、80 μg/mL)5-FU培养人Hep-2细胞48 h的OD450值。随着药物浓度的提高,5-FU对Hep-2细胞生长的抑制作用增强,IC50值为20.92 μg/mL(图1)。
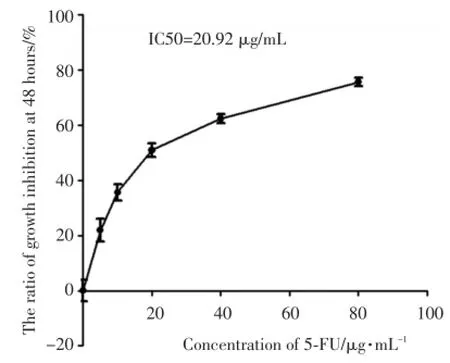
图1 5⁃FU抑制Hep⁃2细胞增殖Fig.1 5⁃FU inhibited the proliferation of Hep⁃2 cells
2.2 SOX2在5-FU处理的Hep-2细胞中高表达
为了研究5-FU处理的Hep-2细胞对SOX2表达的影响,本研究利用IC50值为20.92 μg/mL的5-FU培养的Hep-2细胞,并分别在0、12、24、48、72 h时收集细胞,Western blot法检测SOX2的表达;5-FU处理后,Hep-2细胞中SOX2的表达随着时间延长逐渐上升,48 h达到峰值(图2)。
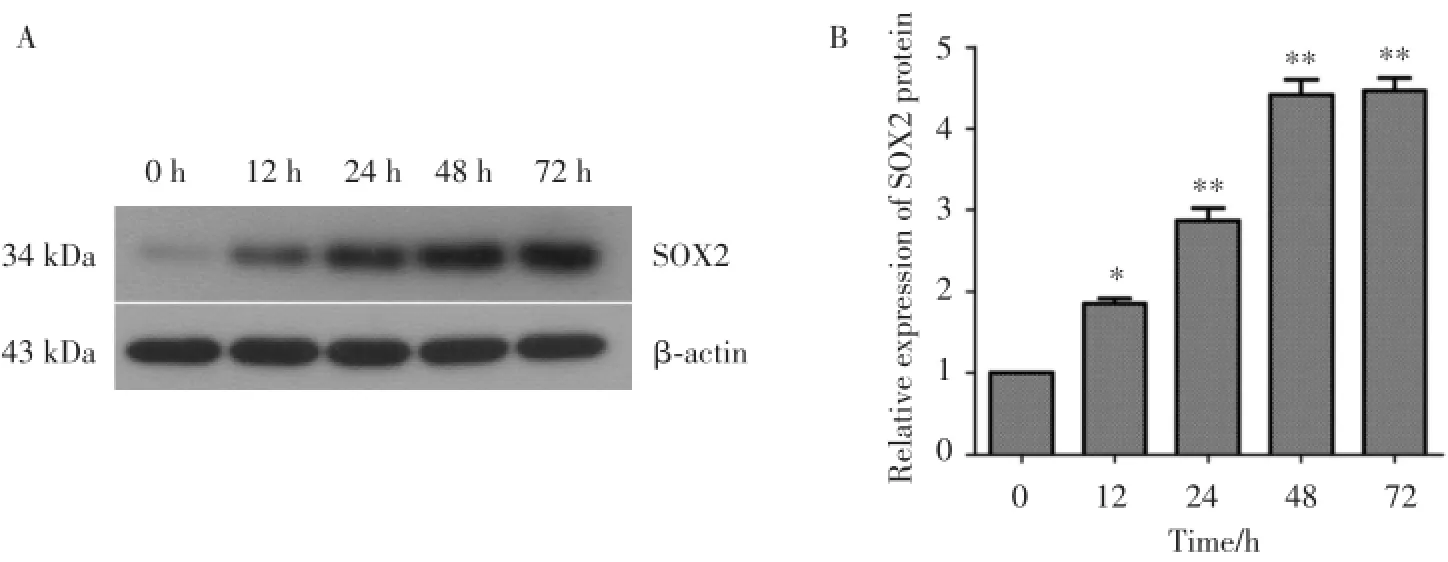
图2 SOX2在5⁃FU处理的Hep⁃2细胞高表达Fig.2 The protein expression of SOX2 was up⁃regulated in Hep⁃2 cells after 5⁃FU treatment
2.3 PI3K/AKT信号活化上调SOX2表达
为了阐明调控SOX2表达的可能机制,本研究采用20.92 μg/mL(IC50值)的5-FU培养Hep-2细胞,并分别在0、12、24、48、72 h时收集细胞,采用Western blot法检测了PI3K/AKT信号活化的关键分子AKT磷酸化情况。5-FU处理后,Hep-2细胞中的磷酸化蛋白激酶B(p-AKT)表达与SOX2一致,随着作用时间延长逐渐上升(图3)。采用磷脂酰肌醇激酶/蛋白激酶B(PI3K/AKT)信号特异性抑制剂LY294002处理5-FU(20.92 μg/mL)培养的Hep-2细胞48 h后收集细胞,采用Western blot法检测SOX2表达,结果显示PI3K/AKT信号抑制后SOX2表达被下调(图4)。

图3 PI3K/AKT信号在5⁃FU处理的Hep⁃2细胞中被活化Fig.3 The PI3K/AKT signaling pathway was activated in Hep⁃2 cells after 5⁃FU treatment
2.4 SOX2参与Hep-2细胞拮抗5-FU诱导的细胞凋亡作用
化疗药物诱导肿瘤细胞凋亡是抗肿瘤治疗最主要方式,本研究通过使用PI3K/AKT信号特异性抑制剂LY294002处理5-FU(20.92 μg/mL)培养Hep-2细胞48 h,探讨SOX2被抑制后Hep-2细胞凋亡的变化及相关凋亡蛋白表达的变化。Hoechst染色法检测细胞凋亡,结果显示与单独5-FU培养Hep-2细胞相比,使用抑制剂LY294002处理后,5-FU诱导细胞凋亡能力增强(图5)。Western blot法检测凋亡蛋白表达变化,结果显示,在单独使用5-FU培养Hep-2细胞中Survivin、Bcl-2、Bax表达均升高;使用抑制剂LY294002处理后,抗凋亡蛋白Survivin、Bcl-2表达显著下降,凋亡蛋白Bax上升趋势更加明显(图6)。

图4 5⁃FU诱导的Hep⁃2中SOX2高表达主要由PI3K/AKT信号介导Fig.4 5⁃FU induced increased expression of SOX2 in Hep⁃2 cells mainly through the PI3K/AKT signaling pathway
图5 SOX2表达抑制增强5⁃FU诱导的Hep⁃2细胞凋亡Fig.5 LY294002 inhibited SOX2 expression and contributed to the enhanced Hep⁃2 cells apoptosis induced by 5⁃FU

图6 SOX2表达抑制增强5⁃FU诱导的凋亡蛋白BAX的表达Fig.6 LY294002 inhibited SOX2 expression and contributed to the enhanced apoptotic protein Bax expression induced by 5⁃FU
3 讨论
IC50是药物抑制细胞生长一半时的药物浓度值,可以用来评判药物诱导凋亡的能力或细胞对药物的耐受程度。IC50值的高低,说明药物诱导细胞凋亡能力或细胞对化疗药物的耐受程度。IC50药物浓度常常被用于建立药物诱导肿瘤细胞凋亡模型,探讨药物诱导细胞凋亡的机制研究及肿瘤细胞拮抗细胞凋亡的机制研究[8]。本研究发现随着5-FU药物浓度的提高,对Hep-2细胞生长抑制作用增强;48 h的IC50值为20.92 μg/mL,与前期研究一致[9],提示Hep-2细胞对5-FU耐受稳定存在,建立的5-FU诱导细胞耐受模型成立。
AKT又称蛋白激酶B,是一种丝氨酸/苏氨酸蛋白激酶,在细胞存活和凋亡中起重要作用。肿瘤细胞中PI3K-AKT作为一条经典信号途径被活化,磷酸化AKT能活化下游多个转录因子,上调抗凋亡蛋白Bcl-2及耐药基因耐受化疗药物诱导的细胞凋亡[10]。研究显示使用PI3K抑制剂LY294002处理可抑制磷脂酰肌醇-3磷酸的生成,阻断了AKT的磷酸化,抑制人喉癌Hep-2细胞的增殖,诱导细胞的凋亡[11]。研究显示,在5-FU连续作用的EB病毒阳性的胃癌细胞中PI3K/AKT/p-NF-κB被活化,发挥对药物耐受作用,使用LY294002处理后,5-FU耐受作用消失[12]。本研究通过使用5-FU(20.92 μg/mL)建立一定程度的Hep-2细胞耐受,得到PI3K/AKT在5-FU处理的12~48 h内PI3K/AKT活化水平持续升高,到72 h仍维持在较高的水平。分析这可能与非耐受细胞死亡、耐受细胞增多有关;也提示我们PI3K/AKT参与了Hep-2细胞对5-FU的耐受。
SOX2在多种肿瘤中为高表达,参与肿瘤细胞耐药机制形成[13]。喉癌耐药病例研究也显示SOX2高表达与喉癌的复发和不良预后高度相关[7],提示喉癌药物耐受过程中SOX2可能也发挥了重要作用。本研究中,使用5-FU处理Hep-2细胞得到SOX2表达随着作用时间的延长逐渐升高,使用PI3K/AKT抑制剂LY294002处理后SOX2的表达减少。这与前期报道的亚砷酸钠抑制PI3K-AKT信号后将显著抑制PI3K/AKT下游转录因子SOX2表达[14]以及转化生长因子α通过EGFR/PI3K/AKT信号调节SOX2和Survivin基因表达一致[15]。同时使用LY294002降低SOX2表达后,检测到细胞凋亡增多,这也与前期报道的使用RNA干扰特异性沉默SOX2后细胞增殖能力减弱、细胞凋亡增多一致[16];提示PI3K/AKT上调SOX2可能是Hep-2细胞对5-FU耐受的主要原因。
凋亡蛋白的表达变化是观察化疗药物诱导细胞凋亡的主要分子指标;Bax是凋亡蛋白,在化疗药物处理Hep-2细胞凋亡中被诱导大量表达,介导细胞凋亡;Bcl-2是抗凋亡蛋白,在化疗药物诱导的细胞凋亡反应中活化,起着一定的抗肿瘤细胞凋亡作用;Survivin基因在肿瘤细胞中高表达,是肿瘤细胞抑制细胞凋亡的主要基因。本研究中,我们发现在5-FU处理的Hep-2细胞中Survivin、Bcl-2表达上调,这可能与Hep-2细胞耐药性作用有关;使用LY294002降低SOX2表达后发现Survivin、Bcl-2表达显著降低,这可能与SOX2上调Survivin、Bcl-2有关。
综上所述,SOX2在5-FU处理的Hep-2细胞中表达上调主要由PI3K/AKT信号的活化介导,SOX2通过上调Survivin、Bcl-2在Hep-2细胞对5-FU耐受中发挥重要作用;靶向PI3K/AKT抑制SOX2表达可能是喉癌耐药治疗的有效靶点。
[1]Kioke T,Wakabayashi T,Mori T,et al.Sox2 in the adult rat sensory nervous system[J].Histochem Cell Biol,2014,14(3):301-309.
[2]Shivane A,Parkinson DB,Ammoun S,et al.Expression of c-Jun and Sox-2 in human schwannomas and traumatic neuromas[J].Histopathology,2013,62(4):651-656.
[3]Yang J,Liao D,Chen C,et al.Tumor-associated macrophages regulate murine breast cancer stem cells through a novel paracrine EGFR/Stat3/Sox-2 signaling pathway[J].Stem Cells,2013,31(2):248-258.
[4]Hage C,Rausch V,Giese N,et al.The novel c-Met inhibitor cabozantinib overcomes gemcitabine resistance and stem cell signaling in pancreatic cancer[J].Cell Death Dis,2013,4:e627.
[5]Li DW,Dong P,Wang F,et al.Hypoxia induced multidrug resistance of laryngeal cancer cells via hypoxia-inducible factor-1alpha[J].Asian Pac J Cancer Prev,2013,14(8):4853-4858.
[6]叶飞,黄桂球,傅敏仪,等.SOX2蛋白在喉癌组织中的表达及临床意义[J].临床耳鼻咽喉头颈外科杂志,2013,27(3):136-139.
[7]Tang XB,Shen XH,Li L,et al.SOX2 overexpression correlates with poor prognosis in laryngeal squamous cell carcinoma[J].Auris Nasus Larynx,2013,40(5):481-486.
[8]张敬东,佟晓光,刘云鹏,等.胃癌细胞对三氧化二砷的敏感性与活性氧产生的关系[J].中国医科大学学报,2010,39(6):432-434.
[9]Di Luigi L,Sottili M,Antinozzi C,et al.The vitamin D receptor agonist BXL-01-0029 as a potential new pharmacological tool for the treatment of inflammatory myopathies[J].PLoS One,2013,8(10):e77745.
[10]Zhang W,Ding W,Chen Y,et al.Up-regulation of breast cancer resistance protein plays a role in HER2-mediated chemoresistance through PI3K/Akt and nuclear factor-kappa B signaling pathways in MCF7 breast cancer cells[J].Acta Biochim Biophys Sin(Shanghai),2011,43(8):647-653.
[11]Wang YQ,Chen C,Chen Z,et al.Indole-3-carbinol inhibits cell proliferation and induces apoptosis in Hep-2 laryngeal cancer cells[J].Oncol Rep,2013,30(1):227-233.
[12]Shin JY,Kim JO,Lee SK,et al.LY294002 may overcome 5-FU resistance via down-regulation of activated p-AKT in Epstein-Barr virus-positive gastric cancer cells[J].BMC Cancer,2010,10:425.
[13]Saigusa S,Tanaka K,Toiyama Y,et al.Correlation of CD133,OCT4,and SOX2 in rectal cancer and their association with distant recurrence after chemoradiotherapy[J].Ann Surg Oncol,2009,16(12):3488-3498.
[14]Ivanov VN,Wen G,Hei TK.Sodium arsenite exposure inhibits AKT and Stat3 activation,suppresses self-renewal and induces apoptotic death of embryonic stem cells[J].Apoptosis,2013,18(2):188-200.
[15]Lin F,Lin P,Zhao D,et al.Sox2 targets cyclinE,p27 and survivin to regulate androgen-independent human prostate cancer cell proliferation and apoptosis[J].Cell Prolif,2012,45(3):207-216.
[16]Oppel F,Muller N,Schackert G,et al.SOX2-RNAi attenuates S-phase entry and induces RhoA-dependent switch to protease-independent amoeboid migration in human glioma cells[J].Mol Cancer,2011,10:137.
(编辑陈姜)
SOX2 Expression in Human LaryngealCarcinoma Hep-2 Cellsand the Related Mechanism under the Treatmentof5-fluorouracil
YANG Ning,HUILian,YANGHui-jun,JIANGXue-jun
(DepartmentofOtorhinolaryngology,The FirstHospital,China MedicalUniversity,Shenyang 110001,China)
ObjectiveTo investigate the effects and mechanism of 5-fluorouracil(5-FU)on the expression of stem cell transcription factor SOX2 in human laryngealcancer Hep-2 cells,and analyze the antagonistrole ofSOX2 on 5-FU induced cellapoptosis.MethodsCCK-8 assay was used to testthe growth inhibition ofHep-2 cells treated with differentconcentrations of5-FU at48 h,and the rate ofinhibition and IC50 values were calculated.The protein expression ofSOX2 and activation ofPI3K/AKTsignaling were detected by Western blotanalysis atdifferenttime points aftertreatment,and Hoechst staining assay was used to detect cells apoptosis.ResultsThe growth of Hep-2 cells was significantly inhibited by 5-FU with a concentration-dependent manner,and the value of IC50 was 20.92μg/mL.The expression of SOX2 was increased with time-dependence and reached peak at 48 h,and p-AKT activation was also gradually increased with time-dependence.However,when Hep-2 cells were treated by the PI3K/AKT inhibitor LY294002,the expression ofSOX2 wasreduced and the numberofapoptotic cells was dramatically increased.Moreover,the results ofthe expressions ofapoptosis-related proteins showed thatSurvivin,Bcl-2,and BAXwere allincreased in Hep-2 cells afterthe treatmentby 5-FU,but the expressions Survivin and Bcl-2 were significantly reduced,BAX was continuing increase when treatment by LY294002.ConclusionPI3K/AKT signaling activation playsan importantrole in antagonizing 5-FUmediated apoptosisin Hep-2 cellsthrough inducing SOX2 expression.
human laryngeal carcinoma;SOX2;5-fluorouracil;PI3K/AKT
R739.65
A
0258-4646(2014)03-0247-05
辽宁省自然科学基金(201202287)
杨宁(1974-),男,主治医师,硕士. E-mail:dyangning@163.com
2013-12-24
网络出版时间:

