低温β-半乳糖苷酶分离纯化及酶学性质研究
张 雪 华 霄 许 琪 杨瑞金 范宇婷
(1.江南大学食品学院,江苏 无锡 214122;2.云南省中小企业服务中心,云南 昆明 650000)
β-D-半乳糖苷酶(EC 3.2.1.23)具有催化乳糖中β-半乳糖苷键水解为葡萄糖和半乳糖及转移半乳糖苷的活力[1]。乳品工业中,乳糖酶用于水解乳制品中的乳糖,缓解乳糖不耐受症[2]。中国90%左右的成人有乳糖不耐症[3],生产提供低乳糖乳是解决乳糖不耐问题的有效途径[4]。
乳品工业中使用的β-半乳糖苷酶多来源于微生物,利用微生物生产β-半乳糖苷酶,具有产量高、成本低、周期短等优点[5],但目前商业β-半乳糖苷酶大多为中温酶,最适温度在37 ℃左右或者更高[6],而乳品加工中许多长时间的工艺以及贮运均在低温下进行[7],不利于β-半乳糖苷酶活力发挥,低温β-半乳糖苷酶在低温下具有较高酶活,因此在乳制品加工及储运过程中能够高效水解乳糖,且低温有利于抑制常温微生物生长,提高了乳制品安全性,且在反应结束后可通过适当升高体系温度来阻止乳糖酶的进一步反应,以保证食品风味的统一性[8]。理论研究方面,分离纯化得到纯酶可进行酶蛋白三级结构、低温酶的催化反应机制及低温酶的结构与其热敏性关系的研究。1996年,得到第一个低温酶的三级结构,该酶是来自南极的革兰氏阴性菌所产的a-淀粉酶,随后得到三级结构的低温酶分别是钙离子锌离子蛋白酶、磷酸丙糖异构酶、柠檬酸合成酶、苹果酸酶,通过这些低温酶的三级结构研究低温酶的低温适应性[9]。
目前国内外研究的大多数低温β-半乳糖苷酶产生菌为节杆 菌(arthrobacter)[10,11]和 交 替 假 单 胞 菌(Pseudoalteromonas)[12-14]。本研究中产低温乳糖酶的耐冷菌Rahnellasp.R3属于拉恩氏属[15]。与刘文玉等[16]所研究的低温乳糖酶产生 菌Rahneua aquatilis sp.14.1 属 同 一 菌 属,但 通 过16SrRNA 序列分析可知,这两株菌的基因序列有较大差异[15],是不同的菌株。
本研究拟采用硫酸铵分级沉淀、Phenyl Sepharose CL-4B疏水层析、Q Sepharose High Performance阴离子交换层析、Sephacryl S-200High Resolution凝胶过滤层析对该酶进行分离纯化,通过SDS-PAGE证实得到纯酶,之后对纯酶进行酶学性质研究,包括最适温度和pH,温度和pH 稳定性,金属离子对该酶的激活或钝化作用,以及酶催化的米氏方程。
1 材料与方法
1.1 材料与仪器
阴离子交换层析填料(Q sepharose high performance)、凝胶层析填料(sephacryl S-200high resolution)、疏水层析填料(phenyl sepharose CL-4B):美国GE Healthcare公司;
邻硝基苯-β-D-半乳糖苷(ONPG):国药集团试剂有限公司;
高分子量标准蛋白:大连宝生物公司;
其他试剂未加说明均为分析纯;
电脑全自动部分收集器:DBS-100型,上海沪西分析仪器厂;
电脑数显恒流泵:DHL-A 型,上海沪西分析仪器厂;
紫外检测器:HD-3型,上海沪西分析仪器厂;
梯度混合器:TH-300型,上海沪西分析仪器厂;
双门层析柜:REC5004V20型,美国Revco公司;
紫外分光光度计:UV-100型,尤尼柯仪器有限公司。
1.2 菌株及培养基
菌株:产低温乳糖酶的耐冷菌Rahnella sp.R3,本实验室筛选并保存;
活化 培 养 基(1/4TSB):胰 蛋 白 胨1.5%,大 豆 蛋 白胨0.5%,氯化钠0.5%,pH (7.2±0.2);
发酵培养基:乳糖3.0%,蛋白胨1.5%,酵母浸膏1.0%,NaCl 0.3%,pH (7.0±0.2)。
1.3 酶活力测定
吸取0.8mL 2.5g/L ONPG 于试管中,15℃预热,添加0.2mL酶液,15 ℃恒温反应5min,加入1mL 10% NaCO3溶液终止反应。适当稀释于420nm 处测吸光值,空白以去离子水代替酶液[15]。酶活定义为一定条件下,1 min 水解ONPG 产生1μmol邻硝基苯酚(ONP)所需的酶量定义为1个酶活单位(U)。
1.4 蛋白浓度的测定
采用Bradford法[17],以牛血清白蛋白质制作标准曲线对蛋白质浓度进行定量。
1.5 低温乳糖酶的纯化
1.5.1 菌株培养及粗酶液的制备 细菌由活化培养基活化培养24h(15 ℃,200r/min),然后按4%的接种量转接发酵培养基,发酵培养32~34h(15 ℃,200r/min)。发酵完成后,发 酵 液 离 心10 min(4 ℃,8 000r/min),收 集 菌 体,用pH 7.1的Tris-HCl缓冲液清洗两次,重悬后高压细胞破碎仪进行细胞破碎,然后离心30min(4 ℃,8 500r/min),得到粗酶液。
1.5.2 硫酸铵饱和度的确定 向7个50mL的烧杯中分别加入20mL 粗酶液,按硫酸铵饱和度为10%,20%,30%,40%,50%,60%,70%依次向烧杯中加入已研磨硫酸铵粉末,缓慢 搅 拌 至 溶 解,4 ℃静 置2h,离 心30 min(4 ℃,8 500r/min),取上清液,测上清液酶活。
1.5.3 Phenyl Sepharose CL-4B 疏 水 层 析 预 先 用 加有0.8mol/L 氯 化 钠 的20 mmol/L Tris- HCl 缓 冲 液(pH 7.5)平衡Phenyl Sepharose CL-4B(2.6cm×40cm)疏水层析柱,流速0.8 mL/min。将硫酸铵盐析后得到的粗酶液经0.22μm 的微孔滤膜后,15 mL 上样Phenyl Sepharose CL-4B(2.6cm×40cm)疏水层析柱,用含有0.8mol/L氯化钠的pH 7.5,20 mmol/L 的Tris-HCl缓冲液洗脱,待OD280 值低于0.05时,使用不含盐的20 mmol/L 的Tris-HCl缓冲液(pH 7.5)洗脱,收集并检测酶活力,收集有酶活的部分。
1.5.4 Q Sepharose High Performance离子交换层析 预先用加有0.3 mol/L 氯化钠的20 mmol/L Tris-HCl缓冲液(pH 7.1)平衡Q Sepharose High Performance(2.6cm×15cm)阴离子交换层析柱,流速1 mL/min。将通过Phenyl Sepharose CL-4B收集到 的 有 酶 活 的30 mL 上 样Q Sepharose High Performance 阴 离 子 交 换 层 析,先 用 加 有0.3mol/L氯化钠的20mmol/LTris-HCl缓冲液(pH 7.1)以相同的流速洗脱,待OD280低于0.05时,再用加有0.3~0.8mol/L氯化钠的20mmol/L Tris-HCl(pH 7.1)缓冲液线性梯度洗脱,收集并检测酶活力,收集有酶活的部分。
1.5.5 Sephacryl S-200High Resolution凝胶过滤层析 预先用20mmol/L的Tris-HCl缓冲液(pH 7.1)平衡Sephacryl S-200 High Resolution(1.6cm×100cm)凝胶过滤层析柱,流速0.5 mL/min。将离子交换层析得到的有酶活的部分15mL浓缩到3mL后经0.22μm 的微孔滤膜,上样 到 Sephacryl S-200 High Resolution 凝 胶 过 滤 层析,20mmol/L的Tris-HCl缓冲液(pH 7.1)洗脱,收集并检测酶活力,收集有酶活的部分。以上所有操作均在4 ℃层析柜中进行。
1.5.6 纯度鉴定和分子量测定 按Laemmli等的方法[18]进行SDS-PAGE,采用分离胶浓度为7.5%,浓缩胶浓度为5%,将样品和标准蛋白(高分子量标准200,116,97.2,66.4,44.3kDa)进行SDS-PAGE,然后通过凝胶成像分析软件Image lab 3.0计算酶的表观分子量。
1.6 酶学性质的研究
1.6.1 酶的最适反应温度及热稳定性研究 选取4,15,25,35,45,55,65 ℃7个反应温度,测定酶活,考察不同反应温度对酶活性的影响。根据温度对酶活力的影响选取4,15,25,35,45 ℃5个温度,保温,每隔15 min测一次酶活,考察酶的热稳定性。
1.6.2 酶的最适pH 及pH 稳定性研究 选取pH 5.0,5.5,6.0,6.5,7.0,7.5,8.0,8.5,9.0,在各个pH 条件下测定酶活,考察pH 对 酶活性影 响。在25 ℃、pH 5.0,5.5,6.0,6.5,7.0,7.5,8.0,8.5,9.0维持24h,测定酶活,考察pH 的稳定性。
1.劳动力资源短缺。“平成景气” 使得日本经济对劳动力的供需矛盾进一步凸显,日本在1988年的有效求人倍率开始大于1,并不断增加。1989年,日本制造业劳动力的供需矛盾在质与量上均呈现供给不足,技术人才短缺成为主要矛盾。根据《日本工业新闻》的一项调查统计:日本电气电子行业、信息通信行业、机械制造行业的技术人员严重短缺。被调查的企业中,超过50%的机械制造行业表示技术人员严重不足;汽车制造、船舶制造和建筑行业表示技术人员缺乏的比例为54%;69%的基础材料企业表示五年后将出现严重的技术人才短缺。
1.6.3 金属离子对酶活性的影响 选取Na+、Mg2+、K+、Ca2+、Cu2+、Al3+、Zn2+7 种 金 属 离 子,离 子 浓 度 均 为5mmol/L,考察这7种金属离子对酶活性的影响。
1.6.4 酶反应动力学的研究 以不同浓度的ONPG 为底物,以Tris-HCl为缓冲液(pH 7.1),在25 ℃测不同浓度底物的反应速率。以底物浓度的倒数1/[S]为横坐标,以反应速率的倒数1/V 为纵坐标,作图,得到Km、Vmax的值。
2 结果与分析
2.1 盐析
硫酸铵分级沉淀结果见图1。由图1可知,在20%饱和度时,上清液中的酶活力很高,在硫酸铵饱和度40%以上时,上清液中的酶活很弱。综合考虑酶的纯化倍数和回收率,选择20%~40%饱和度进行硫酸铵分级沉淀,将得到的沉淀用20mmol的Tris-HCl缓冲液(pH 7.5)重溶。
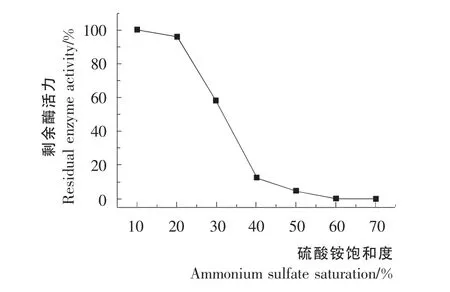
图1 盐析曲线Figure1 Salting-out curve
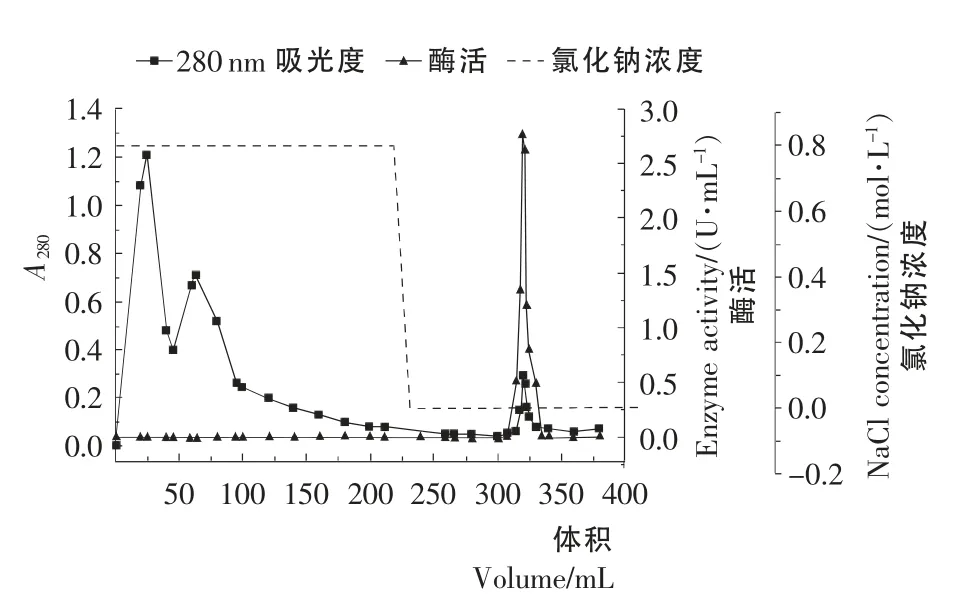
图2 Phenyl Sepharose CL-4B疏水层析Figure2 Phenyl Sepharose CL-4Bhydrophobic interaction chromatography
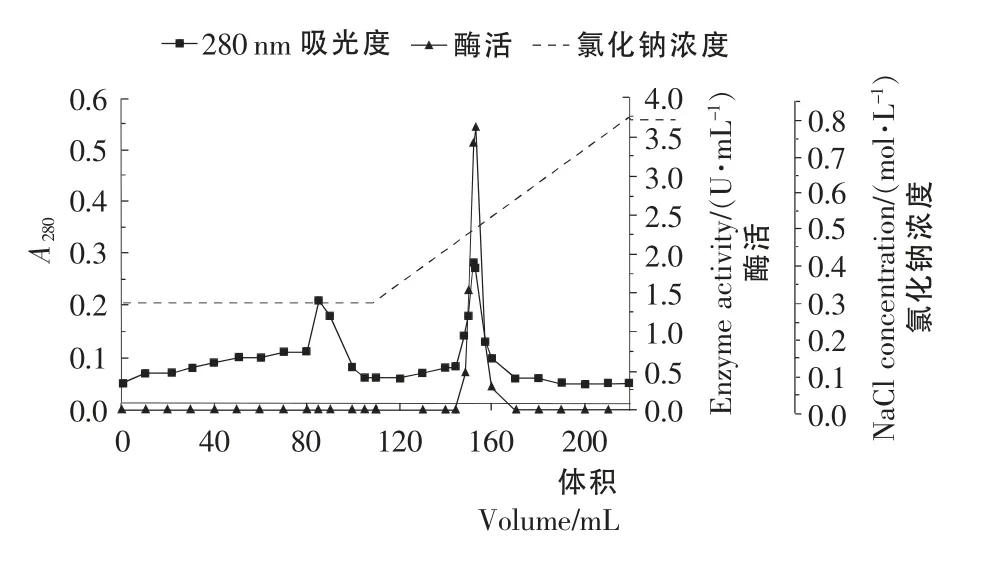
图3 Q Sepharose High Performance阴离子交换层析Figure3 Q Sepharose High Performance anion exchange chromatography
2.2 Phenyl Sepharose CL-4B疏水层析的结果
Phenyl Sepharose CL-4B洗脱曲线见图2。由图2可知,分离得到3个较大的蛋白峰,收集后酶活性检测到第3个蛋白峰有酶活性,酶活峰与蛋白峰重合。酶活出峰位置出现在低盐洗脱阶段,说明目标蛋白疏水性较强。从洗脱曲线来看,疏水层析效率较高,除去了大量的杂蛋白。
2.3 Q Sepharose High Performance阴离子交换层析
Q Sepharose High Performance阴离子交换层析洗脱曲线见图3。由图3可知,图中出现2个峰,收集后酶活性检测到第2个峰有酶活,根据线性洗脱曲线显示,第2个峰出峰位置出现在NaCl浓度为0.45~0.60mol/L处。酶活峰与蛋白峰重合,酶活峰比较集中,离子交换层析去除一部分杂蛋白。
2.4 Sephacryl S-200High Resolution凝胶过滤层析结果
Sephacryl S-2 0 0High Resolution凝 胶 过 滤 层 析 结 果见图4。由图4可知,凝胶过滤层析出现2个峰,经酶活性检测到第2个峰有酶活性,酶活曲线与蛋白曲线重合,酶活峰比较集中,凝胶过滤层析的纯化效率较高。
2.5 酶的纯化结果
由表1可知,经过4 步纯化最终得到纯化倍数为35.6的低温乳糖酶,得率为21.3%。
2.6 相对分子量的测定
纯化后的酶液,通过SDS-PAGE 分析,得到单一条带见图5。由图5可知,得到的低温乳糖酶已经达到电泳纯。SDS-PAGE通过凝胶成像分析软件Image lab 3.0计算得表观分子量为57.3kDa。
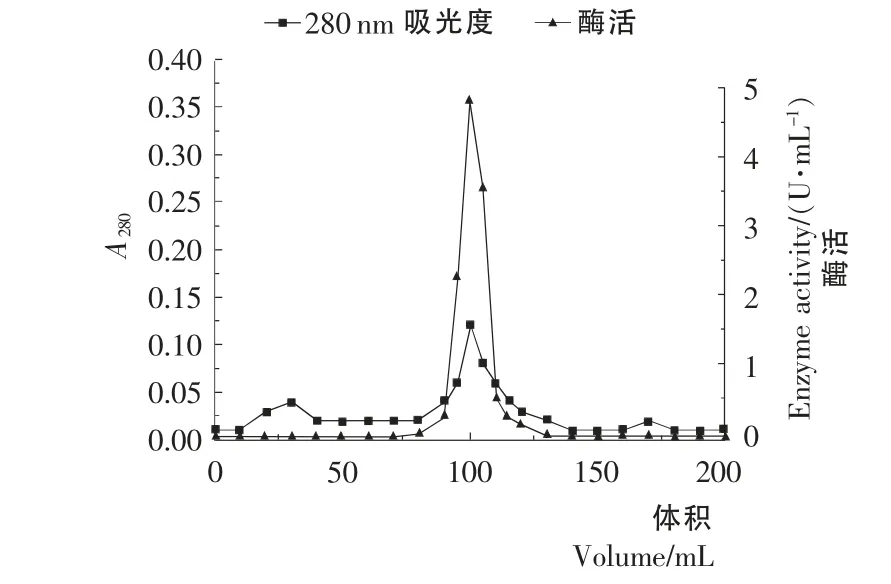
图4 Sephacryl S-200High Resolution凝胶过滤层析Figure4 Sephacryl S-200High Resolution gel filtration chromatography
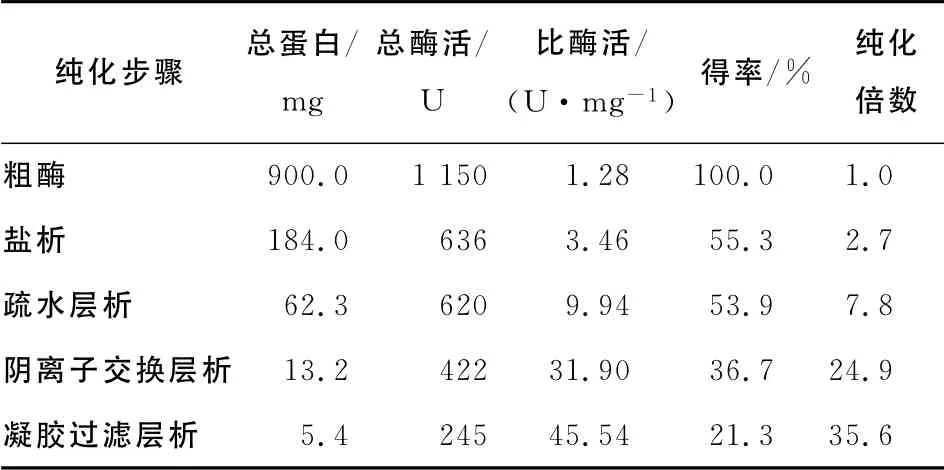
表1 Rahnella sp.R3的低温β-半乳糖苷酶分离纯化Table1 The purification of a new cold-adapted lactase fromRahnella sp.R3
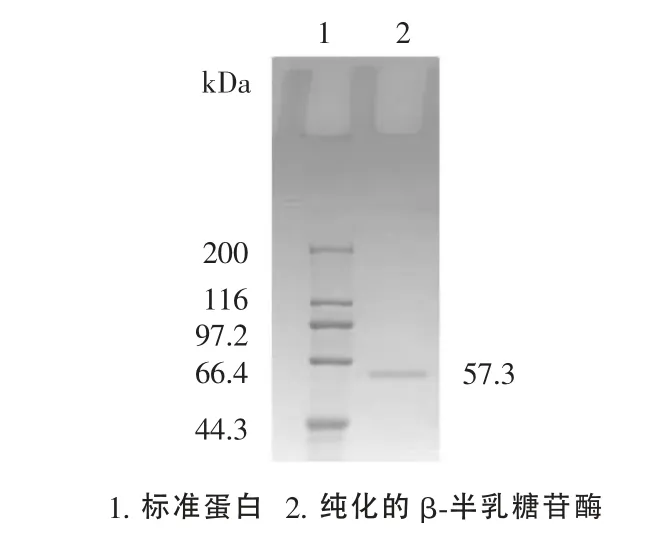
图5 纯化的低温β-半乳糖苷酶SDS-PAGE图Figure5 SDS-PAGE pattern of purifiedβ-galactosidase
2.7 低温乳糖酶酶学性质
2.7.1 酶的最适反应温度及热稳定性 在pH 7.5条件下,4~65 ℃测定酶活力与温度的关系。由图6可知,作用温度为45 ℃时该酶具有最高酶活,故确定该酶的最适作用温度为45℃;15℃下的酶活为最高酶活的40%,4℃下是最高酶活的23%。由图7可知,该酶对热敏感,45℃保温45min酶活几乎全部丧失。在4,15,25 ℃温度下保温90min,酶活保留率均在90%以上,说明该酶在4,15,25 ℃温度下稳定性较好。
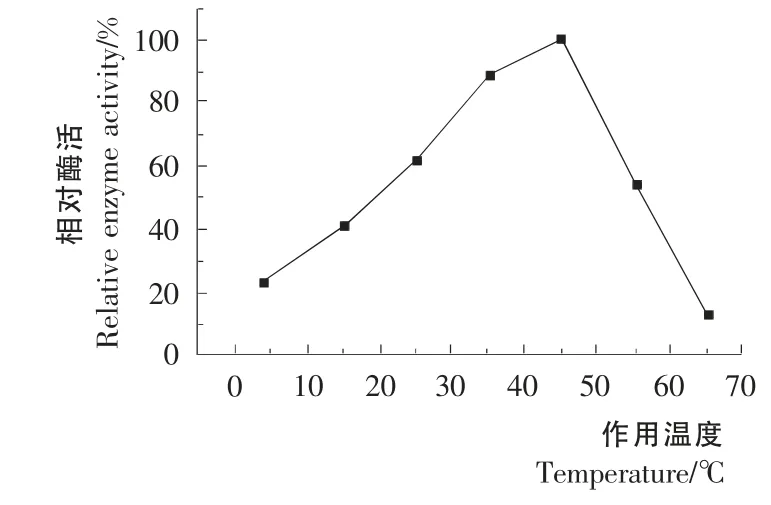
图6 温度对酶活性的影响Figure6 Effect of temperature on enzyme activity
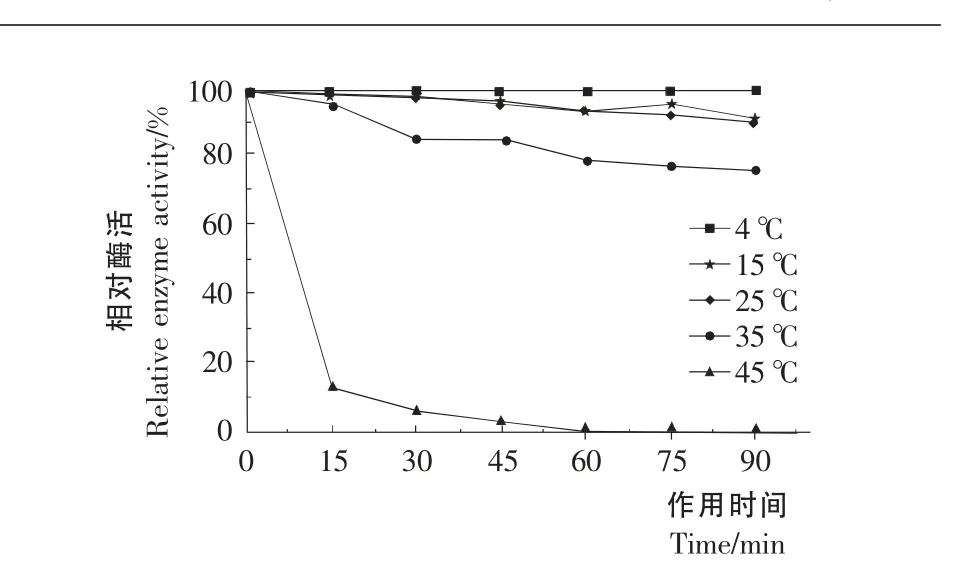
图7 温度对酶稳定性的影响Figure7 Effect of temperature on the stability of enzyme
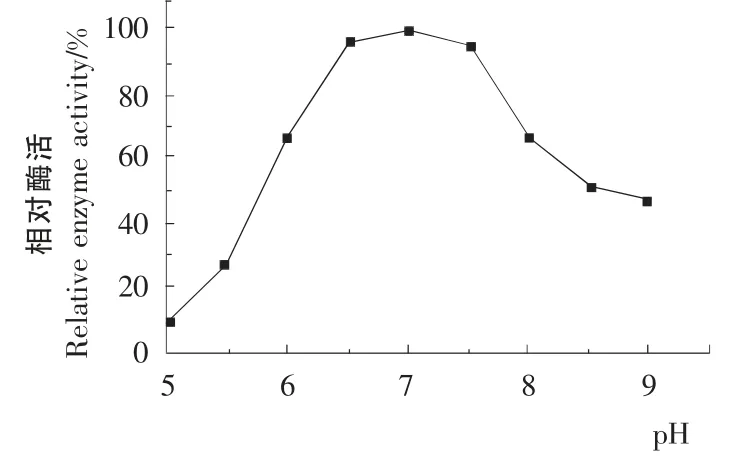
图8 pH 对酶活性的影响Figure8 Effect of pH on enzyme activity
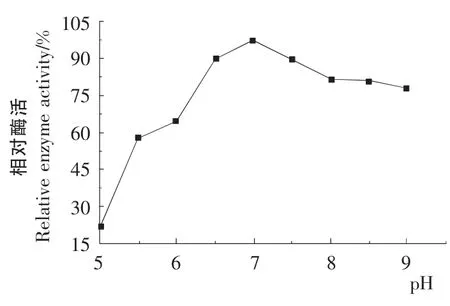
图9 pH 对酶稳定性的影响Figure9 Effect of pH on the stability of enzyme
2.7.2 酶的最适pH 及pH 的稳定性 由图8可知,该酶在pH 6.5~7.5时酶的活性较高,该酶的最适pH 为7.0。由图9可知,在25 ℃、pH 6.5~7.5维持24h,酶活保持86%以上,即在pH 6.5~7.5时该酶具有较高的稳定性。
2.7.3 金属离子对酶活力的影响 由图10可知,5mmol/L Na+、Ca2+、Cu2+、Al3+、Zn2+对酶活力有不同程度的抑制作用,其中Al3+抑制作用最强,Na+、Ca2+抑制作用不明显。5mmol/L Mg2+、K+对酶活力具有促进作用,其中Mg2+促进作用较强,使其酶活提高到1.19倍。
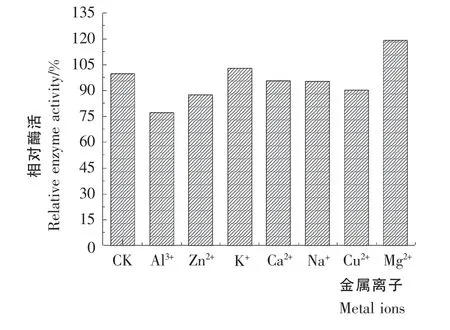
图10 金属离子对酶活性的影响Figure10 Effect of metal ions on enzyme activity
2.7.4 动力学Km值及Vmax的测定 以不同浓度的ONPG为底物,以Tris-HCl为缓冲液(pH 7.1),在25 ℃测不同浓度底物时的反应速率。以底物浓度的倒数1/[S]为横坐标,以反应速率的倒数1/V 为纵坐标作图见图11,计算得Km值为4.64mmol/L,Vmax为7.19mol/(min·mL)。
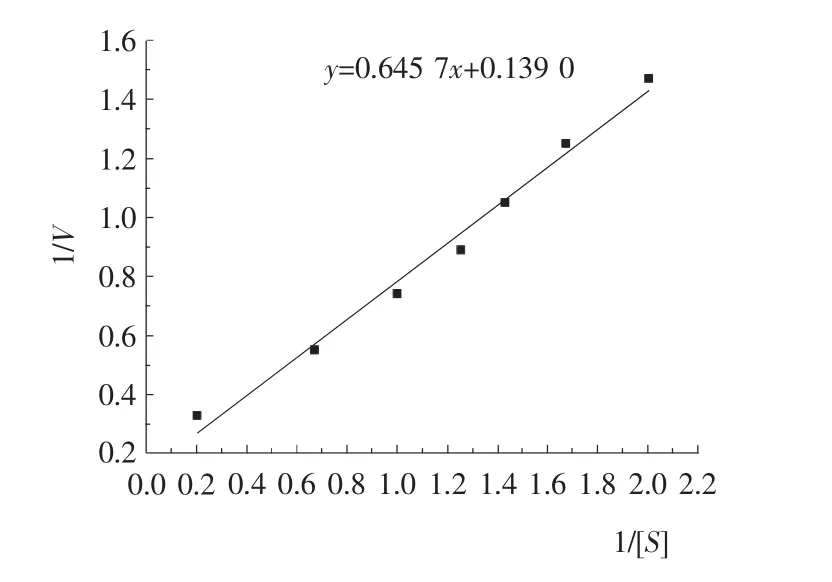
图11 纯化的低温β-半乳糖苷酶的Lineweaver-Burk 图Figure11 Lineweaver-Burk pattern of purified β-galactosidase
3 结论
产低温乳糖酶的耐冷菌Rahnella sp.R3是从天山冻土中筛选得到的一株野生菌,且所产的胞内低温乳糖酶的酶量很低,通过四步纯化步骤纯化得到低温乳糖酶。低温酶在高温下很难保持酶活,整个纯化过程均在4 ℃层析柜中进行,最终得到纯化倍数35.6%,产率21.3%。通过SDS-PAGE电泳分析,显示为单带,表观分子量为57.3kDa。对酶学性质的研究表明,该酶酶活在pH 6.5~7.5范围内保持稳定,且Ca2+对于酶活的抑制作用不明显,这为该酶在乳制品中应用提供了条件。然而野生菌中酶产量较低,可通过构建工程菌手段来提高产量。而该酶的基因序列未知,需通过纯化得到纯酶后进行氨基酸序列测定,利用氨基酸序列设计引物,再结合分子手段可以得到编码该酶的基因序列,为后期分子工作的开展和低温乳糖酶的大规模生产提供了条件。
目前,国内外研究的大多数低温β-半乳糖苷酶产生菌为节杆菌(arthrobacter)[10,11]和交替假单胞菌(Pseudoalteromonas)[12-14]。本研究中产低温乳糖酶的耐冷菌Rahnella sp.R3属于拉恩氏属[15],纯化所得到的酶与新疆石河子大学从新疆低温环境分离筛选到的低温乳糖酶产生菌Rahneua aquatilis sp.14.1[16]进 行 比 较,发 现 该 酶 的 纯 化 倍 数为35.6,明显高于其纯化倍数4.19,取得了更好的纯化效果。SDS-PAGE电泳结果显示表观分子量为57.3kDa,不同于其表观分子量60kDa。在酶学性质方面,该酶最适反应温度为45 ℃,45 ℃保温45 min酶活全部丧失,纯酶最适反应pH 值为6.5~7.5,Rahneua aquatilis sp.14.1所产的低温乳糖酶,酶的最适反应温度为35 ℃,45 ℃保温2h,酶完全失去活力,最适反应pH 值为6.5~7.0均有所不同。
1 卢丽丽,肖敏,徐晓东.转糖基β-半乳糖苷酶产生菌Enterobacter agglomerans B1:筛选鉴定发酵产酶及其合成低聚半乳糖的研究[J].微生物学报,2008,48(1):38~44.
2 徐金龙,玄明,曹宇婷.乳糖酶研究进展[J].养殖技术顾问,2011(10):50.
3 马夫霞.低乳糖牛奶的工艺参数研究[J].食品工业科技,2002,19(3):50.
4 王晓哲,钱方,曹迪,等.乳糖酶水解生产低乳糖牛乳工艺的优化[J].食品与机械,2013,29(2):182~185.
5 张敏文,顾取良,张博.乳糖酶研究进展[J].微生物学杂志,2011,31(3):81~85.
6 P Nicholas.Beta-galactosidase activity in psychrotrophic mictroorganisms and their potential use in food industry[J].Czech Food Sci.,2002,20(2):43~47.
7 王辉,低乳糖牛奶生产工艺参数的研究[J].中国乳品工业,2006,34(1):52~53.
8 夏雨,成玉梁,赵莹,等.欧文氏菌乳糖酶的分离纯化及其酶学性质研究[J].食品与机械,2011,27(5):75~77.
9 Charles Gerday,Mohamed Aittaleb.Cold-adapted enzymes:from fundamentals to biotechnology[J].Tibtech March,2000,18(3):103~107.
10 Nakagawa T,Fujimoto Y.Isolation and characterization of psychrophile producing cold -active-galactosidase[J].Letters in Applied Microbiology,2003(37):154~157.
11 James A Coker.Biochemical characterization of aβ-galactosidase with a low temperature optimum obtained from an Antarctic Arthrobacter isolate[J].Journal of Bacterology,2003,185(18):5 473~5 482.
12 A Hoyoux.Cold-adaptedβ-galactosidase from the antarctic psychrophile pseudoalteromonas haloplanktis[J].Appl Microbio Biotechnol,2001,67(4):1 529~1 535.
13 S Fermandes.β-Galactosidase from a cold adapted bacterium:purification,characterization and application for lactase hydrolysis[J].Appl Microbial Biotechnol,2002(58):313~321.
14 Turkiewica.Antarctic marine bacterium Pseudoalteromonas sp.22bas a source of cold-adaptedβ-Galactosidase[J].Biomolecular Engineering,2003,20(4~6):317~324.
15 沈莲莲,杨瑞金,华霄.产低温乳糖酶菌株的筛选、鉴定及酶学性质的研究[J].工业微生物,2013,43(3):12~16.
16 Liu Wen-yu,Shi Ying-wu.Isolation and identification of a strain producing cold-adaptedβ-galactosidase,and purification and characterisation of the enzyme[J].Czech J.Food Sci.,2008,26(4):284~290.
17 Bradford Min.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye biding[J].Analytical Biochemisty,1976,72(1~2):248~254.
18 Laemmliuk.Cleavage of structural proteins during the assembly of bacteriphoge T4[J].Nature,1970(227):680~685.
——壳聚糖固定化乳糖酶条件的优化
- 食品与机械的其它文章
- 60 Co-γ辐照对安化黑茶“千两茶”品质与功能成分的影响

