β钛合金微弧氧化膜制备及其在人体模拟液中腐蚀性能研究
金 磊,崔文芳,宋 秀,周 廉,2
(1.东北大学 材料织构与各向异性教育部重点实验室,沈阳 110819;2.西北有色金属研究院,西安 710016)
β钛合金微弧氧化膜制备及其在人体模拟液中腐蚀性能研究
金 磊1,崔文芳1,宋 秀1,周 廉1,2
(1.东北大学 材料织构与各向异性教育部重点实验室,沈阳 110819;2.西北有色金属研究院,西安 710016)
采用微弧氧化技术在TiNbZrFe合金表面制备出含钙磷成分的多孔氧化膜,通过人体模拟液浸泡的方法诱导生成羟基磷灰石,并利用电化学阻抗谱 (EIS)研究其在人体模拟液中浸泡不同时间后的耐腐蚀性能.结果表明,经400 V电压微弧氧化后TiNbZrFe合金表面氧化膜的形貌与成分达到最优化,且明显有α-Ca3(PO4)2相生成;α-Ca3(PO4)2相能够起到良好的诱导生成羟基磷灰石 (HA)的作用,在人体模拟液中浸泡1 d后,通过XRD检测出有HA相生成,导致微弧氧化膜层表面的微孔被诱导生成物覆盖填充明显,较小微孔完全消失;随着浸泡时间的延长,经过微弧氧化膜诱导生成的HA涂层不断增厚,EIS结果表明其具有良好的隔绝渗透作用,能够阻碍腐蚀性介质在溶液和金属界面之间扩散和迁移,从而起到保护基体抗腐蚀的作用.
微弧氧化;人体模拟液;腐蚀性能;α-Ca3(PO4)2;羟基磷灰石(HA);交流阻抗
β型钛合金因其良好的机械性能、较低的弹性模量,成为目前生物医用金属植入材料的研究热点[1,2].尽管,钛合金较其他植入金属有良好的生物相容性,但其仍属生物惰性材料,植入物与新生骨之间只能接触生长,不能直接与人体骨组织形成化学键合,生物活性仍然不够理想.如何进一步改善钛合金β型钛合金的生物相容性,是目前医用材料领域的前瞻性课题.
已有研究表明,羟基磷灰石(HA)的化学成分与生物骨组织中的磷酸钙无机物相似[3],能与骨组织形成较强的化学连接,大大缩短了骨愈合时间,从而被认为是目前生物相容性最好的生物陶瓷之一.目前,钛合金表面制备HA涂层技术得到广泛发展,主要方法有等离子喷涂法、电化学沉积法、溶胶-凝胶法等[4~6].然而,这些方法仍存在涂层与基体结合力不高、易脱落等问题,如何制备结合强度高、多孔和被覆性好的生物活性改性层成为目前的迫切任务.微弧氧化技术(MAO)是一种在植入体表面制备生物活性涂层的新型技术,通过此种技术制备的氧化膜内膜层致密紧凑,与基材冶金结合强度高;多孔的外膜层弹性模量远低于未处理的钛合金表面,且能通过控制微弧氧化参数适当控制外膜层相含量和相组成[7~10],有助于生物相容性和组织生长.然而,在复杂的人体环境中,植入件不仅要具有良好的相容性,还要受到长期的腐蚀作用,β型钛合金表面微弧氧化涂层在人体模拟液下耐蚀性能亟待进一步研究.
本研究以亚稳定β型钛合金Ti-30Nb-8Zr-0.8Fe(简称TNZF)为研究对象,通过控制微弧氧化参数在该合金表面制备多孔的氧化膜层,经长时间人体模拟液的浸泡后,观察微弧氧化膜表面形貌和物相的变化,研究HA的生长情况.并利用EIS电化学交流阻抗谱对微弧氧化膜层在浸泡过程中的腐蚀电化学行为进行分析与研究.
1 实验材料和方法
本文采用的亚稳定β型钛合金名义成分(质量分数/%)为 Ti-30Nb-8Zr-0.8Fe(简称TNZF),预处理为表面研磨至2 000#砂纸后,在丙酮,酒精,去离子水中依次清洗完毕待用.采用脉冲直流电源进行MAO处理,电解液选用醋酸钙((CH3COO)2Ca·H2O,0.2 mol/L),磷酸二氢钠(NaH2PO4·2H2O,0.12 mol/L)和 氢 氧 化 钠(NaOH,0.15 mol/L),pH值控制在12左右.微弧氧化实验参数:电压300、350、400、450 V、频率600 Hz、占空比20%、时间10 min.
模拟人体环境的试验采用改进模拟人体液[11,12],用三羟甲基氨基甲烷(CH2OH)3CNH2和1 mol/L盐酸调节溶液的pH值在7.4左右,温度控制在(37±1)℃.将浸泡不同时间(10 h、1 d、3 d、7 d、14 d、21 d)后的微弧氧化试样取出,用去离子水洗净吹干,与未浸泡试样一起进行表面形貌观察和物相分析.
表面形貌观察采用SSX-550扫描电子显微镜,分辨率为3.5 nm.物相分析采用日本理学D/Max-YX-射线衍射仪,采用Cu-Kα靶辐射,测量衍射角2θ为10(°)~80(°)的X-射线衍射谱,测量速率为3(°)/min.
EIS测量在德国Zahner公司Zennium电化学工作站上进行.采用三电极体系,工作电极为待测试样,暴露面积为1 cm2,参比电极为饱和甘汞电极(SCE),以铂电极作为辅助电极.在室温条件下,在改进人体模拟液中进行EIS测试,正弦信号扰动电压幅值 10 mV,扫描频率范围 105~10-2Hz.
2 结果与讨论
2.1 TNZF合金微弧氧化膜的表征
图1为不同电压下TNZF微弧氧化后膜层的表面形貌.可见,在300~400 V的范围内,随着微弧氧化电压的增大,表面微孔的尺寸逐渐增大,400 V时微孔尺寸大约为5~8 μm.当电压达到450 V时,微孔尺寸与400 V时相比变化不大,但形貌有很大变化,且出现较多微裂纹,这在一定程度上影响了膜层的性能[13].
图2为TNZF经不同电压微弧氧化后膜层的XRD衍射谱,可见,钛合金经微弧氧化后,其表面氧化膜主要由金红石型和锐钛矿型TiO2以及非晶相组成,其中以金红石型TiO2所占比例较大.随着微弧氧化电压的增大,锐钛矿峰的衍射强度逐渐降低,而金红石衍射峰强度变化不大.当微弧氧化电压达到350V时,在30.7(°)出现新相的衍射峰,此衍射峰经标定确定为α-Ca3(PO4)2(即α-TCP),并且随着电压的升高,α-Ca3(PO4)2相的含量不断增加.α-TCP相的生成,预示着合金在人体模拟液下诱导生成羟基磷灰石的可能性增大.然而随着电压的进一步升高,当电压为450 V时,由于电压过大,微弧氧化过程由微弧放电阶段转变为对膜层破坏较大的弧放电阶段[14],表现在试样表面出现较多数量的微裂纹,且微孔尺寸非常不均匀.由此可知,合金经400 V微弧氧化后,氧化膜的形貌与成分达到最优化,且生成的α-Ca3(PO4)2相含量较多,所以在后续的模拟人体液浸泡实验中,以400 V电压下的微弧氧化试样作为基材.
2.2 TNZF合金微弧氧化膜在人体模拟液中HA诱导行为
图3为未浸泡和在人体模拟液中浸泡不同时间的微弧氧化试样XRD衍射谱.在浸泡1 d后XRD衍射谱图上出现新的衍射峰,分析认为是诱导形成的HA(Ca10(OH)2(PO4)6),随着浸泡天数的增加,此位置衍射峰的强度逐渐增强,并在其他位置出现了新的衍射峰,经过标定分析均为羟基磷灰石.同时在XRD衍射谱中,金红石型和锐钛矿型TiO2衍射峰强度明显减弱,浸泡21 d时金红石型TiO2衍射峰仍能观察到,锐钛矿型TiO2的衍射峰已经完全消失.这说明微弧氧化膜层厚度在不断增加,逐渐被诱导生成的HA覆盖.这是由于经微弧氧化后生成的α-Ca3(PO4)2,能够在短时间内诱导形成HA,生物相容性更好,浸泡7 d时从扫描照片和XRD衍射谱上可以认定表面已经完全被HA覆盖.
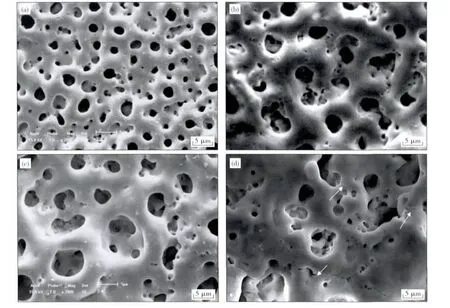
图1 不同电压下微弧氧化表面形貌Fig.1 Surface morphologies of MAO coatings under different voltage(a)—300 V;(b)—350 V;(c)—400 V;(d)—450 V
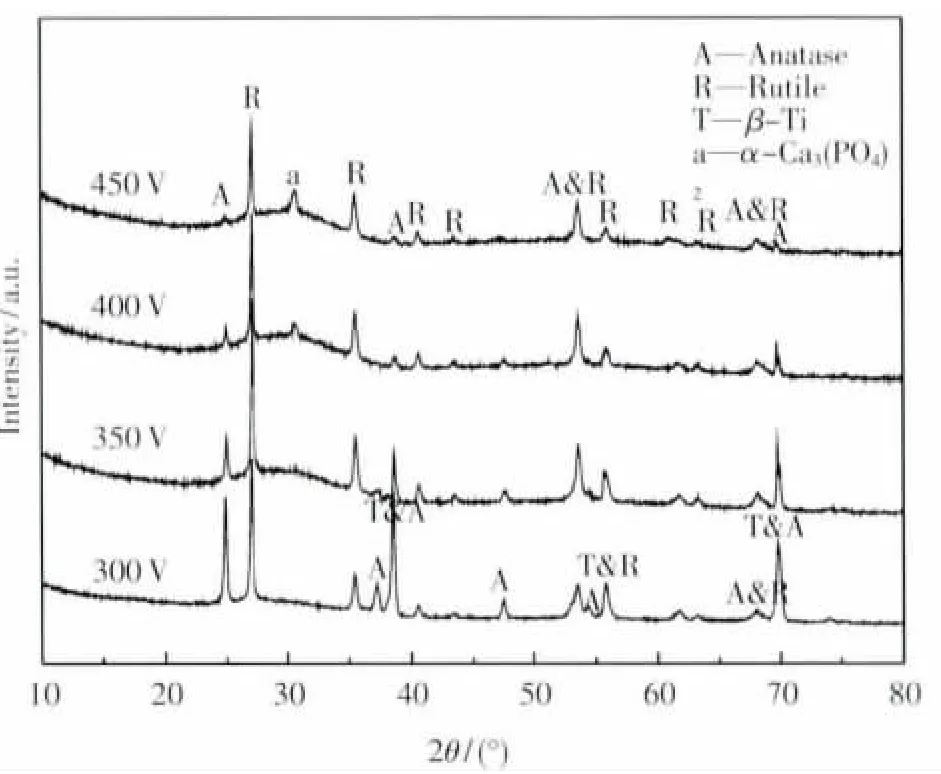
图2 不同电压下微弧氧化膜XRD衍射谱Fig.2 XRD patterns of MAO coatings of the sample under different voltage
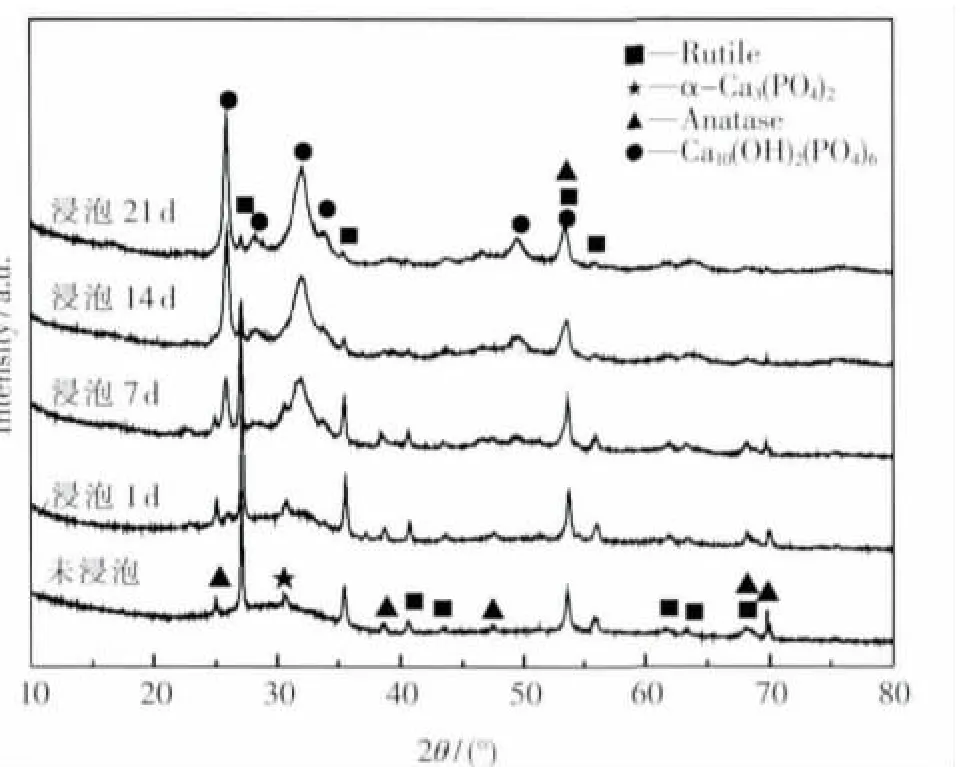
图3 微弧氧化试样在人体模拟液中浸泡若干时间后的XRD衍射谱Fig.3 XRD patterns of MAO coatings immerged in SBF for some time
图4(a)至4(f)分别为微弧氧化试样在人体模拟液中浸泡10 h,1 d,3 d,7 d,14 d,21 d后的表面形貌.从图4(a)微弧氧化层的箭头处可以观察到,浸泡10 h后,表面形貌有轻微变化,孔洞周围区域已不再光亮圆滑,而是凹凸不齐,表明在此处沉积了少量的新物质.浸泡1 d后,从图(b)可以观察到微弧氧化试样表面多孔层发生了很大变化,较大些的微孔被沉积物填充变浅,内径变小;细微孔几乎被完全覆盖,轮廓模糊,表面诱导的新物质层已经形成但还很薄.浸泡3d后,微弧氧化膜层的形貌已经完全被覆盖.随着浸泡时间的进一步延长,7 d、14 d直至21 d的表面形貌差别不大,表现为诱导生成的活性涂层逐渐变厚;活性涂层具有陶瓷的性质,随着膜层的加厚,脆性增大,由于应力的作用使表面的裂纹越来越深.图4 (g)、(h)分别为浸泡1 d和21 d表面形貌的局部放大照片,浸泡1 d时表层覆盖的HA为纤维网格型结构,空隙率较大;而随着浸泡时间的延长,表层微观结构为细小的片层网格结构,其空隙率明显减小,致密性有较大提高.

图4 微弧氧化试样在人体模拟液中浸泡若干时间后表面形貌Fig.4 Surface morphologies of MAO coatings immerged in SBF for some time(a)—10 h;(b)—1 d;(c)—3 d;(d)—7 d;(e)—14 d;(f)—21 d;(g)(h)—Amplification figure
已有研究表明,微弧氧化膜浸入到模拟体液中7 d后,表面才有多颗粒状磷灰石生成[15]; Han等研究亦表明浸入到模拟体液中40 d,试样表面的微孔中开始覆盖一些矿质的磷灰石[16].而在本研究中,通过调整微弧氧化参数,在400 V微弧电压下,TNZF合金微弧氧化膜在人体模拟液中浸泡1 d后,微弧氧化膜已经出现明显的HA衍射峰,证明HA相已生成,而经7 d后微弧氧化多孔表面已被新生成HA层完全覆盖.这是因为在本研究微弧氧化实验参数下,微弧氧化膜Ca、P摩尔比为1.61,与人体骨成分Ca、P摩尔比1.67非常相近,且Ca、P元素在膜层表面形成非晶和少量高温磷酸钙相 α-Ca3(PO4)2,且 α-Ca3(PO4)2在水溶液中可自固化成具有贯穿式微孔结构和一定强度的缺钙型HA,可以制备α-Ca3(PO4)2骨水泥;α-Ca3(PO4)2骨水泥降解物具有诱导成骨的作用,不仅表现为诱导骨髓基质细胞成骨化,还表现在降解物易形成类骨磷灰石上,所以其具有良好的引导和诱导成骨的特性[17~19],未水合的高温磷酸钙相在37℃与模拟人体液反应将形成稳定的HA,从而有利于HA在短时间内形成.在人体模拟液中,试样表面的Ca3(PO4)2发生如下反应,能够增加Ca3(PO4)2的溶解和HA的形成:
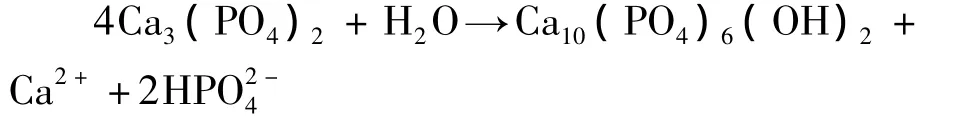
2.3 TNZF合金微弧氧化膜人体模拟液中的腐蚀性能
图5给出了400 V微弧氧化试样在模拟人体液中开路电位下EIS的Bode图和Nyqusit图.其中图5(a)为阻抗图谱,图5(b)为相角图谱.研究表明[20]阻抗图谱中低频区阻抗可以用来评估膜层的防护作用,其数值可以用来评价整个体系的耐蚀性能,反映腐蚀介质在膜层孔隙中扩散的难易程度,阻抗值越高,腐蚀介质在膜层孔隙中扩散的难度越大,表明膜层的孔隙越小或腐蚀介质扩散至基体金属表面的路径越长,能更有效地抑制基体金属腐蚀的发生和发展.
如图5(a)所示,随着试样在模拟液中浸泡时间的增加,其低频阻抗值不断提高,浸泡1 d和未浸泡相比提高幅度不是很明显,浸泡14 d和21 d与短时间浸泡试样相比有较大程度的提高,大约有半个数量级;可见在人体模拟液中浸泡后,膜层表面不断诱导出HA,使得微弧氧化试样表面的微孔不断被覆盖、填充,且致密性和耐渗透性良好.
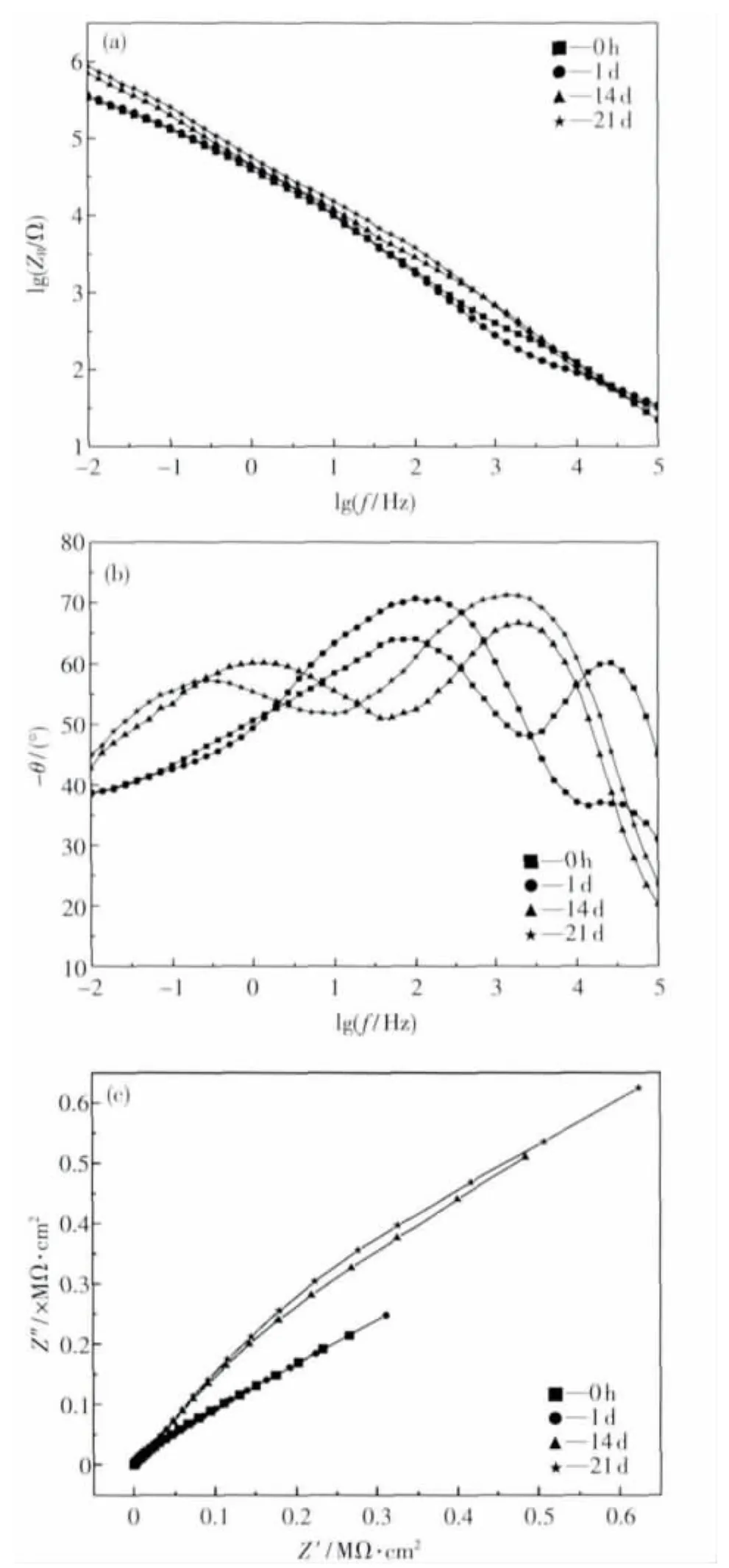
图5 微弧氧化试样在人体模拟液中浸泡不同时间后电化学阻抗谱Fig.5 EIS of MAO coatings immerged in SBF for some time(a)—Bode-阻抗图;(b)—Bode-相角图;(c)—Nyqusit图
由图5(b)可观察到浸泡不同时间试样均有两个时间常数,但代表的意义有很大差别.浸泡0 h试样的两个时间常数中,高频区时间常数与膜层本身相关,代表微弧氧化后形成的疏松多孔层,另一个出现在中频区域,可以将其归因于由微弧氧化内部相对致密的氧化层引起的弛豫时间.浸泡1 d后由于表面沉积一层较薄的HA层,对模拟液的扩散隔绝作用很弱,所以在高频区的时间常数表现为相角值在较窄的高频率范围内数值很低,中频区相角与微弧氧化基材相比有所提高,说明在浸泡过程中,沉积的HA已经逐渐填满疏松多孔区,其致密性可在阻抗谱测量时间内起到弛豫作用,有效地将β钛合金基体和腐蚀介质阻隔开,从而对基体起到良好的保护作用.随着浸泡时间的延长,14 d和21 d试样相角图谱相似,高频相位角数值逐渐升高,同时幅宽增大,说明沉积生成的HA膜层在不断增厚,表明膜层的保护作用逐渐增强,可以起到很好的渗透隔绝作用.
图5(c)为交流阻抗谱的Nyquist图,圆弧曲线反映的是电极表面电荷转移过程,圆弧直径越大,阻碍作用也就越大.既然电子转移阻力大,意味着电子得失就不容易发生,对金属而言,电子得失不容易发生,就意味着金属不容易溶解,也即抑制了金属的腐蚀.
3 结论
(1)TNZF合金经400 V电压微弧氧化后,其表面钙磷涂层形貌与成分最优化,与450 V微弧氧化膜相比,其微孔尺寸分布均匀,无微裂纹产生;与 350 V微弧氧化膜层相比,膜层中α-Ca3(PO4)2的含量更高.
(2)TNZF合金微弧氧化膜中含有少量的α-Ca3(PO4)2相,能够起到良好的诱导生成羟基磷灰石(HA)的作用,在人体模拟液浸泡1天后合金氧化膜表面已基本被HA覆盖.
(3)TNZF合金在人体模拟液中的EIS结果表明,经过微弧氧化膜诱导生成的HA涂层具有良好的隔绝渗透作用,能够阻碍腐蚀性介质在溶液和金属界面之间的扩散和迁移,对基体起到良好的保护作用.
[1]Vannoort R.Review Titanium:the implant material of today[J].J Mater Sci,1987,22:3801-3811.
[2]余耀庭,张兴栋.生物医用材料[M].天津:天津大学出版社,2000:12-14.
(Yu Y T,Zhang X D.Biomedical materials[M].Tianjin: Tianjin University Press,2000:12-14.)
[3]Schreckenbach J P, Marx G, Scgkittig F, et al.Characterization of anodic apark-converted titanium surfaces for biomedical applications[J].J Mater Sci Mater Med,1999,10:453-457.
[4]Wu G M,HsiaoW D,KungSF.Investigationof hydroxyapatite coated polyether ether ketone composites by gas plasma sprays[J].Surf Coat Technol,2009,203:2755-2758.
[5]Huang J C,Ni Y J,Wang Z C.Preparation of hydroxyapatite functionally gradient coating on titanium substrate using a combination of electrophoretic deposition and reaction bonding process[J].Surf Coat Technol,2010,204:3387-3392.
[6]Harle J,Kim H W,Mordan N,et al.Initial responses of human osteoblasts to sol- gelmodified titanium with hydroxyapatite and titania composition[J].Acta Biomater,2006,2:547-556.
[7]Huang P,Wang F,Xu K W,et al.Mechanical properties of titania prepared by plasma electrolytic oxidation at different voltages[J].Surf Coat Technol,2007,201:5168-5171.
[8]Shi X L,Xu L L,Wang Q L.Porous TiO2film prepared by micro-arc oxidation and its electrochemical behaviors in Hank's solution[J].Surf Coat Technol,2010,205:1730-1735.
[9]Song W H,Jun Y K,Han Y,et al.Biomimetic apatite coatings on micro-arc oxidized titania[J].Biomaterials,2004,25:3341-3349.
[10]Yao Z Q,Ivanisenko Y,Diemant T,et al.Synthesis and properties of hydroxyapatite-containing porous titania coating on ultrafine-grained titanium by micro-arc oxidation[J].Acta Biomater,2010,6(7):2816-2825.
[11]Kokubo T,Takadama H.How useful is SBF in predicting in vivo bone bioactivity[J].Biomaterials,2006,27:2907-2915.
[12]Oyane A,Kim H M,Furuya T,et al.Preparation and assessment of revised simulated body fluids[J].J Biomed Mater Res A,2003,A 65:188-195.
[13]王庆良,葛世荣,史兴岭.钛合金微弧氧化陶瓷层的结构研究[J].中国矿业大学学报,2008,37(4):462-466.
(Wang Q L,Ge S R,Shi X L.Structure and property of microarc oxidation ceramic layer on titanium alloy[J].Journal of China University of Mining&Technology,2008,37(4): 462-466.)
[14]李利群,袭建军,姚英学.钛合金微弧氧化技术的研究[J].焊接专题综述-Feature Article,2008,5:15-18.
(Li L Q,Xi J J,Yao Y X.Titanium alloy micro-aro oxidation technology research[J].Welding Project Review-Frticle,2008,5:15-18.)
[15]YuS,Yu Z T,WangG,etal.Preparation and osteoinduction of active micro-arc oxidation films on Ti-3Zr-2Sn-3Mo-25Nb alloy[J].T Nonferr Metal Soc,2011,21:573-580.
[16]Han Y,Hong S H,Xu K W.Structure and in vitro bioactivity of titania-based films by micro-arc oxidation[J].Surf Coat Technol,2003,168:249-258.
[17]王新荣,阮立坚.α-Ca3(PO4)2的晶相转变研究[J].硅酸盐学报,1992,20(2):117-121.
(Wang X R,Ruan L J.Study of the phase transformation in α-Ca3(PO4)2[J].Journal of the Chinese Ceramic Society,1992,20(2):117-121.)
[18]Prado da Silva M H,Lemos A F,Gibson I R,et al.Porous glass reinforced hydroxyapatite materials produced with different organic additives[J].J Non-Cryst Solids,2002,304:286-292.
[19]宋宏杰,梁星,骆筱秋,等.α-磷酸三钙骨水泥修复骨缺损及其降解物诱导成骨的实验研究[J].四川大学学报(医学版),2005,36(6):847-849.
(Song H J,Liang X,Luo Y Q,et al.Experimental study on the reconstruction of bone defects in vivo and the osteo induction with degradation productsofα - Tricalcium phosphate cements in vitro[J].J Sichuan Univ(Med Sci Edi),2005,36(6):847-849.)
[20]Montemor,M F,Trabelsi W,Zheludevich M,et al.Modification of bis-silane solutions with rare-earth cations for improved corrosion protection of galvanized steel substrates[J].Progress in Organic Coatings,2006,57(1):67-77.
Preparation of micro-arc oxidation film on β titanium alloy and its corrosion behavior in a simulated body fluid
Jin Lei1,Cui Wenfang1,Song Xiu1,Zhou Lian1,2
(1.Key Laboratory for Anisotropy and Texture of Materials(Ministry of Education),Northeastern University,Shenyang 110819,China; 2.Northwest Institute of Nonferrous Metals Research,Xi'an 710016,China)
Ca-P containing porous oxidation film was prepared on the surface of biomedical β-type TiNbZrFe alloy by micro-arc oxidation(MAO),and the hydroxyapatite stoichiometric(HA)was successfully induced through immerging the film in a simulated body fluid.The electrochemical impedance spectroscopy(EIS)was carried out to study the corrosion properties of the coated alloy immerged in SBF for different times.The results showed that the composition and the morphology of the oxide film on TiNbZrFe alloy was optimized at a MAO voltage of 400V.An α-Ca3(PO4)2phase formed in the film and this phase played an effective role to induce HA,which can be detected by XRD through immerging it for 1 day.A porous HA film covered on the alloy surface,and even the smaller pores entirely disappeared.The thickness of HA coatings increased with the immersing time,EIS results showed that the HA coatings have effective isolating effect,which can hinder diffusion and transmission migration of the corrosive medium through the interface between the corrosive solution and the metal,so that the substrate can be protected from corrosion.
micro-arc oxidation;simulated body fluid;corrosion behavior;α-Ca3(PO4)2;hydroxyapatite (HA);electrochemical impedance spectroscopy(EIS)
TG 146.2
A
1671-6620(2014)01-0040-06
2013-10-16.
中央高校基本科研业务费资助(N100702001,N120310001);国家博士后科学基金面上项目 (2012M510820);辽宁省博士启动基金项目 (20131036);国家自然科学基金青年科学基金项目 (51301037).
金磊 (1983—),男,东北大学博士生,E-mail:keshi4303@163.com.

