巴戟天对大鼠抗运动性疲劳能力及脑组织自由基的影响
崔笑梅,曹建民,周海涛
(1.兰州理工大学,甘肃 兰州 730050;2.北京体育大学,北京 100084;3.北京联合大学,北京 100023)
巴戟天对大鼠抗运动性疲劳能力及脑组织自由基的影响
崔笑梅1,曹建民2,周海涛3
(1.兰州理工大学,甘肃 兰州 730050;2.北京体育大学,北京 100084;3.北京联合大学,北京 100023)
目的 研究巴戟天对大鼠抗运动性疲劳能力及脑组织自由基的影响。方法 以大强度耐力训练大鼠为模型,将55只49 d龄雄性Wistar大鼠随机分为5组:静止对照组(C组),运动对照组(T组),运动ig低剂量巴戟天组(TML组),运动ig中剂量巴戟天组(TMM组),运动ig高剂量巴戟天组(TMH组),每组10只。采用专业灌胃器每天ig 1次。低、中、高剂量组ig剂量分别为4 g/(kg·d)、8 g/(kg·d)、12 g/(kg·d),ig量为5 ml/kg,C和T组ig等量生理盐水。4周力竭游泳训练。末次训练后24 h,测定体重、力竭游泳时间及脑组织中丙二醛(MDA)等相关指标。结果 TM各组体重大于T组(P<0.05),力竭游泳时间均长于T组(P<0.01),TM各组间无显著性差异。力竭游泳导致大鼠脑组织中MDA含量显著升高,运动对照组及TM各组分别升高至(6.06±0.24)umol/L、(4.77±0.26)umol/L、(4.89±0.19)umol/L、(5.09±0.33)umol/L、,但TM各组明显低于运动对照组(P<0.01);SOD,GSH-Px活性显著下降,运动对照组及TM各组SOD分别下降至(211.35±13.37),(255.85±10.31),(263.98± 10.24),(267.31±12.69)U/mL,GSH-Px分别下降至(55.72±5.23),(70.64±5.83),(71.96±4.96),(75.38±5.06)U/mg但TM各组明显高于运动对照组(P<0.01);TM各组间各项指标无显著性差异。结论 巴戟天能够提高脑组织抗氧化酶活性,从而抑制大强度力竭运动造成的脑组织氧化损伤,延缓疲劳。
巴戟天;大鼠;抗疲劳;脑组织;自由基
巴戟天(MORINDAE OFFlCINALIS RADIX,RMO)为双子叶植物茜草科(Rubiaceae)巴戟天(Morinda officinalis How.)的干燥根,味甘、微涩,性微温,是我国著名四大南药之一。始载于《神农本草经》,列为上品,其后历代本草均有记载。主要成分为巴戟天多糖、树脂,并含丰富的微量元素和维生素C等。巴戟天在中医药处方中应用广泛,是重要的中药材品种之一。现代医学研究证明,巴戟天具有补肾助阳,祛风除湿,强筋健骨,抗疲劳、增强免疫力等功效[1]。本文以大强度耐力训练大鼠为模型,研究巴戟天对大鼠抗运动性疲劳能力及脑组织自由基的影响,旨在为其临床应用提供理论依据。
1 材料
1.1 试验动物
清洁级55只雄性Wistar大鼠,49 d龄,平均体重(187.75± 12.85)g,由北京大学医学部实验动物科学部提供(合格证编号:SCXK(京)2006-000)8。在整个试验过程中,实验室内温度保持在(22±2)℃,相对湿度55%~75%,光照时间随自然变化。所有试验大鼠均以基础饲料(北京大学医学部实验动物科学部提供)和蒸馏水常规饲养,自由饮食。试验时间为35 d,正式训练时间为28 d。
1.2 试验用药
试验用巴戟天产自广东肇庆,购自北京同仁堂(批号:100156357),并经天津中瑞药业有限公司高占友高级工程师鉴定。称取巴戟天600 g加7倍水,浸泡90 min后煎30 min,将所得水煎液过滤,再将过滤出的巴戟天加4倍水煎30 min,将所得水煎液过滤。将两次过滤出的水煎液混合,浓缩到50 ml置于三角瓶内。最后将制备好的所有药液放入4℃冰箱冷冻保存,即为巴戟天煎剂(生药)12 g/ml。
1.3 试剂
测定丙二醛(MDA)采用比色法;测定超氧化物歧化酶(SOD)采用黄嘌呤氧化酶法;测定谷胱甘肽过氧化物酶(GSHPx)采用化学比色法。均采用南京建成生物工程研究所提供的试剂盒(试剂盒编号:20120509),严格按照使用说明书操作。
1.4 仪器
BS224S型电子分析天平、CQ-250超声波清洗器、RE-52型旋转蒸发器、DL-50型超级恒温器、756M C型紫外可见分光光度计及GL-20G高速冷冻离心机。
2 方法
2.1 动物分组
实验大鼠适应性饲养4 d后,以20 min/d的运动量对其进行为期3 d的筛选,淘汰不适应游泳训练者。将剩余大鼠以数字随机分组法分为5组:静止对照组(C组),运动对照组(T组),运动ig低剂量巴戟天组(TML组),运动ig中剂量巴戟天组(TMM组),运动ig高剂量巴戟天组(TMH组),每组10只。各组每天自由摄食饮水,采用专业灌胃器,每天ig一次。低、中、高剂量组ig剂量分别为4 g/(kg·d)、8 g/(kd·d)、12 g/(kd·d),相当于成人推荐剂量的5倍、10倍、30倍。ig量为5 ml/kg,C和T组ig等量生理盐水。
2.2 训练及测试方案
C组不进行任何训练。其他组进行负重游泳训练,均采用100 cm×50 cm×60 cm的玻璃泳槽作为大鼠游泳训练装置,水深50 cm。水温(31±2)℃,为防止大鼠在水面漂浮不动,特在游泳箱底部放置佳宝AP1500型水泵形成流动水。训练28 d,第一周不负重,第二周负2%体重,第三周负4%体重,第四周负5%体重,每次游泳训练至力竭。大鼠开始游泳至力竭所用时间为大鼠力竭运动能力[2]。力竭标准以大鼠下沉后10 s不露出水面为度。处死前的最后1次为无负重力竭游泳训练,记录力竭时的游泳时间。末次训练后24 h测定体重、力竭游泳时间及脑组织中(MDA等生化指标。处死时均采用戊巴比妥钠65 mg/kg麻醉,断头处死,立即开颅,迅速取出全脑,浸入冰生理盐水中洗净残余血液,滤纸吸干,用剪刀剪下约0.3~0.4 g脑组织,用电子天平称重,按1∶9(质量分数)加入冰冷的生理盐水,冷环境中匀浆制成质量分数为10%的脑组织匀浆液,低温离心(2 000 r/ min)20 min,取上清液于样品管中待测。
2.3 统计学方法
3 结果
3.1 体重及运动能力变化(见表1)
表1 巴戟天对大鼠体重及运动能力的影响(±s)
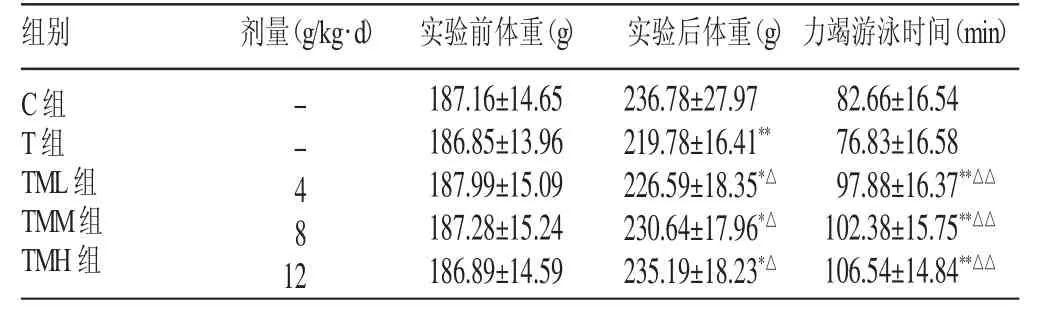
表1 巴戟天对大鼠体重及运动能力的影响(±s)
注:*表示与C组比较,P<0.05;**表示与C组比较,P<0.01;△表示与T组比较,P<0.05;△△表示与T组比较,P<0.01
组别 剂量(g/kg·d) 实验前体重(g) 实验后体重(g)力竭游泳时间(min)C组T组TML组TMM组TMH组182.66±16.54 176.83±16.58 197.88±16.37**△△102.38±15.75**△△106.54±14.84**△△--481 2 187.16±14.65 186.85±13.96 187.99±15.09 187.28±15.24 186.89±14.59 236.78±27.97 219.78±16.41**226.59±18.35*△230.64±17.96*△235.19±18.23*△
由表1可知,TM各组间体重无显著性差异,大于T组(P<0.05),小于C组(P<0.05),且体重随剂量增大而增加;TM各组力竭游泳时间长于C组、T组(P<0.01),且随剂量增大而延长,但组间无显著性差异。
3.2 脑组织MDA、GSH-Px、SOD含量
表2 巴戟天对力竭大鼠脑组织MDA、GSH-Px、SOD含量的影响(±s)
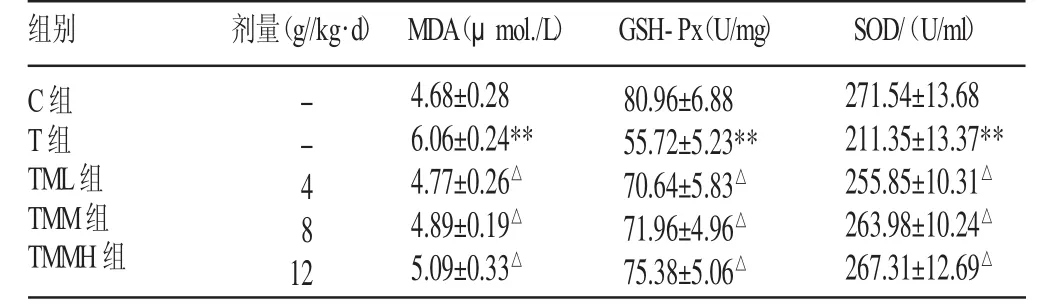
表2 巴戟天对力竭大鼠脑组织MDA、GSH-Px、SOD含量的影响(±s)
注:同表1
组别 剂量(g//kg·d) MDA(μmol./L) GSH-Px(U/mg) SOD/(U/ml)C组T组TML组TMM组TMMH组271.54±13.68 211.35±13.37** 255.85±10.31△263.98±10.24△267.31±12.69△--481 2 4.68±0.28 6.06±0.24** 4.77±0.26△4.89±0.19△5.09±0.33△80.96±6.88 55.72±5.23** 70.64±5.83△71.96±4.96△75.38±5.06△
力竭运动引起大鼠脑组织MDA含量升高,T组高于C组(P<0.01),TM各组均低于T组(P<0.05),但高于C组;GSHPxSOD含量下降,T组低于C组(P<0.01),TM各组高于T组(P<0.01),但低于C组;TM组间以上各项指标无显著性差异(见表2)。
4 讨论
4.1 巴戟天对大鼠体重及运动能力的影响
在运动训练过程中,通过体重的变化可以了解训练的安排是否妥当、训练对机体的影响程度和机体对训练的适应状况[3]。试验结果显示,T组体重小于C组(P<0.01),说明机体的自身调节作用已不能完全阻止力竭运动对生长发育所产生的影响;TM各组体重大于T组(P<0.05),小于C组(P<0.05),说明巴戟天对长时间力竭运动造成的机体损伤有一定作用,可在一定程度上抑制体重相对增长下降的趋势。
力竭时间是机体的抗应激能力、抗疲劳能力等多种能力的综合体现,是衡量机体运动能力的重要直接指标[4]。试验结果显示,TM各组力竭游泳时间明显长于C组、T组(P<0.01),且随剂量增大而延长。说明巴戟天能够延缓大鼠运动性疲劳的产生,提高机体运动能力,且呈剂量依赖性。其机理可能为以下几方面:(1)巴戟天中的主要成分巴戟天多糖对物理、化学及生物来源的多种活性氧(ROS)具有清除作用,具有减轻脂质过氧化产物丙二醛(MDA)的生成量,提高超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)活性和稳定细胞膜的作用,从而提高大鼠运动时自由基的消除,起到抗疲劳、提高运动能力作用[5]。(2)巴戟天中富含维生素C及锰等多种微量元素,能够促进机体能量代谢,起到抗疲劳作用,提高运动能力[6]。(3)巴戟天有助于肌糖原的合成和含量的提高,加快并促进ATP高能磷酸化合物合成,起到抗疲劳、提高运动能力的作用[7]。
4.2 巴戟天对脑组织自由基的影响
自由基又称游离基,是指外层轨道含有未配对电子的原子、原子团或特殊状态的分子,他们是生物体内代谢过程中产生的副产品。自由基特别是高度活泼的羟自由基对人体的危害主要是发生脂质过氧化反应使细胞膜变性,并丧失对细菌和病毒的抵御能力,攻击正在复制中的基因等。在正常情况下体内自由基的产生和清除处于一个动态平衡状态[8]。力竭运动时,氧自由基大量产生,组织抗氧化能力下降、氧自由基与细胞膜上的多聚不饱和脂肪酸发生脂质过氧化反应,致使细胞膜受到破坏,其流动性和通透性发生变化,胞内Ca2+严重超负荷,线粒体和三磷酸腺苷含量明显减少。脑组织是体内所有器官、组织中最易遭受自由基袭击的部分[9]。机体的功能多集中于大脑,大脑是一种高度发达、结构极其复杂、功能非常完善的特殊物质系统,是体内分析、综合的最高级中枢,脑组织受损可导致皮层功能受损,进而使运动冲动发放减弱,大脑分析、综合能力下降,并产生各种感觉(如时间与空间感觉)障碍,还可导致心理应激加强,不良情绪增多,从而削弱运动员竞争的动机与意志,阻碍运动成绩发挥。脑作为运动的调节中枢,其功能正常与否,直接关系到机体的运动能力[10]。
机体内存在清除自由基、减轻其危害的主要物质是抗氧化酶[11]。SOD是需氧生物体内数千种酶中以氧自由基为底物的唯一酶,该酶对底物具有很强的专一性,且催化效能高。其通过催化超氧阴离子形成过氧化氢而清除超氧阴离子,保护机体免受损伤,在一定范围内,自由基代谢增强时,SOD会代偿性增加。因此,SOD活性的高低是机体抗氧化能力强弱的标志。GSH-Px主要存在于细胞液与线粒体内,是机体广泛存在的一种重要的抗氧化酶,与SOD、CAT一同构成了对抗机体活性氧的三道防线,可催化GSH对过氧化氢的还原反应,从而起到保护细胞膜结构和功能完整的作用[12]。MDA是细胞脂质过氧化的主产物,生物膜脂质不饱和脂肪酸极易受到自由基攻击而发生过氧化,MDA生成量不仅反映氧自由基生成与否,而且还反映脂质过氧化程度。组织线粒体MDA含量是目前公认的衡量机体自由基代谢的敏感指标[13]。
试验结果说明,作为一种直接发挥抗氧化作用的化合物,巴戟天能够有效清除大鼠因大强度力竭运动引起的自由基代谢紊乱并提高抗氧化能力,进而直到改善、抑制脑组织氧化损伤,缓解疲劳的作用。其机制可能为一方面巴戟天中所含巴戟素通过改善机体供氧能力,改善运动机体微循环,增强机体免疫力,使SOD增加、活力增强,降低脑组织的过氧化脂质(LPO)含量[14];另一方面通过减少机体超氧阴离子自由基的生成,而使SOD的消耗相应降低。两方面的共同作用能够调节机体维持SOD的动态平衡,显著提高大鼠力竭运动脑组织SOD活性,对清除机体自由基、减轻自由基对脑组织的氧化损伤起到积极作用,从而延缓疲劳发生,提高运动能力。
[1]肖培根.新编中药志[M].北京:化学工业出版社,2002.
[2]Voces J.Effects of administration of the standardized Panax ginseng extract G115 on hepatie antioxidant function after exhaustive exercise[J]. Comp Biochem Physiol C Pharmacol Toxicol Endocrinol,1999,123(2):175.
[3]赖学鸿.牛蒡子对运动大鼠糖代谢、血睾酮及运动能力的实验研究. [J].重庆医科大学学报,2010,35(3):375.
[4]张平,李明学,李岚.锌对力竭运动时大鼠肝脑组织自由基代谢的影响[J].体育科学,2005,25(5):63.
[5]刘霄.巴戟天多糖的降血糖和抗氧化作用研究[J].中药材,2009,32(6):949.
[6]黄绍锉,刘明秋,林海,等.南药巴戟天中十二种无机元素的初步研究[J].广东微量元素科学,1994,1(3):6.
[7]夏桂兰,赵宝东,赵春玉,等.巴戟天对小鼠抗疲劳的实验研究[J].中国病理生理杂志,1998,14(2):182.
[8]Husain K,Somani S M.Response of cardiac antioxidant system to alcohol and exercise training in the rat[J].Alcohol,1997,14(3):301.
[9]简·卡珀.大脑的营养[M].雷丽萍,李海燕,译.北京:新华出版社,2002. [10]洪长青,严栩,谢敏豪.热应激与运动[J].北京体育大学学报,2004,27(4):496.
[11]孙存普,张建中,段绍瑾,等.自由基生物学导论[M].合肥:中国科学技术大学出版社,1999.
[12]刘俊,秦志峰,刘运莲,等.运动训练对小鼠肌肉组织自由基损伤的影响[J].南华大学学报:医学版,2003,31(1):22.
[13]Dillard C J.Effects of exercise vitamin E and ozone on pulmonary function and lipid peroxidation[J].J Appl Physiol,1978(45):927.
[14]陈朝风,谭宝毓,陈洁文,等.巴戟素对急性缺血性脑损伤保护作用的机制研究[J].广州中医药大学学报,2000,17(3):215.
R965
A
1671-1246(2014)19-0100-03
注:本文系2013年甘肃省哲学社会科学基金项目(13YD061)

