Mn3N2/CMK-8复合材料的制备及其作为锂离子电池负极材料的性能
方 晶
(南昌航空大学环境与化学工程学院,江西 南昌 330063)
1 引言
锂离子电池(LIBs)因其具有高的能量密度及环境友好等特点已广泛应用于便携式电子设备[1-5]。近来由于电动车的迫切需求,研究高功率、长循环寿命和高安全性能的LIBs已引起广泛关注。石墨因其高的比容量及廉价已广泛用作LIBs的负极材料[1, 6]。但是石墨低的锂嵌入电位(~0.1 V (vs Li/Li+))使得在负极生成高活性的树枝状金属锂,从而导致LIBs内部短路[7]。此外,石墨低的锂离子扩散系数限制了LIBs的功率密度[1,3,8]。
相比石墨而言,过渡金属氮化物电极材料展现出更高的储锂可逆容量,被视为潜在的电极材料[9-16]。这类材料在存储锂时,不同于商业化的碳材料,采用了置换反应的机制,一个金属离子能够与多个锂发生置换,在放电过程中分解成纳米尺寸的LinN和金属粒子基质,而且随后的充电过程这些纳米尺寸的LinN和金属粒子基质可以重新形成金属氮化物[17]。最近,有许多金属氮化物(如Co3N、Fe3N[9, 10]、Ni3N、CrN[11]、VN[12]、CoN[13]、Sb3N[14])作为锂离子电池负极材料的电化学性质已被报道,其储锂机制均符合传统的置换反应机理。虽然许多三元锂-金属元素-氮Li-M-N(M代表过渡金属元素)像Li3FeN2、和Li3-xCoxN在最初的研究中[15, 16]都发现有嵌脱锂的过程,然而这些氮化物与其他低化合价的金属氮化物,例如:Ni3N和Fe3N(化学价+ 1),均表现出相对较低的储锂容量[9, 10]。相反,其他金属高价态的金属氮化物如CrN、VN和CoN(化学价+ 3)虽然表现较高的储锂容量,其在电压范围0.01和3.5 V之间储锂容量可达1000 mAh/g以上,但嵌锂过程中体积膨胀的原因造成电极材料展示出较高的不可逆嵌锂容量,同时电极材料的极化、粉化现象严重[11-13]。此外,其他金属氮化物,例如Sb3N,电极反应过程中与金属锂形成合金的反应会引起巨大的体积膨胀导致整个电极的破碎和粉化[14]。因此,为了克服上述缺陷,尝试探索减小电化学活性金属氮化物的极化,缓解体积膨胀所造成的应力变化是目前改善过渡金属氮化物储锂性能的主要方向。近来Fang[18]组报导了MnO,Mn3O4,Mn2O3和MnO2的电化学储锂性能。发现不管最初是什么锰的氧化物,在接下来的循环中MnO是唯一可逆生成和分解的产物。受此工作启发,氮化锰(Mn3(+2)N2)因其中的锰与MnO中的锰有相同价态也显示出相当的可逆容量。这一中间价态能减少极化。此外由于金属锰不与锂形成合金,在电化学过程中,体积的改变可容忍。然而,Mn3N2的电子导电性比石墨低,这大大限制了其广泛应用。
本文以有序介孔碳为CMK-8硬模板、辅以高温处理,制备了Mn3N2/CMK-8复合材料,研究其作为LIBs负极材料的电化学性能。相比Mn3N2粉体及其他报道[19],Mn3N2/CMK-8作为负极材料显示出高的容量及更稳定的循环性能。
2 实验部分
2.1 实验试剂
本实验中所用的所有化学试剂都为分析纯并未进一步纯化。表面活性剂PEO20PPO70PEO20(P123,BASF 公司进口),正硅酸乙酯(TEOS,国药集团化学试剂有限公司),浓盐酸(36%~38%,国药集团化学试剂有限公司),正丁醇(国药集团化学试剂有限公司),冰醋酸(国药集团化学试剂有限公司),蔗糖(国药集团化学试剂有限公司),浓硫酸(国药集团化学试剂有限公司),氢氟酸(国药集团化学试剂有限公司),硝酸锰(国药集团化学试剂有限公司),硝酸锰(国药集团化学试剂有限公司)。
2.2 制备过程
2.2.1 kit-6的制备
将6 g三嵌段共聚物表面活性剂P123溶解在10 ml浓盐酸(35.6%)和220 ml去离子水溶液中,搅拌4 h至P123溶解,形成透明溶液,再向此溶液中加入6g正丁醇搅拌1 h,然后将该溶液置于35~45 ℃的水浴中,将12.9 g正硅酸乙酯缓慢滴加到该溶液中,将温度保持在35~45 ℃之间,搅拌24 h,然后再在100 ℃条件下水热处理24 h,最后过滤用去离子水反复洗涤,所得粉体在100 ℃干燥处理后,550 ℃煅烧出去表面活性剂。
2.2.2 CMK-8的制备
取5.15 g蔗糖加入稀硫酸中(0.57 g浓硫酸加入到15 gH2O中),搅拌,再向此溶液中加入3 g已制备好的kit-6,在室温下搅拌2 h,再放入烘箱。先在80 ℃下烘6 h,然后在160 ℃下烘6 h,然后研磨,加入到蔗糖稀硫酸溶液中,室温下搅拌2 h,放入烘箱。先在80 ℃下烘6 h,然后在160 ℃下烘6 h,然后研磨。再在N2保护下,在马弗炉中以每分钟升温三度,升至900 ℃,赔烧4 h,再用5 wt % HF 缓慢搅拌24 h, 过滤用去离子水反复洗涤,最后在70 ℃下过夜处理。
2.2.3 Mn3N2/CMK-8复合物的制备
将0.5 g 模板CMK-8分散至10 mL 乙醇中,加入 3.5 mM 硝酸锰,40 ℃搅拌8 小时,研磨干后,300 ℃ 反应 3 h, 升温速度:1 ℃/min;然后重复3次,每次降低 25% 硝酸锰的加入量。然后将所得粉体在氨气下,800 ℃反应3 h 。
为了比较将MnO粉体在氨气下,800 ℃反应3 h得到Mn3N2。
2.3 材料表征
样品粉末X 射线衍射在Bruker D8 Advance 型X射线衍射仪上进行,采用Cu靶Ka射线(λ=0.15406 nm),工作电压和电流分别是40 KV,40 mA,扫描步长为0.02°,XRD扫描范围为10°~80°(2θ);扫描电镜(SEM)图在JSM-7001F型场发射扫描电子显微镜上获得,加速电压:0.5 KV~30 KV;最高分辨率:1.2nm;透射电镜(TEM)图在JEM2100型投射电镜上获得。
2.4 锂离子电池的组装以及电化学测试
将80 wt %的电极活性材料(Mn3N2/CMK-8复合物)和10 wt %的乙炔黑,在研钵中充分研磨混合成均匀粉末,滴加10 wt %的聚偏氟乙烯(PTFE)乳液,待混合物变成胶状后,用刮刀将其均匀涂敷于铜箔集电极上,在130 ℃下保持8 h以除去其中的水分。电化学测试采用两电极体系的模拟电池进行,以相同直径的纯锂片为参比电极和对电极,微孔聚丙烯(Celgard-2402)作为隔膜,1.0 M LiPF6/EC+DMC+DEC (体积比为1:1: 1)为电解液,在充满氩气的手套箱中组装成成模拟电池。电池的冲放电测试在室温下由Roofer电池测试系统完成,充放电的电流密度皆为100 mA/g,首先让电池在电池起始电压以该电流密度恒流放电至0 V,再以该电流密度恒流充电至3.0 V范围。电池的循环寿命和容量保持率测试在0~3.0 V范围内进行测试。
3 结果与讨论
3.1 表征
图1所示为Mn3N2/CMK-8复合物样品的XRD图。可看出主要的衍射峰能很好与Mn3N2标准卡片(no. 87-2438)相对应,其中37.87°和42.77°分别对应于其(103)和(110)晶面。宽的峰可以归结于样品结构的纳米结晶化或重结晶。通过Scherrer公式可以计算出平均晶粒尺寸大约为10 nm(用37.87的峰宽计算)。没有出现CMK-8碳衍射峰, 由谱图基线的波动及5°< 2Ө<20°的基线减小, 表明该裂解碳为无定形结构。XRD数据表明Mn3N2能通过在CMK-8模板上在氨气气氛中制备。
图2(a,c)所示为Mn3N2与Mn3N2/CMK-8复合物样品的SEM图。与可看出Mn3N2/CMK-8复合物仍然保留其模板CMK-8的孔洞结构。图2(b,d)分为为其TEM图。Mn3N2植入在碳骨架的介孔通道内,一些粒子分布在介孔通道外。这种结构也使Mn3N2受到周围碳的二维束缚,在充放电循环中发生“膨胀”时,主要在平行于孔道方向上发生,而在粒状包覆结构中则因为包覆材料各个方向束缚力相同,发生三维方向膨胀。在CMK-8模板上的纳米Mn3N2, 模板可以起到骨架的支撑作用, 同时也提供了电子和L i+的传递通道,这种结构维持了Mn3N2及其后续反应产物的空间位置的稳定性, 可有效地缓解Mn3N2“膨胀”的影响并抑制“团聚”现象。
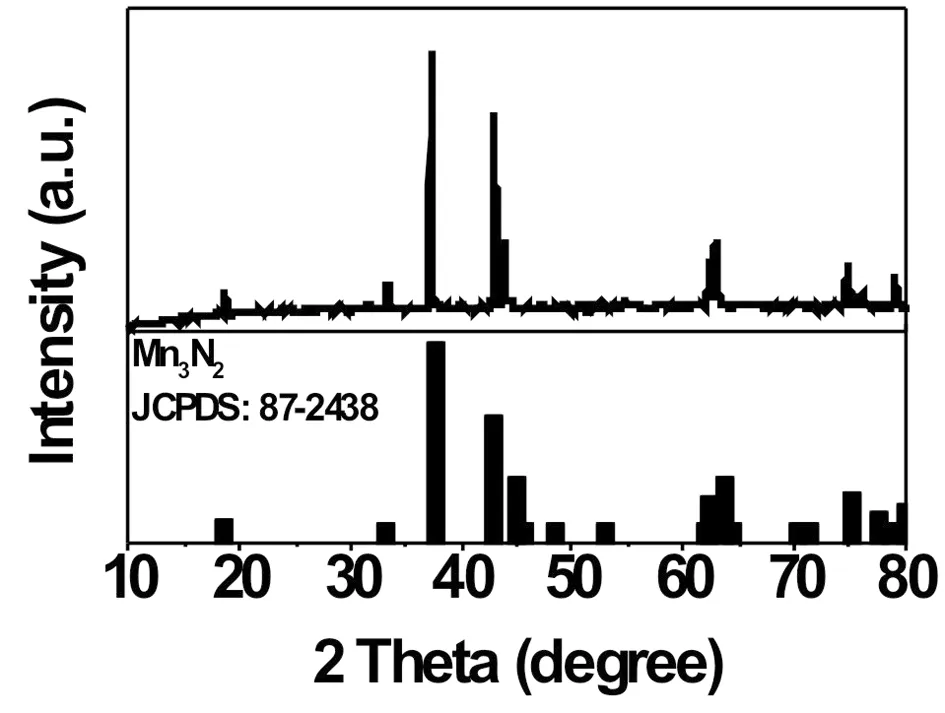
图1 Mn3N2/CMK-8复合物的XRD图

图2 Mn3N2(a)和Mn3N2/CMK-8复合物(c)的扫描电镜图;及其分别对应的透射电镜图(b)和(d)。
3.2 电池性能测试
图3a与b分别为Mn3N2/CMK-8复合物(a)和Mn3N2(b)作为负极材料装配的锂离子电池的充放电比容量和电压的变化曲线图,电压为0~3V,电流密度为100 mA/g 。可以看出Mn3N2/CMK-8复合物负极的首圈充放电容量均低于纳米Mn3N2负极, 这主要是因为无定形碳的容量低, 其含量增加使样品总体容量下降。对于Mn3N2/CMK-8复合物负极第1次循环的放电比容量为792 mAh/g,充电比容量为473 mAh/g,首次库伦效率为59.7% 。第2次循环的放电比容量为482 mAh/g,充电比容量为434 mAh/g,库伦效率为90.1% 。此后库伦效率基本保持不变。样品前5次循环放电比容量的衰减比较小,明显高于石墨化碳材料的理论容量(372 mAh/g),可见CMK-8支撑的介孔结构明显改善了样品的可循环特性。第1次充放电循环的比容量明显下降主要是因为锂在嵌入无定形碳的过程中,首先要嵌入石墨微晶之中,然后才会进入到微晶的微孔之中,同理,锂的脱嵌也是在石墨微孔中发生,然后再从石墨微晶中脱嵌。因此,锂在发生脱嵌的过程中会产生电压滞后的现象。除此之外,由于制备的温度较低,碳材料中残留有缺陷结构,锂在嵌入的时候也会首先与这些结构发生反应,由此导致其首次充放电的库伦效率较低。
图3c是Mn3N2/CMK-8复合物(a)和Mn3N2(b)作为负极材料装配电池的可逆循环容量。图中Mn3N2负极容量从1020 mAh/g迅速下降, 第20 次循环容量降至200 mAh/g 。而对于Mn3N2/CMK-8复合物在电流密度为100 mA/g时,经过大约2个循环的充放电之后,样品的放电比容量基本稳定在480 mAh/g 。样品具备非常优异的放电循环可逆性和稳定性。在循环过程中, Mn3N2负极容量迅速下降是由于“粉化”和“团聚”, 使充电产生的LinX不能互相接触,嵌/脱锂的通道逐渐丧失。而用CMK-8模板支撑后循环性能有明显改善, 这是因为纳米Mn3N2具有更多的嵌锂位置,并且抑制了充放电过程中体积变化,而无定形碳本身也具备一定的储锂性能,又能够提供稳定的Li+嵌通道,缓冲首循环Mn3N2体积变化,防止了颗粒的团聚。因此Mn3N2/CMK-8复合物具备非常好的纳米特性,可以减少充放电过程中的体积膨胀和收缩对结构的影响,同时,介孔结构也发挥其结构优势提高了样品的循环性能。
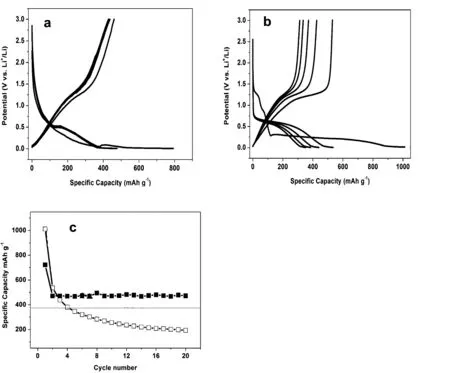
图3 Mn3N2/CMK-8复合物(a,■)和Mn3N2(b,□)的恒电流(100 mA/g)前五次充放电曲线及相应的循环曲线。图(d)中直线为石墨理论储锂容量。
4 结论
氮化物自身首圈容量很高,但是因为极化等原因,衰减很快,无法商业化应用,为了提高氮化物的库仑效率我们通过模板法,在氨气氛围下制备出CMK-8复合复合的Mn3N2,采用恒电流充放电循环研究了其作为锂电池负极材料的电化学储锂性能。结果表明,在恒电流为100mA/g时,Mn3N2储锂的可逆容量为792mAh/g;首圈库伦效率为59.7%,在100 mA/g 放电倍率下,20次循环后,容量为480mAh/g 。相比非模板法制备的Mn3N2,容量保有率提高70%,结合电镜与XRD数据,这种碳模板法制备的Mn3N2晶粒小且大小均匀,可逆容量高且容量保有率高。Mn3N2与CMK-8复合可以减少充放电过程中的体积膨胀和收缩对结构的影响,同时,介孔结构也发挥其结构优势提高了样品的循环性能。
[1]Xiang,H. F.; Zhang, X.; Jin, Q. Y.; Zhang, C. P.; Chen, C. H.; Ge, X.W. J. Power Sources 2008,183,355.
[2]Koga,C.;Wada, S.; Nakayama, M. Electrochim. Acta 2010,55,2561.
[3]Dedryvère, R.; Foix, D.; Franger, S.; Patoux, S.; Daniel, L.; Gonbeau, D. J. Phys. Chem.C 2010,14,10999.
[4]Capsoni, D.; Bini, M.; Massarotti, V.; Mustarelli, P.; Ferrari, S.; Chiodelli, G.; Mozzati, M. C.; Galinetto, P. J. Phys. Chem.C 2009,113,19664.
[5]Lee, S. C.; Lee, S. M.; Lee, J.W.; Lee, J. B.; Lee, S. M.; Han, S. S.; Lee, H. C.; Kim, H. J. J. Phys. Chem.C 2009,113,18420.
[6]Yoshikawa, D.;Kadoma, Y.; Kim, J. M.; Ui, K.; Kumagai, N.; Kitamura, N.; Idemoto Y. Electrochim. Acta 2010,55,1872.
[7]Rahman, M. M.;Wang, J. Z.; Hassan, M. F.; Chou, S.;Wexler, D.; Liu, H. K. J. Power Sources 2010,195,4297.
[8]Stournara, M. E.; Shenoy, V. B. J. Power Sources 2011,196,5697.
[9]Z.W. Fu, Y. Wang, X.L.Yue, S. L. Zhao, Q.Z. Qin, J. Phys. Chem. B 2004,108,2236.
[10]Y. Wang, Z.W. Fu, X.L.Yue, Q.Z. Qin, J. Electrochem.Soc.2004,151,162.
[11]Q. Sun, Z.W. Fu,Electrochem. Solid State Lett.2007,10,189.
[12]Q. Sun, Z.W. Fu,Electrochim. Acta 2008,54,403.
[13]B.Das, M.V. Reddy, P. Malar, T. Osipowicz, G.V.S. Rao, B.V.R. Chowdari, Solid State Ionics 2009,180, 1061.
[14]Q. Sun, W.J. Li, Z.W. Fu,Solid State Sci.2010,12,397.
[15]M.Nishijima, Y. Takeda, N. Imanishi, O. Yamamoto, M. Takano, J. Solid State Chem.1994,113,205.
[16]M.Nishijima, N. Kagohashi, N. Imanishi, Y. Takeda, O. Yamamoto, S. Kondo, Solid State Ionics 1996, 83,107.
[17]H. Li, Z. Wang, L. Chen, X. Huang,Adv. Mater.2009,21,4593.
[18]X.P. Fang, X. Lu, X.W.Guo, Y. Mao, Y.-S. Hu, J.Z. Wang, Z.X. Wang, F. Wu, H.K. Liu, L.Q. Chen, Electrochem. Commun.2010,12,1520.
[19]Q. Sun, Z. W. Fu, Appl. Surf. Scie.2012,258,3197.

