高效抗癌天然产物OSW-1及其类似物的合成进展
江龙发
(江西出入境检验检疫局综合技术中心)
“OSW-1”是Ornithogalum saundersiae Saponins的缩写形式,汉译为“虎眼万年青皂甙”。1992年,日本科学家Sashida[1],从植物虎眼万年青中分离到具有不可思议的超强抗癌作用的皂甙类化合物“OSW-1”。生理活性筛选实验表明:“OSW-1”体外抗癌活性比现在临床使用的紫杉醇、阿霉素、喜树碱等抗癌药物强数十倍甚至百倍,并且对正常细胞没有毒性。[2]而其独特作用于肿瘤细胞的机理[3]也使其有望成为开发一种新型抗癌药物的强有力的先导化合物。由于其独特的化学结构及高效的生物活性,OSW-1已经成为有机化学家合成的热门分子。本文简要概括了近年来OSW-1及其类似物的主要合成方法。
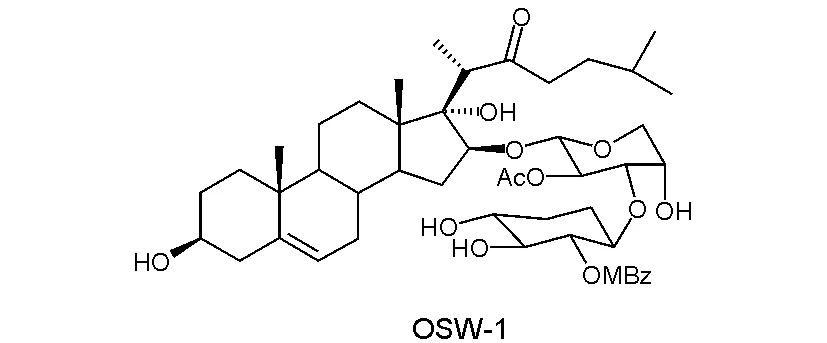
图1 OSW-1
一、Fuch’s 对OSW-1 苷元的合成[4]
1998年,Fuch 小组首次报道了OSW-1合成方面的工作,保护的OSW-1苷元被首次成功合成:以去氢表雄酮1为起始原料,经过Wittig反应,Lweis酸催化的“ene”反应及OsO4氧化的双羟化反应和C-16位羟基的构型转化反应等9步操作,以55%的总产率合成了保护的苷元8。在这条路线中,关键步骤是在D环上引入反式的双羟基,为实现这一目标,Fuch 小组一开始希望对4或5的C-16~17双键进行环氧化,进而碱性开环来达到,但经过各种尝试,三元环氧均无法实现开环,于是选择了毒性较大且价格较贵的OsO4进行双羟化氧化,显然这不利于工业化生产。
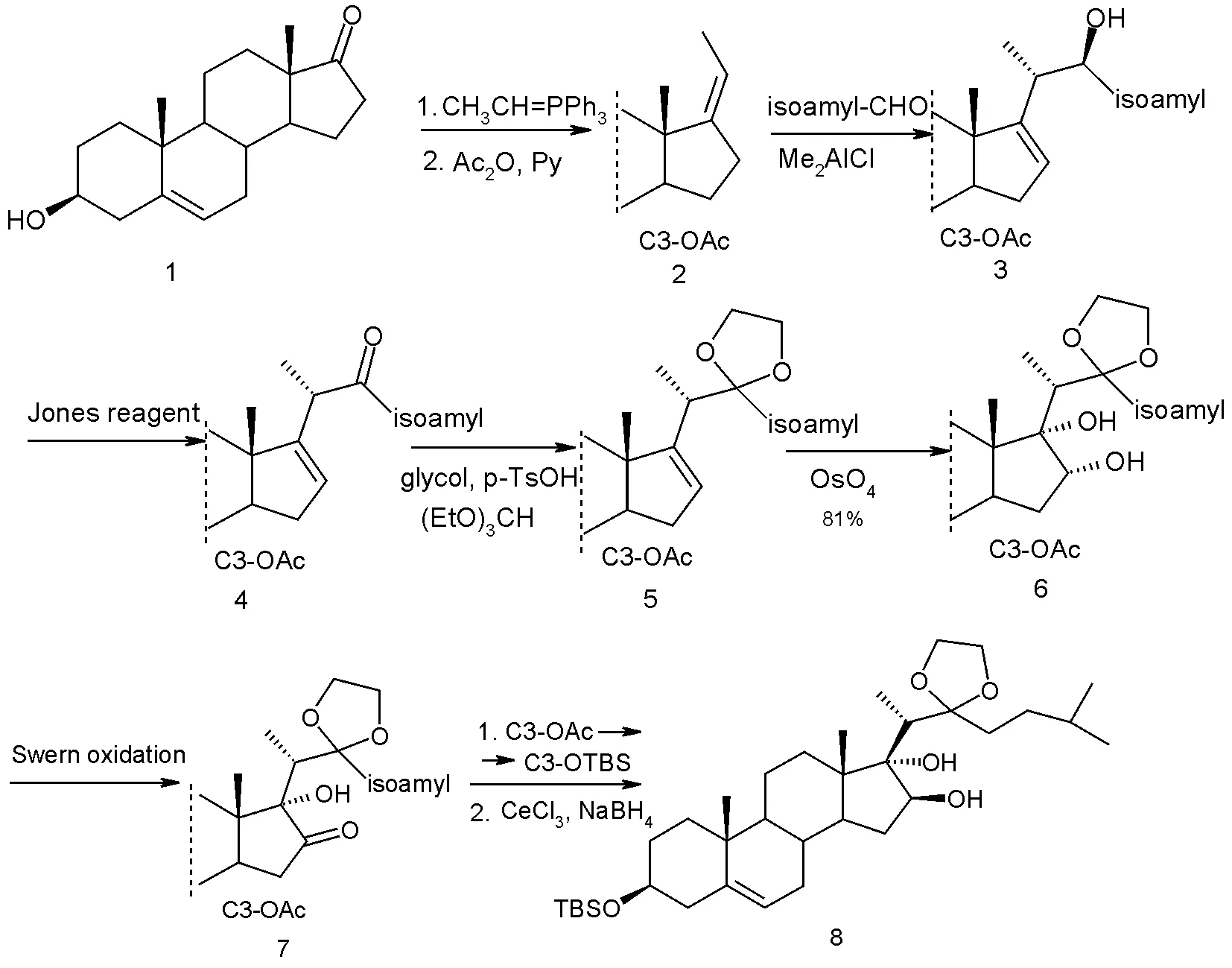
图2 合成步骤
二、Yu和Hui对OSW-1的合成[5a,5b]
1999年,Yu和Hui 首次报道了OSW-1 的成功全合成。合成路线中,去氢表雄酮也被选作起始原料。在合成苷元的过程中,他们基本上采取了类似于Fuch的合成策略,经过12个线性步骤,以10%的总产率合成了被保护的苷元8。接着又以D-木糖和L-阿拉伯糖为原料,经过多步修饰及最后的连接合成出了糖苷元18。最终两个片断在TMSOTf下成功连接,而随后用一种高效的去保护基试剂Pd(MeCN)Cl2,通过一锅反应实现脱除所有的保护基得到目标化合物OSW-1。整条全合成路线共有27个操作步骤,总产率为仅有6%。由于该路线较长,总产率低,无工业化应用前景。
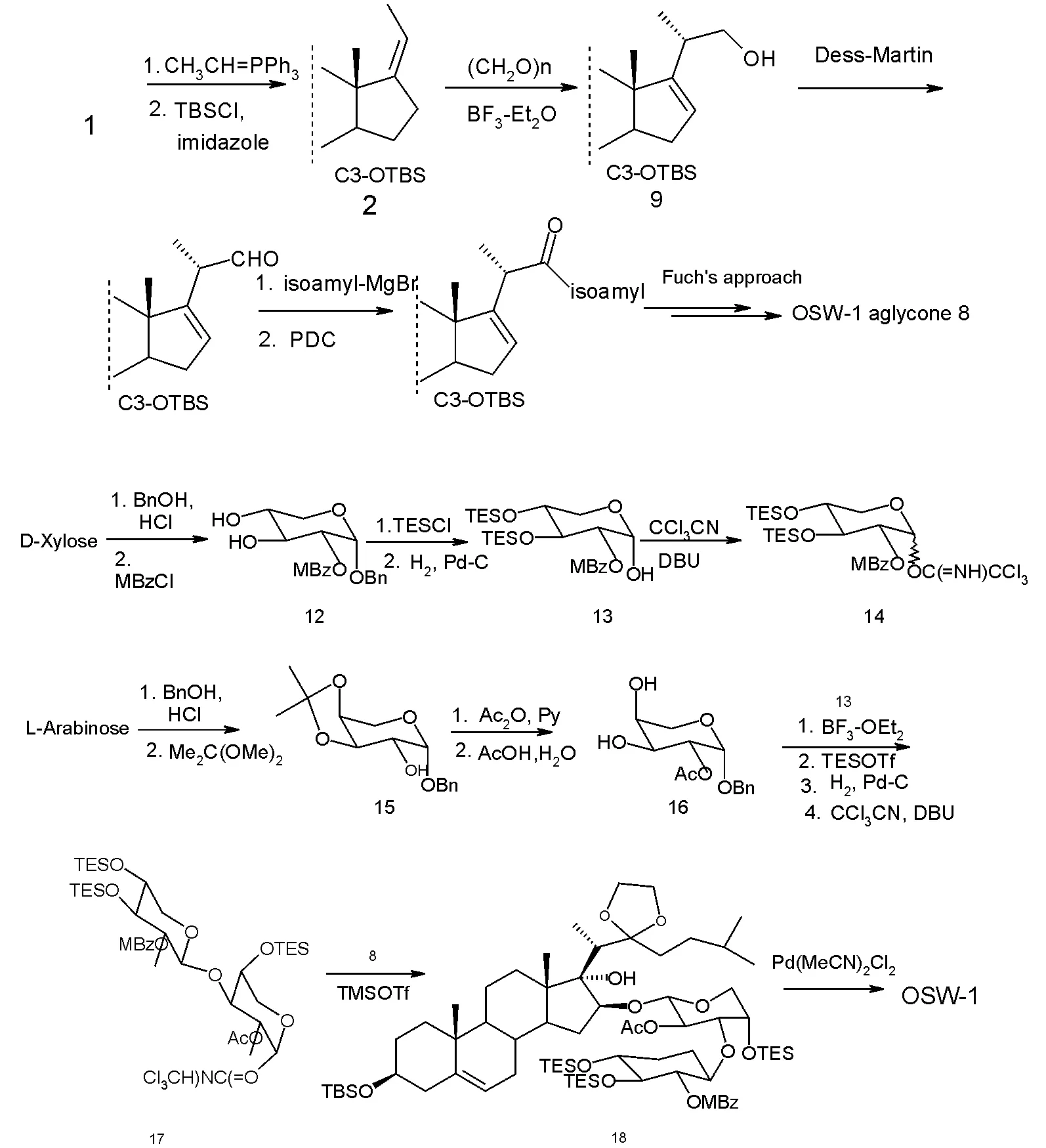
图3 合成步骤
三、Yu和Jin的合成策略[6]
2001至2002年,Yu和Jin连续报道了对OSW-1的合成工作。在甾体苷元部分,虽然也使用了去氢表雄酮作为原料,但合成中的一些关键步骤却与前人的合成不同。如C-16羟基通过利用SeO2/t-BuOOH体系进行烯丙基氧化得到,从而避免了昂贵且剧毒的OsO4的使用;又如通过烷氧烯基铜锂试剂进行1,4-加成实现边链的引入。而糖苷元部分,虽然D-木糖和L-阿拉伯糖也被选作原料,但作者成功开发了与前人不同的方法合成了糖苷元17。总之,这条路线通过10个线性步骤以28%的总产率成功实现了OSW-1的合成。该路线较之前的几条路线在工业上具有相当可行性,但仍有待改善。特别是21到22 步骤需要进一步优化。
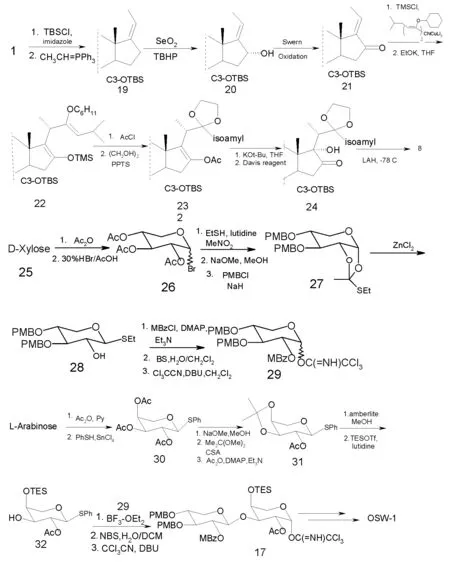
图4 合成步骤
四、Morzycki的合成策略[7]
从2000年起,Morzycki小组连续几年发表多篇论文探索了OSW-1的合成,最终他们开发了一条新的合成甾体苷元的路线,也为OSW-1类似物的合成提供了一条相当简便的途径。Morzycki小组仍然以去氢表雄酮为原料,首先通过C-3 羟基与C5~6 双键作用形成环丙烷化合物33起到对它们保护的作用,随后Wittig反应及在强碱下双键转移得到中间体35,接着在C16~17双键环氧化后,作者成功地探索出了在LiOH/H2O2条件下环氧丙烷通过分子内方式实现开环,从而大大简化了以往合成中C-16羟基正确构型繁琐的引入。以中间体37为原料,与不同的烷基锂试剂反应可实现多种OSW-1类似物甾体苷元的合成。随后作者通过简单的几步在C-16羟基上引入糖基部分并最终合成了OSW-1。该路线通过9个线性步骤,以5%的总产率实现了OSW-1的合成。这条路线虽然产率较低,但步骤相对较短,而且所用试剂较为常规,具有一定的应用前景。
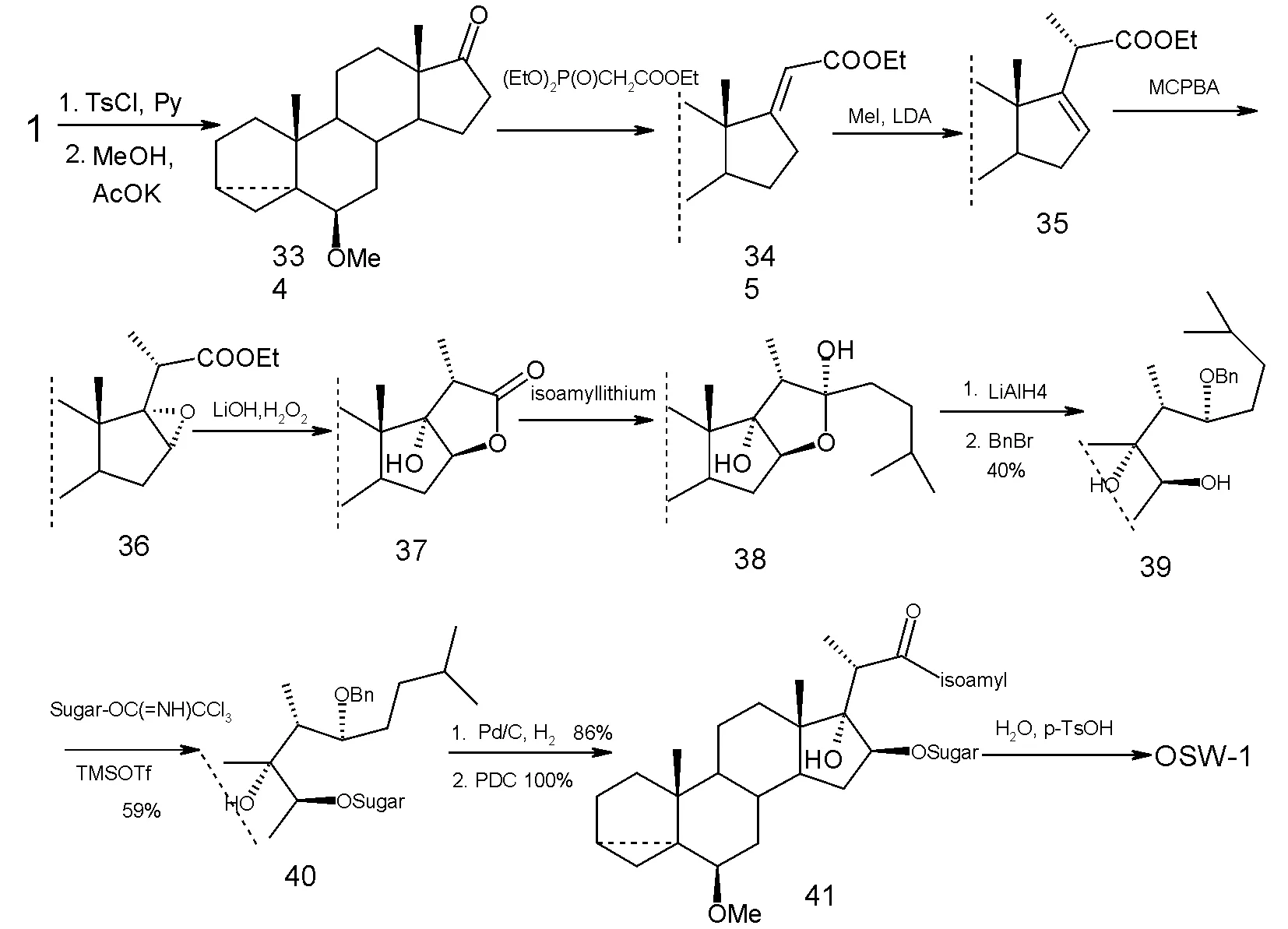
图5 合成步骤
五、Tian的合成策略
2003年,田伟生小组[8]也报道了一条OSW-1甾体苷元的合成途径。合成路线优势在于使用了价格非常便宜的薯蓣皂苷为原料,而不是以往合成中所用的去氢表雄酮,而后者正是通过降解前者所得,从而他们的路线体现了原子经济性的原则。最终他们以13个线性步骤及9.5%的总产率合成出了保护的甾体苷元。在这条合成路线中,关键步骤是E/F环的开环。另外一个关键步骤为46到47的转化,由于低的转化率阻碍了此种策略的应用。2007年[9],该小组又用类似的方式成功合成出了5(6)-2氢OSW-1,发现此化合物在对三种肿瘤细胞的作用检测中,其活性比OSW-1 强。
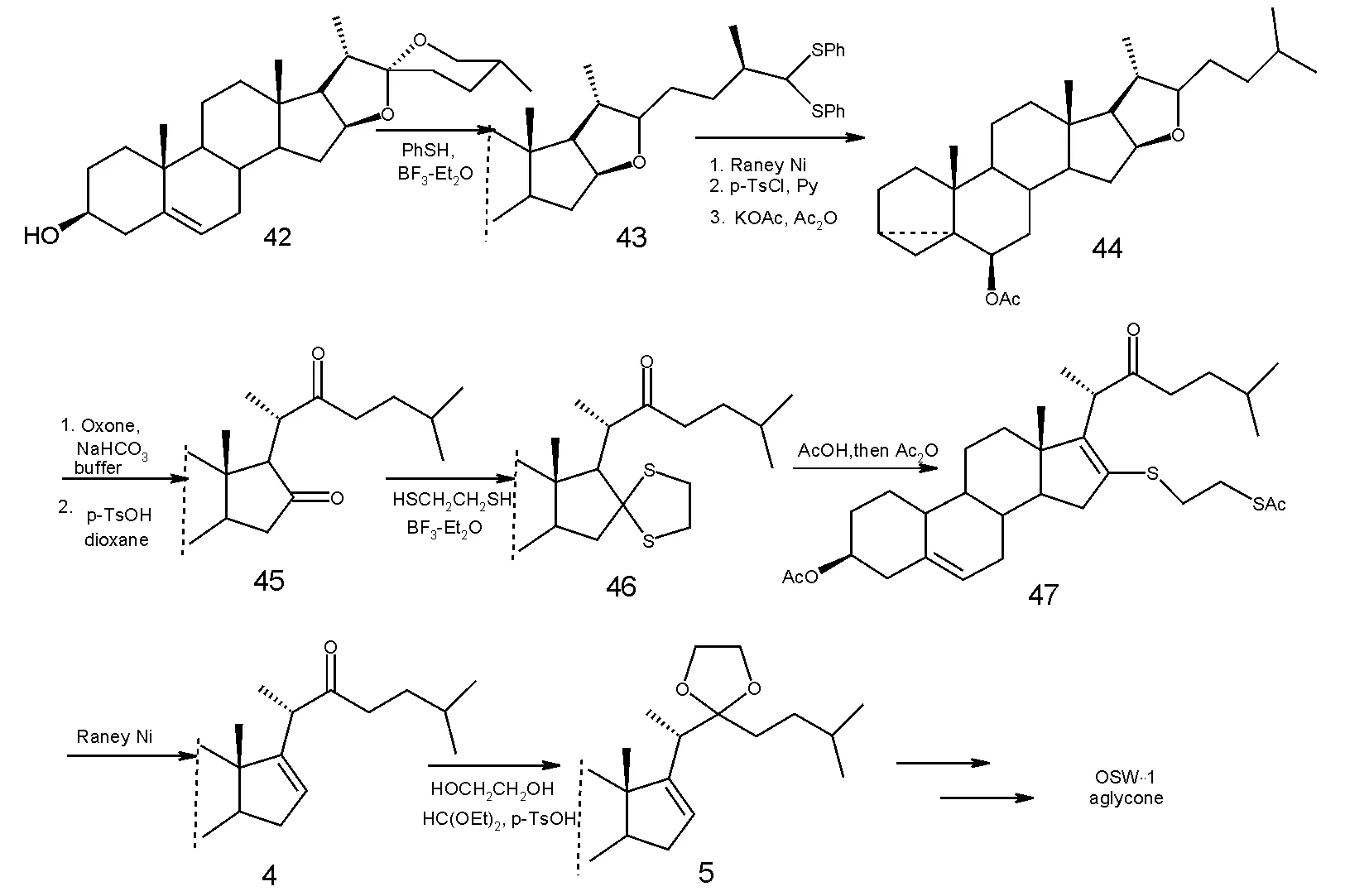
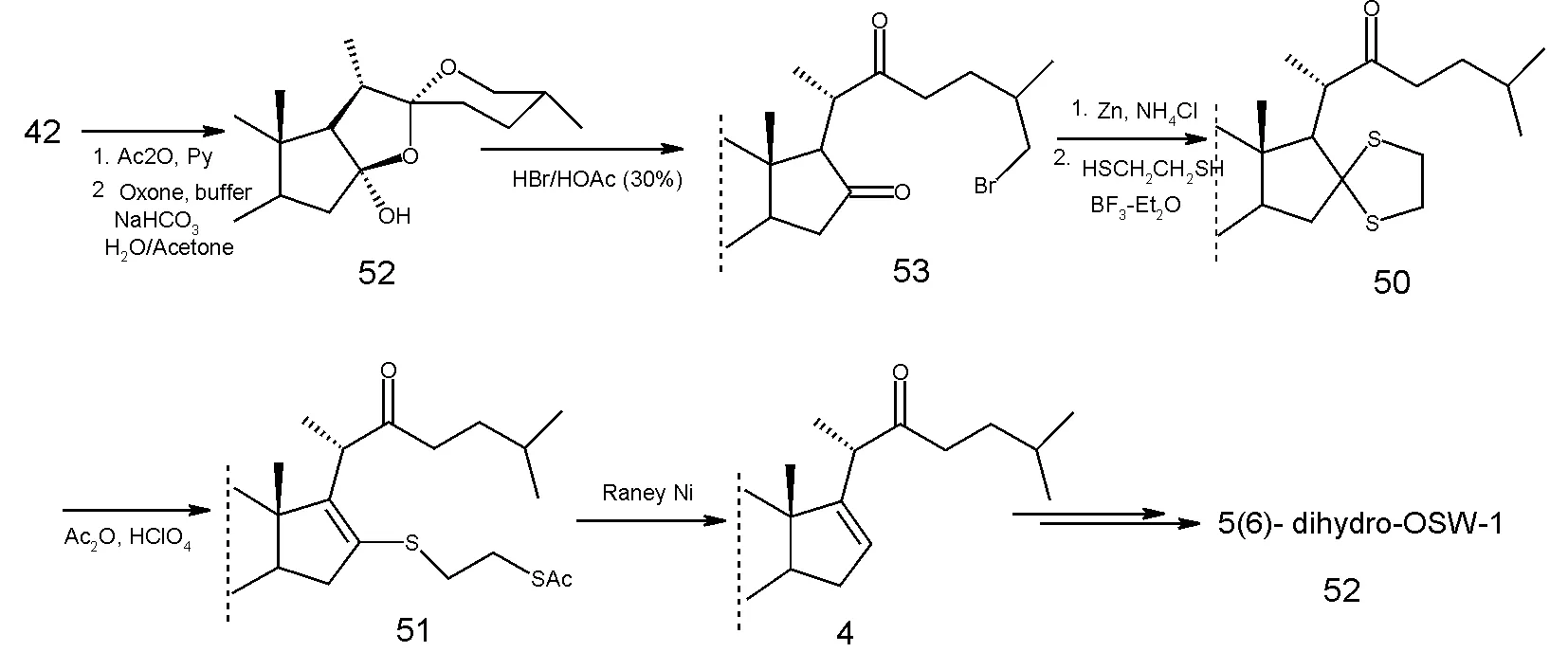
图6 合成步骤
六、Yu的合成策略[10]
2005年,俞标小组报道了一种不同的甾体苷元合成途径。该路线的特色是通过Aldol缩合开发了一种新颖而有效C-16及C-17双羟基C-22酮基甾体骨架的合成途径,此途径可以简便地合成出大量的C-22酯边链的OSW-1甾体苷元类似物。最终以14个线性步骤和7%的总产率合成出了OSW-1。另外作者还发现C-23氧代OSW-1类似物具有与OSW-1相同的活性。

图7 合成步骤
除了以上几个小组报道有关OSW-1的合成外,近年还有Guo小组[11]及Jin小组[12]和Tsubuki小组[13]也报道了他们的合成工作,但他们的合成路线与以往具有很强的相似性,因此这里不再详述。
总之,相比国内外所有科研小组有关OSW-1的合成工作,可以得出以下结论:首先由Jin 和Yu共同设计的合成路线相比是最好的,其通过10个线性操作以28%的总收率完成OSW-1的合成。其次Yu提出的路线为合成含有C-22酯边链的OSW-1甾体苷元提供了一条简便的途径。再其次由Hui和Yu开发的糖苷元的合成是比较简洁的。最后Tian通过使用保留骨架的薯蓣皂苷元作为原料来合成OSW-1的尝试是值得进一步研究的。
[1]Kubo,S.;Mimaki,Y.;Terao,M.;Sashida,Y.;Nikaido,T.;Ohmoto,T.Phytochemistry,1992,31,3969.
[2]Mimaki,Y.;Kuroda,M.;Kameyama,A.;Sashida,Y.;Hirano,T.;Oka,K.;Maekawa,R.;Wada,T.;Sugita,K.;Beutler,J.A.Bioorg.Med.Chem.Lett.1997,7,633-636.
[3]Zhou,y.;Carcia-Prieto,C.;Xu,R.H.;Lou,C.G.;Jin,Z.D.;Huang,P.J Natl Cancer Inst 2005;97:1781-5.
[4]Guo,C.X.;Fuchs,P.L.Tetrahedron Lett.1998,39(10),1099-1102.
[5]a>Deng,S.J.;Yu,B.;Lou,Y.;Hui,Y.Z.J.Org.Chem.1999,64(1),202-208;b>Patent:faming zhuanli gongkai shuomingshu CN1844138.
[6]a>Yu,W.S.;Jin,Z.D.J.Am.Chem.Soc.2002,124,6576-6583;b>Yu,W.S.;Jin,Z.D.J.Am.Chem.Soc.2001,123,3369-3370;c>Patent:Appl.No.60/310,709.
[7]a>Morzycki,J.W.;Wojtkielesicz,A.Wolczynski,S.Bioorg.Med.Chem.lett.2004,14,3323-3326;b>Morzycki,J.W.;Wojtkielesicz,A.Carbohydrate Research 2002,337,1269-1274;c>Morzycki,J.W.;Gryszkiewicz,A.Jastrzebska,I.Tetrahedron 2001,57,2185-2193;d>Morzycki,J.W.;Gryszkiewicz,A.Jastrzebska,I.Tetrahedron Letters 2000,41,3751-3754.
[8]a>Xu,Q.H.;Peng,X.W.;Tian,W.S.Tetrahedron Lett.2003,44,9375-9377;b>Patent:faming zhuanli shengqing gongkai shuomingshu CN1416875.
[9]Chen,L.J.;Xu,Q.H.;Huang,H.;Lin,J.R.;Tian,W.S.Tetrahedron lett.2007,48,3475-3477.
[10]a>Shi,B.F.;Tang,P.P.;Hu,X.Y.;Liu,J.O.;Yu,B.J.Org.Chem.2005,70,10354-10367;b>Shi,B.F.;Wu,H.;Yu,B.;Wu,J.R.Angew.Chem.2004,116,4424-4427;c>Patent:WO2005082924.
[11]Xue,J.;Liu,P.;Pan,Y.B.;Guo,Z.W.J.Org.Chem.2008,73,157-161.
[12]Kang,Y.;Lou,C.G.;Ahned,K.B.R.;Huang,P.;Jin,Z.D.Bioorg.Med.Chem.Lett.2009,19,5166.
[13]Tsubuki,M.;Matsuo,S.;Honda,T.Tetrahedron Lett.2008,49,229.

