盐藻小G蛋白DsRab的原核表达及纯化
李秀娟 柴晓杰 陶晓迎 赵欢 丛玉婷
(大连海洋大学 农业部北方海水增养殖重点实验室 辽宁省海洋生物资源恢复与生境修复重点实验室,大连 116023)
盐藻小G蛋白DsRab的原核表达及纯化
李秀娟 柴晓杰 陶晓迎 赵欢 丛玉婷
(大连海洋大学 农业部北方海水增养殖重点实验室 辽宁省海洋生物资源恢复与生境修复重点实验室,大连 116023)
前期对盐藻小G蛋白基因DsRab研究表明,在盐胁迫诱导下该基因转录水平明显提高。为进一步研究该蛋白在盐藻耐盐机制中的作用,PCR扩增DsRab的开放阅读框(ORF),并将其克隆至带有GST标签的原核表达载体pGS-21a,得到重组表达载体pGS-21a-DsRab。将重组表达载体转化E. coli BL21(DE3),IPTG诱导表达,并优化诱导表达条件,利用GST-SefinoseTMKit进行纯化,用SDS-PAGE和Western blot鉴定。结果表明,成功构建了重组表达载体pGS-21a-DsRab,SDS-PAGE结果显示得到的蛋白与预期分子量相符,并且纯度较高;Western blot检测结果初步证明该融合蛋白为GST-DsRab。
盐藻 DsRab GST 原核表达 纯化
盐生杜氏藻(Dunaliella salina,以下简称盐藻)的细胞结构简单,具有很强的抗盐能力,可以生长在5.0 mol/L NaCl培养液中,而且其培养条件也很简单。因此,盐藻是研究植物耐盐分子机制的重要模式生物[1,2]。研究表明当盐藻在高盐环境胁迫下,体内的蛋白质合成和降解以及能量代谢等多种代谢途径会发生很大程度的改变[2-4],其中耐盐作用主要是依靠盐藻中Na+/H+泵和大量合成兼容性溶质甘油,但应答盐胁迫的调控过程还少有报道。从信号传导方面开展对盐藻抗盐生理调节过程的研究,有助于全面了解盐藻耐盐机制[3]。
小G蛋白(Small GTP-binding proteins)分子量一般在20-30 kD之间,以单体形式普遍存在于真核生物中,通过激活态(结合GTP)与非激活态(结合GDP)的转变来行使分子开关作用,参与重要的细胞生理活动,包括信号传导、细胞增殖、囊泡转运、细胞骨架重组等[10,13]。Rab蛋白是小G蛋白家族(Ras、Rho、Rab、Arf/Sar和Ran 5个亚家族)中最大的亚家族,近年来在酵母、果蝇、拟南芥、烟草、水稻等真核生物中发现的Rab蛋白遍布于胞内
的各个膜区室[5,9],在胞吞和胞吐作用中,不同的Rab蛋白定位于特定的细胞器膜上,参与膜泡的形成、定向转运、锚定链接等过程[6,8]。现已发现许多与植物的抗逆性有关的Rab蛋白,其表达量会受到盐胁迫、低温、干旱等逆境条件的影响[4,7]。因此,深入了解Rab蛋白功能及进一步研究植物抗逆性相关蛋白的相互作用网络具有重要科学意义。
本实验室已从盐藻细胞中成功克隆出新的Rab蛋白基因DsRab(GenBank Accession No.JN989548),并用实时荧光定量PCR方法研究了DsRab基因在盐胁迫下的表达情况,证明DsRab是一个盐诱导上调基因[4]。本试验构建重组表达载体pGS-21a-DsRab,通过优化诱导表达条件使DsRab蛋白在上清中的表达量增加,利用GST-SefinoseTMKit纯化,获得纯度较高的可溶性融合蛋白,为制备抗体以及进一步在蛋白质水平上研究该蛋白在盐藻耐盐性机制中的作用奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌种和质粒 大肠杆菌(E.coli)菌株DH5α、E.coliBL21(DE3)、质粒pGS-21a由本室保存;pMD18-T Simple Vector购自TaKaRa公司。
1.1.2 试剂 限制性内切酶、Taq酶、IPTG、X-gal、T4连接酶购自TaKaRa,硝酸纤维素膜、Anti-GST Antibody、HRP-IgG、沉淀型单组分TMB底物溶液购自TIANGEN,GST-SefinoseTMKit(BSP032-7),Prestained Protein Molecular Weight Marker购自生工生物工程(上海)有限公司,凝胶回收试剂盒购自爱思进生物技术有限公司,其他试剂均为国产分析纯。
1.2 方法
1.2.1 原核表达载体的构建 根据DsRab基因cDNA全长序列(GenBank Accession No.JN989548)设计引物并加入酶切位点,上游引物(含EcoR I 酶切位点)P1:5'-CGGAATTCATGAACCCAGAGTACGACTACC -3',下游引物(含SalI酶切位点)P2:5'-GTCGACCTAGCAGCAGGTGGAGCGG-3'。以总RNA反转录的cDNA为模板,P1,P2为引物进行PCR扩增。扩增条件:94℃预变性5 min;94℃变性30 s,55℃退火30 s,72℃延伸1 min,35个 循环;72℃延伸9 min。扩增产物经1.0%琼脂糖凝胶电泳分离鉴定,回收目的片段,连接到pMD18-T simple载体上(T-A克隆),构建重组质粒pMD18-DsRab,转化E.coliDH5α感受态,在Amp抗性平板上筛选阳性单克隆。用EcoR I、SalI双酶切目的片段和pGS-21a质粒,用T4连接酶连接,构建表达载体pGS-21a-DsRab,转化E.coliDH5α感受态,筛选阳性单克隆,交由大连宝生物公司测序,以验证读码框的正确性。
1.2.2 融合蛋白的原核表达 将测序鉴定正确的表达质粒pGS-21a-DsRab转化E.coliBL21(DE3),挑取阳性单克隆,接种于5 mL含氨苄青霉素(50 mg/L)的LB液体培养基中,37℃过夜培养。次日,按1%的比例接种到5 mL新的LB液体培养基(氨苄青霉素50 mg/L)中,37℃振荡培养到菌液OD600=0.6-0.8时,试验组加入终浓度为1 mmol/L的IPTG,对照组不加IPTG,37℃诱导6 h。离心收集菌体,用0.01 mol/L PBS缓冲液悬浮,冰上超声波破碎,4℃、12 000 r/min离心10 min,分离上清与沉淀,加上样缓冲液,对上清和沉淀进行SDS-PAGE检测。
1.2.3 融合蛋白表达条件的优化 按1.2.2相同方式过夜培养的菌液,1%的比例转接到新的LB液体培养基(氨苄青霉素50 mg/L)中,37℃振荡培养到菌液OD600=0.6-0.8时,进行分组培养:IPTG终浓度梯度为0.1、0.2、0.4、0.8和1.0 mmol/L;诱导温度梯度为25、28、30、35和37℃;培养6 h。离心收集细菌,0.01 mol/L PBS缓冲液悬浮,冰上超声波破碎,离心取上清,用SDS-PAGE检测。
1.2.4 重组蛋白的纯化 优化表达条件下,将过夜培养的菌液按1%的比例接种于100 mL的LB液体培养基(含氨苄青霉素50 mg/L)中,37℃振荡培养至菌液OD600=0.6-0.8,加入终浓度为0.1 mmol/L IPTG诱导表达,28℃振荡培养6 h。4℃、8 000 r/min离心3 min,收集细菌,用20 mL 0.01 mol/L PBS缓冲液悬浮,冰上超声波破碎,4℃、12 000 r/min离心20 min,取上清并用0.45 μm滤膜抽滤。用GSTSefinoseTMKit纯化,SDS-PAGE电泳检测。
1.2.5 Western blotting检测 纯化后的融合蛋白进行SDS-PAGE电泳,电转移至NC膜(200 mA,2 h),用5%牛血清白蛋白4℃封闭过夜,加入一抗Anti-GST Antibody(1∶2 000),37℃孵育1 h,0.01
mmol/L PBST洗涤3次,每次5 min,然后加入二抗HRP-IgG(1∶200),37℃孵育1 h,0.01 mmol/L PBST洗涤3次,每次5 min,然后加入沉淀型单组分TMB底物溶液显色。
2 结果
2.1 原核表达载体的构建
经PCR扩增获得一条600 bp左右的条带(图1-A),与预期片段大小一致。EcoR I、SalI双酶切重组质粒pGS-21a-DsRab,结果(图1-B)表明目的片段已与pGS-21a质粒正确连接,重组质粒可以用于测序。测序结果表明扩增片段与DsRab基因开放阅读框完全一致,读码框正确,原核表达载体pGS-21a-DsRab构建成功。
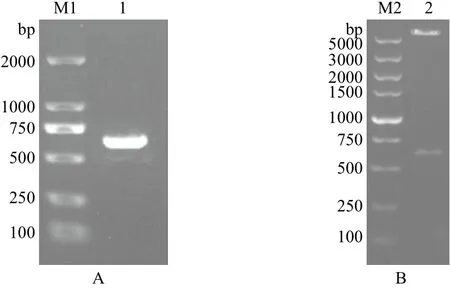
图1 盐藻DsRab基因PCR产物(A)及重组质粒pGS-21a-DsRab双酶切(B)凝胶电泳
2.2 融合蛋白的原核表达
对照组表达菌(含有空载体pGS-21a)诱导后,在35 kD左右有一条表达增强的标签蛋白条带,含有重组质粒的表达菌诱导后在57 kD左右有一条明显表达增强的条带,此条带在对照组没有出现,与预期结果相符(融合蛋白包括预计分子量为22 kD的DsRab蛋白和35 kD的标签蛋白)(图 2-A)。结果还显示,上清和沉淀均可见清晰的目的蛋白条带,表明目的蛋白为部分可溶性表达。
2.3 融合蛋白表达条件的优化
电泳结果显示,诱导剂IPTG的浓度在0.1-1.0 mmol/L范围内,融合蛋白的表达量没有太大变化(图2-B)。在25、28、30、35和37℃ 5个诱导温度下,融合蛋白的表达量比较,在28℃诱导时,融合蛋白的表达量最大(图2-C)。在最优条件下,融合蛋白的可溶性表达量显著增加(图2-D)。

图2 pGS-21a-DsRab在大肠杆菌中表达的SDS-PAGE电泳分析
2.4 重组蛋白的纯化及鉴定
纯化产物经SDS-PAGE检测,在57 kD左右有单一蛋白条带,表明融合蛋白被有效纯化(图3-A)。Western blotting检测(图3-B)显示,融合蛋白能与抗GST单克隆抗体特异性结合,具有良好的免疫学活性,表明融合蛋白在E.coliBL21(DE3)中成功表达。
3 讨论
高盐环境下,植物对盐胁迫的应答是非常复杂的过程,涉及一系列与抗逆性相关的信号传导过程[6,7]。研究表明Rab蛋白作为一种分子开关蛋白,分布于胞内所有的亚细胞结构,不同的Rab蛋白与相应的上游调控因子和下游效应因子相互作用,参与了胞内几乎所有的膜运输过程[12,14]。近来大量研究报道证实有些Rab蛋白与植物的高盐适应性有关。
Mazel等[6]将拟南芥AtRab7在转基因植物中表达,加速了转基因植物根、叶和原生质体中的胞吞作用,对盐和渗透胁迫的耐受性提高。O’Mahony 等在牧草(Sporobolus stapfianus)中发现的sRab2可能涉及由植物ABA参与的耐旱信号的传导[13,16]。水稻在冷冻、干旱及生长激素ABA存在的条件下,OsRab7基因的mRNA含量呈现不同的趋势[16];高盐胁迫下,普通冰草Rab5B、烟草PgRab7、花生AhRab7基因的表达量都有增加[7,15,16]。
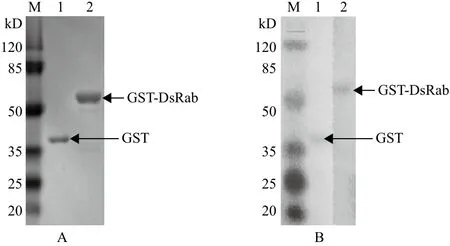
图3 重组蛋白的纯化(A)及Western blot鉴定(B)
在高度耐盐的模式生物盐藻中,有关DsRab蛋白的研究鲜有报道。本实验室已经克隆得到盐藻新基因DsRab,并初步证明该基因与盐藻耐盐性有关[4],为进一步研究DsRab蛋白在盐藻抗盐应答中的作用,获得高纯度的可溶性的DsRab蛋白是非常重要的。本试验中融合蛋白的表达选用经典的大肠杆菌原核表达系统,表达的融合蛋白在细胞的上清和沉淀中均有存在,说明融合蛋白以可溶性及包涵体形式表达。为了获得大量的可溶性蛋白,对诱导剂浓度和诱导温度两个表达条件进行了优化。其中诱导剂IPTG在0.1-1.0 mmol/L范围内,融合蛋白表达量相差不大,为尽可能减少包涵体形式的蛋白表达,诱导剂的浓度越小越好。试验中的5个诱导温度比较,28℃时蛋白的表达量最大。所以确定的最优表达条件是0.1 mmol/L IPTG,28℃,诱导培养6 h。
本试验中纯化的可溶性DsRab蛋白可以用于筛选与该蛋白可能发生相互作用的蛋白质,进一步了解DsRab上下游的作用因子。为深入研究盐藻DsRab蛋白在抗盐方面的作用,也可以在转基因的植物中过量表达该蛋白,检测转基因植物的高盐适应性。这些结果,不仅为下一步制备抗体并进一步研究DsRab蛋白在盐藻耐盐机制中的作用奠定了基础,而且为该类蛋白在植物抗逆中的作用提供了新的信息。
4 结论
成功的构建了盐藻DsRab蛋白的原核表达载体pGS-21a-DsRab,并在大肠杆菌E.coliBL21(DE3)表达体系中成功表达,优化诱导表达条件后,纯化上清蛋白,获得了纯度较高的可溶性融合蛋白。Western blot初步证明该融合蛋白就是带有GST标签的DsRab蛋白。
[1] Jia Y, Xue L, Li J, et al. Isolation and proteomic analysis of the halotolerant alga Dunaliella salina flagella using shotgun strategy[J]. Mol Biol Rep, 2010, 37(2):711-716.
[2] 余祝君, 柴晓杰, 张晓琳, 等.盐藻小G蛋白基因(DsRab)的克隆及在高盐胁迫下的表达分析[J]. 生物技术通报, 2013(9):77-83.
[3] 薛飞, 柴晓杰, 余祝君, 等.盐藻新基因DsSTPK的克隆及生物信息学分析[J].中国生物化学与分子生物学报, 2012, 28(3):289-295.
[4] Goyal A. Osmoregulation in Dunaliella, Part II:Photosynthesis and starch contribute carbon for glycerol synthesis during a salt stress in Dunaliella tertiolecta[J]. Plant Physiol Biochem, 2007, 45(9):705-710.
[5] Mazel A, Leshem Y, Tiwari BS, et al. Induction of salt and osmotic stress tolerance by overexpression of an intracellular vesicle trafficking protein AtRab7(AtRabG3e)[J]. Plant Physiol, 2004, 134(1):118-128.
[6] 向小华, 宋琳, 裴玉贺, 等.花生AhRab7基因的克隆及其原核表达研究[J].植物遗传资源学报, 2013, 14(4):686-693.
[7] Nahm MY, Kim SW, Yun D, et al. Molecular and biochemical analyses of OsRab7, a rice Rab7 homolog[J]. Plant Cell Physiol, 2003, 44(12):1341-1349.
[8] 郭志爱, 臧庆伟, 景蕊莲, 等.小麦小G蛋白Rab2基因TaRab2的克隆及其表达分析[J].作物学报, 2007, 33(2):201-207.
[9] 杨晓华, 彭晓珏, 杨国华, 等.水稻OsRab7耐盐功能的初步鉴定及其表达载体的构建[J].武汉植物学研究, 2008, 26(1):1-6.
[10] Grosshans BL, Ortiz D, Novick P. Rabs and their effectors:
achieving specificity in membrane traffic[J]. Proc Natl Acad Sci USA, 2006, 103(32):11821-11827.
[11] Deneka M, Neeft M, van der Sluijs P. Regulation of membrane transport by Rab GTPases[J]. Crit Rev Biochem Mol Biol, 2003, 38(2):121-142.
[12] Eathiraj S, Pan X, Ritacco C, et al. Structural basis of family-wide Rab GTPase recognition by rabenosyn-5[J]. Nature, 2005, 43(6):415-419.
[13] 冯婉娟, 徐子静, 孟令锋, 等. Rab蛋白调控胞内囊泡运输[J].现代生物医学进展, 2012, 13(12):2582-2600.
[14] Coxon FP, Rogers MJ. The role of prenylated small GTP-binding proteins in the regulation of osteoclast function[J]. Calcif Tissue Int, 2003, 72:80-84.
[15] Agarwal PK, Agarwal P, Jain P, et al. Constitutive overexpression of a stress-inducible small GTP-binding protein PgRab7 from Pennisetum glaucum enhances abiotic stress tolerance in transgenic tobacco[J]. Plant Cell Rep, 2008, 27:105-115.
[16] Schiene K, Donath S, Brecht M, et al. A Rab-related small GTP binding protein is predominantly expressed in root nodules of Medicago sativa[J]. Mol Gen Genomics, 2004, 272:57-66.
(责任编辑 马鑫)
Prokaryotic Expression and Purification of DsRab from Dunaliella salina
Li Xiujuan Chai Xiaojie Tao Xiaoying Zhao Huan Cong Yuting
(Key Laboratory of Mariculture & Stock Enhancement in North China’s Sea,Ministry of Agriculture / Key Laboratory of Marine Bio-resoursce Restoration and Habitat Reparation in Liaoning Province,Dalian Ocean University,Dalian 116023)
Previous studies indicated that the DsRab transcript could be increased by salt stress. In order to study the functions of DsRab in salinity tolerance, the open reading frame(ORF)of DsRab gene was obtained through PCR. The target fragment was cloned in pGS-21a, and the recombinant plasmid pGS-21a-DsRab was transformed into E. coli BL21(DE3). The recombinant protein was induced with IPTG. Then the prokaryotic expression condition was optiminzed to harvested more supernatant recombinant protein. The products were purified by GST-SefinoseTMKit, and identified by SDS-PAGE and Western blot. The results showed that the recombinant expression vector pGS-21a-DsRab was constructed successfully, the molecular weight of the recombinant protein was in the expected line. Western blot analysis showed that the recombinant protein can be identified specifically by the anti-GST antibody.
Dunaliella salina DsRab GST Prokaryotic expression Purification
2013-10-28
国家自然科学基金项目(30972240),辽宁省教育厅科技研究项目(2008T023)
李秀娟,女,硕士研究生,研究方向:海洋生物学;E-mail:lixiujuan113@yeah.net
柴晓杰,女,博士,教授,研究方向:海洋生物分子生物学;E-mail:cxj63@126.com

