基于重组大肠杆菌无细胞体系生产吡咯喹啉醌
孙继国韩增叶葛喜珍田平芳
(1.北京化工大学生命科学与技术学院,北京 100029;2.北京联合大学生物化学工程学院,北京 100023)
基于重组大肠杆菌无细胞体系生产吡咯喹啉醌
孙继国1韩增叶1葛喜珍2田平芳1
(1.北京化工大学生命科学与技术学院,北京 100029;2.北京联合大学生物化学工程学院,北京 100023)
采用无细胞体系生产吡咯喹啉醌(pyrroloquinoline quinone,PQQ)。首先将肺炎克雷伯氏菌PQQ基因簇pqqABCDEF置于半乳糖苷酶启动子之下,构建表达载体,经转化筛选获得重组大肠杆菌。制备重组菌的细胞匀浆,体外反应后测定PQQ产量。结果显示,与活体重组菌相比,无细胞体系的PQQ产量提高约30%,表明胞内存在PQQ合成的限速反应,而无细胞体系可解除此限速反应。
大肠杆菌 无细胞体系 吡咯喹啉醌 限速反应
吡咯喹啉醌(pyrroloquinoline quinone,PQQ)是不同于烟酰胺嘌呤核苷酸(NAD/NADP)和黄素核苷酸(FMN/FAD)的一种新型辅酶,被归类为B族维生素[1]。PQQ分子中含有参与氧化还原反应的邻醌类结构,可作为辅因子参与脱氢、氧化、水合和脱羧等反应[2]。迄今,PQQ主要发现于革兰氏阴性细菌,如肺炎克雷伯氏菌(Klebsiella pneumoniae)、扭脱甲基杆菌(Methylobacterium extorquens)和绿脓杆菌(Pseudomonas aeruginosa)等[3,4]。大肠杆菌(Escherichia coli)不能合成PQQ,但能合成以PQQ为辅因子的酶蛋白[5,6]。肺炎克雷伯氏菌的PQQ合成基因为线性排列的基因簇pqqABCDEF,包括6个阅读框[7],pqqA负责前体的合成,其余基因产物参与催化或转运。
在大肠杆菌中已成功表达乙酸钙不动杆菌和肺炎克雷伯氏菌的PQQ基因簇,并检测到PQQ的合成[8]。前者的PQQ合成量较低,后者培养基中的PQQ产量达到230 nmol/L,推测是在胞质合成PQQ,然后运输释放到培养基中。乙酸钙不动杆菌的PQQ分泌能力较弱。作为辅因子,PQQ参与多种反应,较难在胞内高度积累,推测是因为存在限速步骤。无细胞体系(cell-free system)是基于不完整细胞或完全不依赖细胞生产目标产物的方法,常用于研究多酶反应的限速步骤,或直接用酶进行体外催化[9]。
利用T7启动子在大肠杆菌中过表达葡萄糖酸杆菌的pqqABCED阅读框,但不能大量合成PQQ[10],推测胞内存在PQQ合成的限速步骤。本研究用无细胞体系验证限速步骤,旨在探索体外用细胞匀浆合成PQQ。
1 材料与方法
1.1 材料
1.1.1 菌株、质粒与培养条件 肺炎克雷伯氏菌(K.pneumoniaeDSM 2026),大肠杆菌E. coliDH5α及E. coliBL21,以及携带PQQ基因簇的表达质粒pETPQQ由本实验室保存。大肠杆菌和肺炎克雷伯氏菌的通用培养基为Luria-Bertani(LB),重组大肠杆菌的培养基为高糖M9培养基,其葡萄糖浓度为1.5%(W/V)。上述两菌的培养温度分别为37℃和30℃(肺炎克雷伯氏菌提供PQQ基因簇),转速为200 r/min,抗生素为硫酸卡那霉素50 mg/L。
1.1.2 主要试剂 PrimeStar聚合酶、ExTaq聚合酶、限制性内切酶和T4 DNA连接酶购自大连宝生物公司;PQQ标品购自Sigma公司;其他试剂均为国产分析纯。
1.2 方法
1.2.1 工程菌的构建 以pET28a质粒为骨架,选择BglII和EcoR I为上下游酶切位点,将其自身的T7启动子更换为半乳糖苷酶启动子pLAC(以本实验室构建的pET-PQQ为对照,PQQ基因簇含自身原始启动子)。设计引物如表1所示。PCR克隆pUC19中的lac启动子(用ExTaq聚合酶,PCR参数:95℃5 min;95℃ 45 s,55℃ 45 s,72℃ 45 s,共30个循环;72℃延伸10 min)。基于T7启动子前面的BglII位点和多克隆位点的EcoR I位点,将T7启动子更换为lac启动子,得到重组载体pET-pLAC。将去掉原始启动子的肺炎克雷伯氏菌PQQ基因簇pqqABCDEF插入其下游。具体方法:以肺炎克雷伯氏菌基因组DNA为模板,PCR扩增5.5 kb的pqqABCDEF基因簇。根据GenBank报道序列设计引物。使用PrimerStar聚合酶,PCR参数:98℃ 3 min;98℃ 15 s,60℃ 15 s,72℃ 5 min,共30个循环。用EcoR I和Hind Ⅲ双酶切pET-pLAC,将5.5 kb的PQQ基因簇插入pET-pLAC质粒,构建由pLAC调控的pqq基因簇表达质粒pET-pLAC-PQQ。
表1 试验所用引物
1.2.2 重组菌培养条件 以LB培养基为种子培养基,高糖M9培养基(1.5%葡萄糖)为发酵培养基。大肠杆菌在37℃下培养,转速200 r/min。用种子培养基活化重组菌,按1%菌量转接于发酵培养基。当重组菌E. coli(pET-pLAC-PQQ)的OD600值为0.6时加入诱导剂IPTG,使其终浓度为1 mmol/L。以E. coli(pET-PQQ)为对照,培养72 h,测定PQQ产量(卡那霉素终浓度为50 mg/mL)。
1.2.3 无细胞体系的制备 工程菌经种子培养基过夜活化,按1%菌量转接于发酵培养基。当E. coli(pET-pLAC-PQQ)的OD600值为0.6时,加入IPTG使其终浓度为1 mmol/L,培养24 h后测OD600。按OD600=1时10 mL菌液量(即OD600×V=10),5 000 r/min离心10 min,加入裂解缓冲液,超声破碎细胞,收集培养24 h的培养基,测OD600后按相同菌量离心,弃上清,用pH7.0的PBS重悬,再次离心,弃上清,以洗去残余培养基,离心后加入15 mL(即OD600×V值的1.5倍)细胞破碎缓冲液,超声破碎,4℃下经5 000 r/min离心10 min,取上清,避光密闭条件下30℃孵育3 h,测定孵育前后的PQQ产量(非酶法测定)。无细胞体系反应条件:30℃,3 h。用于超声破碎的缓冲液成分:pH7.0磷酸缓冲液,0.1%巯基乙醇,0.05% PMSF。超声条件:超声2 s,间隔3 s,功率80 Hz,50次。
1.2.4 PQQ含量与生长速度测定 PQQ含量用非酶法测定[11];用比浊法测定600 nm下的菌体吸光度,绘制生长曲线。
2 结果
2.1 含LAC启动子载体的构建
超表达基因将造成过重的细胞负荷。因质粒pET28a携带T7强启动子,故需更换为半乳糖苷酶启动子(pLAC,来自pUC19质粒)。PCR产物经电
泳鉴定,符合预期(~500 bp),电泳结果见图1。测序结果表明启动子序列完全正确。

图1 LAC启动子克隆及载体构建示意图
2.2 PQQ基因簇的克隆与重组载体构建
PCR产物经电泳鉴定,符合目的条带大小(~5.5 kb)。
基于EcoR I和Hind Ⅲ两个酶切位点,将5.5 kb的PQQ基因簇插入含LAC启动子的载体,提取质粒,酶切,琼脂糖凝胶电泳结果(图2)表明,不同启动子的PQQ重组质粒构建成功。E. coliDH5α为质粒扩增宿主菌,E. coliBL21为表达宿主菌,载体及菌种见表2。
图2 Lac启动子载体的构建

表2 菌株及重组质粒
2.3 PQQ基因簇的表达
因PQQ基因簇的原始启动子及半乳糖苷酶启动子均非强启动子,且PQQ基因簇本身含有发卡转录抑制结构,因此基因经转录和翻译产生的蛋白较少,从SDS-PAGE难以辨认,故只能从PQQ产量来间接体现基因的表达。
2.4 发酵液中PQQ产量
工程菌经种子培养基过夜活化,在高糖M9发酵培养基中培养72 h后,向E. coli(pET-pLAC-PQQ)加入诱导剂IPTG,用非酶法检测发酵上清液的PQQ含量。结果(图3)表明,E. coli(pET-pLAC-PQQ)与E. coli(pET-PQQ)的PQQ产量基本一致,表明这两种启动子对PQQ产量无明显差异。

图3 两种重组菌的PQQ产量
2.5 工程菌生长曲线
由生长曲线可知,携带PQQ基因的重组菌比对照菌(含空载体pET)提前2 h进入平稳期,系因PQQ基因表达导致了代谢负荷。若扣除该代谢负荷,PQQ的合成促进了菌体生长。进入平稳期后,重组菌E. coli(pET-pLAC-PQQ)的生物量略低于其他菌,可能是添加IPTG造成了细胞毒性。总体来看,重组
菌E. coli(pET-pLAC-PQQ)与其他菌的生物量基本持平,表明生成的PQQ至少没有抑制大肠杆菌的生长繁殖(图4)。

图4 重组大肠杆菌生长曲线
2.6 无细胞体系培养
2.6.1 无细胞体系破碎条件的确定 细胞破碎条件是影响胞液中酶活的关键因素,因此对常用4种破碎条件进行选择,经过无细胞反应体系后确定条件1为最佳破碎条件(图5)。
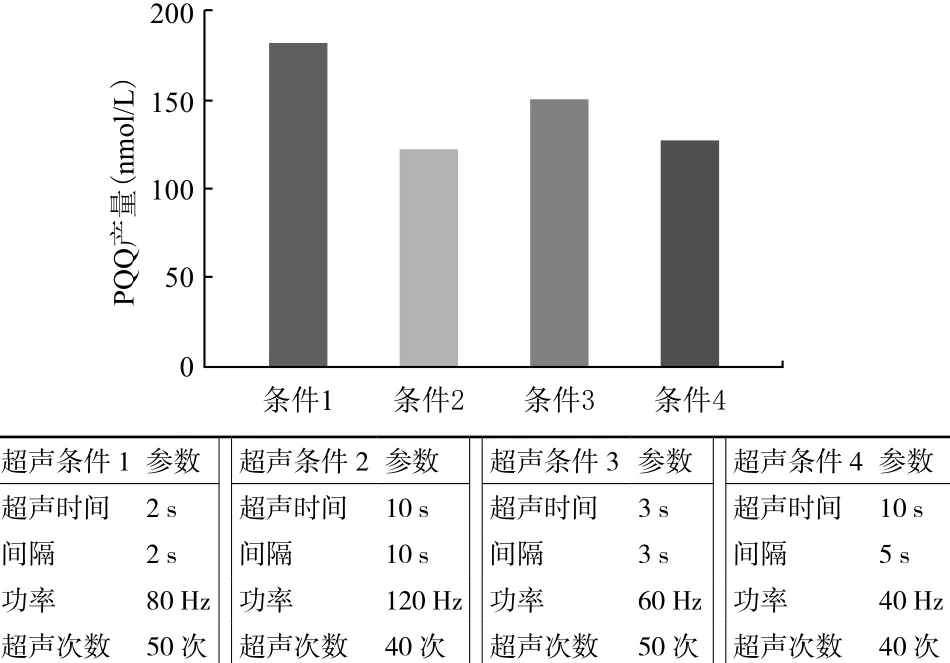
图5 细胞破碎条件
2.6.2 无细胞体系孵育条件的确定 因缺乏无细胞体系孵育条件的相关研究,因此研究了PQQ体外反应最佳条件。最终确定反应条件为30℃,避光密封孵育3 h(图6)。
2.6.3 工程菌无细胞体系反应 按照上述方法对工程菌进行无细胞体系反应,反应结束后测定PQQ产量。
测定结果(图7)表明,细胞破碎前后对照菌的PQQ产量没有变化,但重组菌E. coli(pET-pLACPQQ)的PQQ产量却提高了约30%,表明重组菌E. coli(pET-pLAC-PQQ)的细胞内存在瓶颈反应,从而限制了PQQ的合成。细胞破碎后,其PQQ产量明显增加,表明限速步骤被解除,PQQ合成反应得以继续。
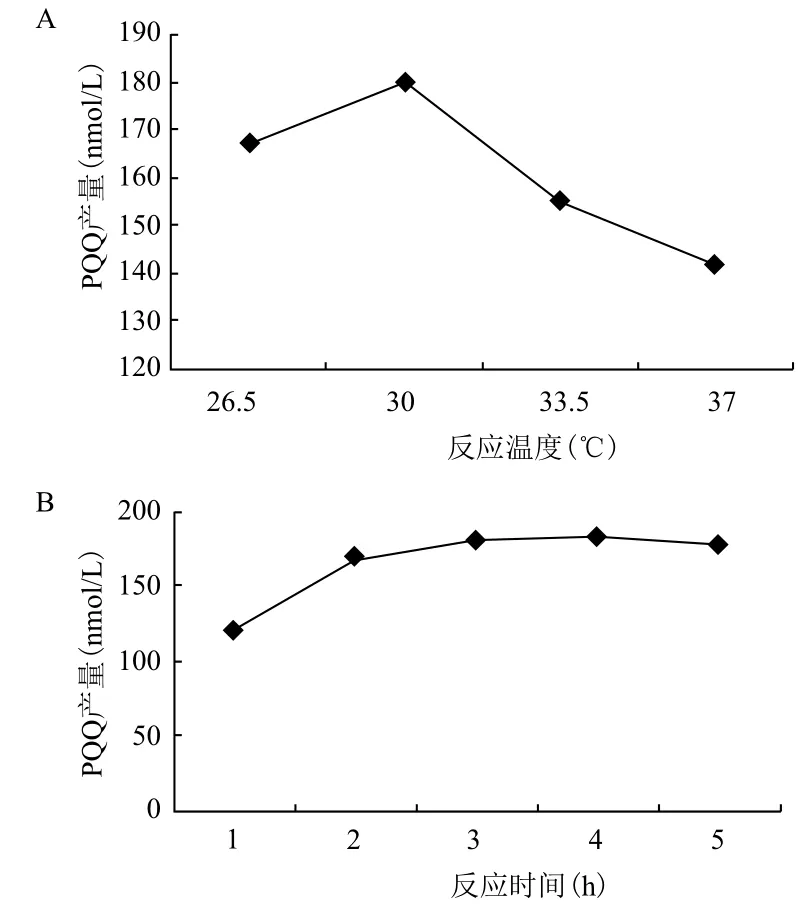
图6 无细胞体系反应条件
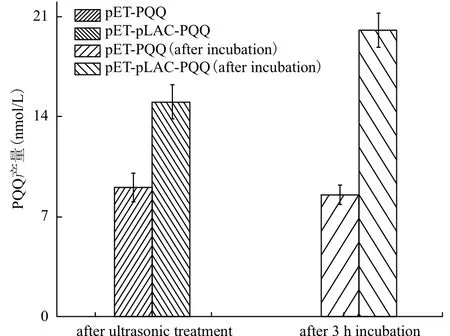
图7 重组菌无细胞体系孵育前后的PQQ产量
3 讨论
无细胞体系是提高目标产物产量的重要策略,其本质是解除活细胞内生化反应的限速步骤[9]。本研究构建了合成PQQ的重组大肠杆菌,结果表明更换启动子及优化培养基未能显著提高PQQ产量。考虑到限速反应的存在,建立了无细胞体系。与活细胞合成PQQ相比,重组菌E. coli(pET-pLAC-PQQ)
经无细胞体系反应后,其PQQ产量提高约30%,表明胞内存在瓶颈反应,无细胞体系可解除此瓶颈。该结果证明了PQQ体外合成的可行性。此外,培养条件、能量与还原力平衡、粗提液成分及酶活性均影响PQQ产量。
本试验的PQQ增产幅度有待提高,表明细胞粗提物无法达到最优效果。若对底物和酶进行纯化,对反应条件进行优化,并充分考虑能量和还原力等因素,可望进一步提高PQQ产量。由于PQQ生物合成机理尚未完全阐明,通常会采用超表达其基因簇或无细胞体系来提高其产量。由于PQQ是葡萄糖脱氢酶的辅酶,推断PQQ通过参与葡萄糖代谢而促进细胞生长。结果显示,PQQ基因的表达导致了代谢负荷,若扣除该代谢负荷,PQQ的合成促进了菌体生长。事实上,有文献[12]报道PQQ能刺激细胞生长,推断PQQ与细胞生长之间存在耦合关系。因此,共表达PQQ基因簇和葡萄糖脱氢酶基因可望促进PQQ的积累。此外,由于PQQ参与多种代谢过程以及其合成机制的复杂性,对PQQ生产菌进行大规模基因组改造,然后进行高通量筛选,不失为PQQ高产育菌的有效策略[13]。随着PQQ合成机理的阐明,其无细胞生产体系也将得以完善。
4 结论
构建了合成PQQ的重组大肠杆菌,结果表明更换启动子及优化培养基未能显著提高PQQ产量。考虑到限速反应的存在,建立了无细胞体系。与活细胞合成PQQ相比,重组菌E. coli(pET-pLAC-PQQ)经无细胞体系反应后,其PQQ产量提高约30%,表明胞内存在瓶颈反应,无细胞体系可解除此瓶颈。培养条件、能量与还原力平衡、粗提液成分及酶活性均影响PQQ产量。
[1] Kasahara T, Kato T. Nutritional biochemistry:A new redox-cofactor vitamin for mammals[J]. Nature, 2003, 422:832.
[2] Misra HS, Rajpurohit YS, Khairnar NP. Pyrroloquinoline-quinone and its versatile roles in biological processes[J]. J Biosci, 2012, 37(2):313-325
[3] Gorisch H. The ethanol oxidation system and its regulation in Pseudomonas aeruginosa[J]. Biochim Biophys Acta, 2003, 1647(1-2):98-102.
[4] Shen YQ, Bonnot F, Imsand EM, et al. Distribution and properties of the genes encoding the biosynthesis of the bacterial cofactor, pyrroloquinoline quinine[J]. Biochemistry, 2012, 51(11):2265-2275.
[5] Matsushita K, Arents JC, Bader R, et al. Escherichia coli is unable to produce pyrroloquinoline quinone(PQQ)[J]. Microbiology, 1997, 143(10):3149-3156.
[6] Cleton-Jansen AM, Goosen N, Fayet O, et al. Cloning, mapping, and sequencing of the gene encoding Escherichia coli quinoprotein glucose dehydrogenase[J]. J Bacteriol, 1990, 172(11):6308-6315.
[7] Meulenberg JJ, Sellink E, Riegman NH, et al. Nucleotide sequence and structure of the Klebsiella pneumoniae, pqq operon[J]. Mol Gen Genet, 1992, 232(2):284-294.
[8] Goosen N, Horsman HP, Huinen RG, et al. Genes involved in the biosynthesis of PQQ from Acinetobacter calcoaceticus[J], Antonie Van Leeuwenhoek, 1989, 56(1):85-91.
[9] Spirin AS, Baranov VI, Ryabova LA, et al. A continuous cellfree translation system capable of producing polypeptides in high yield[J]. Science, 1988, 242(4882):1162-1164.
[10] Yang XP, Zhong GF, Lin JP, et al. Pyrroloquinoline quinone biosynthesis in Escherichia coli through expression of the Gluconobacter oxydans pqqABCDE gene cluster[J]. J Ind Microbiol Biotechnol, 2010, 37(6):575-580.
[11] 赵永芳, 徐宁, 王银善, 肖华胜.吡咯喹啉醌含量的非酶系统测定[J].武汉大学学报, 1995, 41(6):777-780.
[12] Choi O, Kim J, Kim JG, et al. Pyrroloquinoline quinone is a plant growth promotion factor produced by Pseudomonas fluorescens B161[J]. Plant Physiol, 2008, 146(2):657-668.
[13] Cong L, Ran FA, Cox D, et al. Multiplex genome engineering using CRISPR/Cas systems[J]. Science, 2013, 339(6121):819-823.
(责任编辑 马鑫)
Exploiting Cell-free System of Recombinant E. coli to Synthesize Pyrroloquinoline Quinone
Sun Jiguo1Han Zengye1Ge Xizhen2Tian Pingfang1
(1. College of Life Science and Technology,Beijing University of Chemical Technology,Beijing 100029;2. College of Biochemical Engineering,Beijing Union University,Beijing 100023)
In this study, cell-free system was developed to overproduce pyrroloquinoline quinone(PQQ). The PQQ gene cluster from Klebsiella pneumoniae was subcloned into vector harboring lac promoter and a recombinant Escherichia coli was acquired. Subsequently cell homogenate was prepared which showed ~30% increase of PQQ yield compared with in vivo biosynthesis. Not only revealing the presence of intracellular velocity-limiting reaction(s)that retards PQQ biosynthesis, this study also suggests that cell-free system can address this issue. Hence, this study provides basis for further enhancement of PQQ production.
E. coli Cell-free system Pyrroloquinoline quinine Velocity-limiting reaction
2013-11-25
国家自然科学基金项目(21076013),“973”项目(2012CB725200)
孙继国,男,硕士研究生,研究方向:微生物代谢工程;E-mail:mishiweilan@126.com
田平芳,男,博士,教授,研究方向:微生物基因工程;E-mail:tianpf@mail.buct.edu.cn

