氮磷比对不同生长时期强壮前沟藻富集2,2’,4,4’-四溴联苯醚的影响
葛 蔚柴 超尹逊栋昌 晶
(1. 青岛农业大学生命科学学院, 青岛 266109; 2. 青岛农业大学资源与环境学院, 青岛 266109)
氮磷比对不同生长时期强壮前沟藻富集2,2’,4,4’-四溴联苯醚的影响
葛 蔚1柴 超2尹逊栋2昌 晶2
(1. 青岛农业大学生命科学学院, 青岛 266109; 2. 青岛农业大学资源与环境学院, 青岛 266109)
以海洋微藻强壮前沟藻(Amphidinium carterae Hulburt)为研究对象, 研究氮磷比对强壮前沟藻不同生长时期富集2,2’,4,4’–四溴联苯醚(BDE-47)的影响, 测定其比生长率、脂类和碳水化合物等指标, 分析了不同生长时期强壮前沟藻对BDE-47的富集与其生长和生化成分的关系。研究发现, 在强壮前沟藻的适应期, 氮磷比16时的强壮前沟藻细胞富集量为1.3 ng/(106cells), 显著低于其他氮磷比; 在对数期和稳定期, 氮磷比64、128时其富集量显著高于其他氮磷比, 对数期氮磷比64和128的富集量可达2.5—2.6 ng/(106cells), 约是其他氮磷比的1.5倍; 稳定期时约是其他氮磷比的2.4倍, 且氮磷比128时高达3.6 ng/(106cells)。不同氮磷比下强壮前沟藻对 BDE-47的富集量与脂类含量之间呈一定的正相关关系, 线性拟合回归系数近0.6。结果表明, 营养盐结构导致了强壮前沟藻的生长和脂类等生化成分变化, 并与 BDE-47富集量呈正相关关系,从而可对强壮前沟藻富集BDE-47产生影响。
氮磷比; 多溴联苯醚; 富集; 微藻
阻燃剂是一类能阻止塑料等高分子材料被引燃的功能性助剂, 在过去的30年中, 其使用量持续增加, 目前全球产量高达每年31万吨[1]。其中, 多溴联苯醚(PBDEs)是一类使用最广泛的阻燃剂, 大量应用于塑料、电子电器、建材、纺织品、家具等产品中[2]。作为一种添加型阻燃剂, PBDEs仅是混入塑料等产品中, 并不形成化学键, 这导致PBDEs极易从产品中流出而进入环境[3]。自20世纪70年代在环境中首次发现PBDEs后, PBDEs在环境和生物样本中的含量呈指数增长趋势, 目前已成为全球性污染物[4,5]。PBDEs具有较强的毒性、持久性和生物累积性, 因此关于它对环境和生物所造成的影响已成为环境科学的热点问题[6]。
近年, 海洋环境面临着PBDEs污染, ?世界范围的近海水体中均检测到了PBDEs。在我国, 厦门近海沉积物中8种PBDEs的平均含量为16.31 ng/g, 间隙水中平均浓度为15.3 ng/L[7]; 珠江口海水中17种 PBDEs的浓度范围为0.34—68.0 ng/L[8]; 长江口表层沉积物中12种PBDEs的最高浓度为0.55 ng/g[9]。调查发现, 在209种PBDEs同系物中, 2,2’,4,4’-四溴联苯醚(BDE-47)是一种主要存在于中国近海水体和水产品的一种PBDEs同系物[10—12]。
海水中的有机污染物能够被微藻富集并在食物链中传递[13], 而海水中的营养盐影响着微藻对有机物的富集程度。在营养匮乏环境中的淡水微藻对多氯联苯和多氯代二苯并呋喃的富集量更高[14,15], 同时营养盐浓度影响了海洋微藻对PBDEs的富集[16, 17]。上述研究主要是针对营养盐浓度, 关于营养盐结构对海洋微藻富集有机物的影响研究未见报道。本研究以我国近海常见的海洋微藻——强壮前沟藻(Amphidinium carterae Hulburt)为实验材料, 以近海环境和生物中主要存在的BDE-47为PBDEs的代表, 研究氮磷比对强壮前沟藻富集PBDEs的影响, 为探索不同营养条件下海洋微藻对有机污染物的富集特征提供科学依据。
1 材料与方法
1.1 微藻培养条件
强壮前沟藻来自于中国科学院海洋研究所生态室, 于光照培养箱中采用F/2培养基单种培养, 培养温度(20±1)℃ , 光照4000 lx, 光暗比为12h︰12h。
1.2 氮磷比设置
强壮前沟藻在无氮、磷人工海水中培养48h后,接种于 5 L无菌人工海水中, 添加硝酸盐( NO3-)和磷酸盐( PO4
3-), 氮磷比分别设置为: 1 ( NO3-: 16 µmol/L, PO4
3-: 16 µmol/L)、4 ( NO3-: 64 µmol/L, PO4
3-: 16 µmol/L)、16 ( NO3-: 256 µmol/L, PO43-: 16 µmol/L)、64 ( NO3-: 256 µmol/L, PO43-: 4 µmol/L)、128 ( NO3-: 256 µmol/L, PO43-: 2 µmol/L)。微量元素和维生素浓度根据F/2培养基加入。
在接种后的第 1天(适应期)、第 4天(对数期)和第9天(稳定期), 从培养体系中取出600 mL藻液,根据文献[13], 加入 0.6 mL BDE-47的甲醇工作液(浓度为0.2 μg/mL), 使最终BDE-47浓度为0.2 μg/L。强壮前沟藻在 0.2 μg/LBDE-47环境中暴露24h后,收集藻细胞, 测定微藻生化组分和 BDE-47的富集量等。实验重复三次。
1.3 测定方法
细胞计数 培养开始后每 24h后取一定体积藻液, 加入鲁哥试剂, 用血球计数板计数测定藻细胞密度。
营养盐的测定 培养开始后每24h后用0.45 μm微孔滤膜过滤一定量藻液, 滤液分别用镉柱还原法[18]和抗坏血酸还原的磷钼兰法[19]测定硝酸盐和磷酸盐含量。
碳水化合物和总脂的测定 过滤收集强壮前沟藻细胞, 根据 Zhao等的方法[20]预处理碳水化合物和总脂样品, 并分别采用苯酚–硫酸法和重铬酸盐氧化法[20]。
BDE-47的测定 强壮前沟藻暴露于BDE-47环境24h后, 取一定体积藻液过滤, BDE-47提取、纯化和测定方法见Chai等[17]。BDE-47的测定设置了实验空白和双平行样, 并采用 2,2’,4,4’,5,5’-六溴联苯醚(BDE-153)做回收率指示剂, 平均回收率为(84±10)%, 数据未采用回收率校正。
1.4 数据处理方法
采用SPSS 16.0软件对结果进行方差检验。
2 结果
2.1 营养盐在培养过程中的变化
在不同氮磷比条件下, 硝酸盐和磷酸盐浓度均呈降低趋势(图1、图2)。氮磷比为1时, 硝酸盐浓度在第8天浓度降低到0.2 µmol/L, 在培养第10天未检出; 其余氮磷比条件下的硝酸盐浓度在培养最后1天的浓度为(4.80—159.50) µmol/L (图1)。根据Justic等[21]提出的浮游微藻生长所需最低氮浓度为 1 µmol/L的标准, 氮磷比为1时, 培养体系在第9天呈现氮限制特征, 其他氮磷比条件未出现氮限制特征。
磷酸盐的变化表明, 培养至第 5天时氮磷比128中的磷酸盐浓度降低到0.04 µmol/L, 在第6至第10天未检出; 氮磷比64条件下的磷酸盐浓度在培养第 9天时为 0.30 µmol/L, 在最后 1天未检出;氮磷比16时, 在培养第9天的浓度为0.95 µmol/L,到最后1天降低到0.04 µmol/L; 而在其他氮磷比条件下的磷酸盐在第10天的浓度为(0.39—0.75) µmol/L。根据微藻生长的磷营养盐阈值为0.1 µmol/L的标准[21],在氮磷比为128条件下强壮前沟藻生长在第6至第10天一直受到磷限制, 而氮磷比为64在最后1天出现了磷限制特征, 氮磷比为 16时虽然在培养最后的浓度为 0.04 µmol/L, 但在第 9天时的浓度仍为0.95 µmol/L, 因此可能未受到明显的磷限制。
2.2 不同氮磷比下强壮前沟藻的密度和比生长率
培养第1天强壮前沟藻密度没有显著差异(图3),约为2.0×104cells/mL。第2至第6天微藻进入对数生长期, 氮磷比1、4、16条件下的细胞密度高于64、128条件下约0.5倍。第9至第10天微藻基本进入稳定期, 各氮磷比下的细胞密度均出现显著差异,氮磷比为16时的密度高达14.0×104cells/mL, 氮磷比为128是的密度最低, 仅为6.8×104cells/mL。
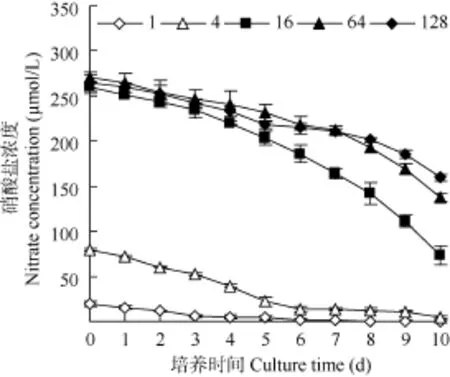
图1 不同氮磷比条件下培养过程中硝酸盐的浓度变化Fig. 1 The change of nitrate concentration under different N/P ratios during cultivation

图2 不同氮磷比条件下培养过程中磷酸盐的浓度变化Fig. 2 The change of phosphate concentration under different N/P ratios during cultivation
在不同氮磷比下强壮前沟藻的比生长率也出现一定的差异(图 4), 其中氮磷比为 16时的平均和最大比生长率均最高, 分别为 0.20和 0.49/d; 其次是在氮磷比为1和4条件下, 平均比生长率为(0.17—0.18)/d, 最大比生长率为0.36/d; 比生长率最低的氮磷比条件为 64和 128, 平均比生长率为(0.11—0.13)/d, 最大比生长率为(0.26—0.30)/d。因此, 强壮前沟藻的生长在最适氮磷比 16时的密度和比生长率最高, 在低氮磷比条件下略低, 在高氮磷比条件下最低。
2.3 不同氮磷比下强壮前沟藻的脂类和碳水化合物含量
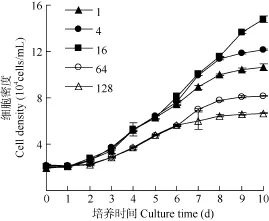
图3 不同氮磷比条件下强壮前沟藻的细胞密度Fig. 3 The cell density of Amphidinium carterae Hulburt under different N/P ratios during cultivation
不同氮磷比条件下强壮前沟藻细胞脂类含量见图 5, 在强壮前沟藻生长的适应期, 细胞内脂类含量范围在 7.8—9.8 mg/(108cells), 其中氮磷比为 16时的脂类含量最低, 但总体上没有出现显著差异(P>0.05); 对数期氮磷比128时的脂类含量为12.9 mg/ (108cells), 显著高于其他氮磷比; 稳定期氮磷比 64和128的脂类含量分别为11.2和13.1 mg/(108cells), 而氮磷比1、4和16时为7.8—8.8 mg/(108cells), 在高氮磷比的脂类含量显著升高(P<0.05)。与脂类相似,适应期细胞内碳水化合物没有显著差异(图6), 范围为0.7—0.8 mg/(108cells); 在对数期和稳定期, 氮磷比64和128时的碳水化合物含量分别为1.4—1.5 mg/ (108cells)和1.5—1.8 mg/(108cells), 显著高于其他氮磷比 (P<0.05)。 总体上, 在各氮磷比下适应期强壮前沟藻的脂类和碳水化合物含量无显著差异; 在对数期和稳定期, 高氮磷比时的两种生化成分含量显著升高。

图 4 不同氮磷比条件下强壮前沟藻的平均比生长率和最大比生长率Fig. 4 The average and maximum specific growth rate of Amphidinium carterae Hulburt under different N/P ratios during cultivation

图5 不同氮磷比条件下强壮前沟藻细胞脂类含量Fig. 5 Cellular lipid of Amphidinium carterae Hulburt under different N/P ratios
2.4 不同氮磷比下强壮前沟藻对BDE-47的富集量
不同氮磷比下强壮前沟藻对 BDE-47的富集量见图 7, 适应期氮磷比为 16时的细胞富集量为1.3 ng/(106cells), 显著低于其他氮磷比(P<0.05);对数期时, 氮磷比64和128的富集量分别为2.5和2.6 ng/(106cells), 在其他条件下为 1.5—1.8 ng/ (106cells),在高氮磷比条件下强壮前沟藻对 BDE-47的富集量显著升高 (P<0.05); 与对数期相似, 稳定期的富集量也是在氮磷比64、128时显著高于其他氮磷比(P<0.05), 约是其他条件下的 2.4倍, 其中氮磷比128时的富集量最高, 为3.6 ng/(106cells)。

图6 不同氮磷比条件下强壮前沟藻细胞碳水化合物含量Fig. 6 Cellular carbohydrate of Amphidinium carterae Hulburt under different N/P ratios

图7 不同氮磷比条件下强壮前沟藻细胞对BDE-47的富集量Fig. 7 The bioaccumulated BDE-47 amount in Amphidinium carterae Hulburt under different N/P ratios
在不同氮磷比下强壮前沟藻对 BDE-47的富集量与脂类和碳水化合物含量之间呈一定的正相关关系(图8), 随着生化成分含量的增加, BDE-47富集量呈上升趋势。与碳水化合物相比, 强壮前沟藻对BDE-47的富集量与脂类的正相关关系更良好, 线性拟合回归系数接近0.6。
3 讨论
3.1 营养盐结构对微藻细胞富集有机污染物的影响
Lynn等[13]报道, 在低磷、低硅环境中培养的硅藻极小冠盘藻 Stephanodiscus minutulus细胞对2,2’,6,6’-四氯联苯的富集量分别是高磷、硅环境中的1.7和2.6倍, 同时发现在低氮环境下富集量也高于高营养环境, 但差异较小。Datta[15]在硅藻梅尼小环藻Cyclotella meneghiniana对2,2’,4,4’,5,5’-六氯联苯的富集研究中发现了相似的规律, 即细胞富集量在低硅环境中>低磷>低氮>高营养。但 Kilham[14]对硅藻固定化菱形藻 Nitzschia sp.富集氘代的多氯代二苯并呋喃时发现富集量在低硅环境中>高营养>低磷, 规律略有不同, 这可能是由于研究采用的微藻和有机物种类均不同。葛蔚等[16]研究了不同氮浓度下硅藻牟氏角毛藻Chaetoceros muelleri对2,2’,4,4’, 5-五溴联苯醚的富集量, 发现随着氮浓度的升高,细胞富集量呈降低趋势。Chai等[17]发现, 在缺氮、缺磷环境中, 甲藻东海原甲藻 Prorocentrum donghaiense对三种多溴联苯醚同系物的富集量均显著高于高氮、磷环境。因此, 当营养盐限制或匮乏时,微藻对有机物的富集量可能升高。本研究也发现了相似的规律, 由于初始氮磷比的差异, 培养过程中氮、磷浓度发生了变化(图1、图2), 导致氮磷比64时强壮前沟藻的生长在稳定期受到了磷的限制, 氮磷比128时在对数期和稳定期均受到严重的磷限制,使得强壮前沟藻在对数期和稳定期时对多溴联苯醚的富集量显著升高(图7); 同时氮磷比为1时微藻的生长在稳定期受到了氮限制(图1), 使得对多溴联苯醚的富集量也略高于氮磷比为4和16时, 但差异不明显(图7)。

图8 强壮前沟藻细胞BDE-47的富集量与生化成分的关系Fig. 8 Relationship of bioaccumulated BDE-47 amount and biochemical composition content in Amphidinium carterae Hulburt under different N/P ratios
3.2 营养盐结构对微藻细胞生长和生化成分的影响
Redfield等曾提出微藻生长的最适氮磷比为16,当氮磷比低于 16时氮可能是微藻生长的限制性营养盐, 高于16时则磷可能是限制性因素[22]。但由于微藻对氮、磷的吸收率存在差异, 不同微藻生长的最适氮磷比也不同。研究发现, 东海原甲藻、球形棕囊藻和尖刺拟菱形藻的最适氮磷比分别为30、30和 10[23], 而新月柱鞘藻、青岛大扁藻和米氏凯伦藻分别在氮磷比160、4和80时细胞比生长速率最快[24]。在本研究中, 氮磷比为16时, 强壮前沟藻生长的种群密度最大, 其次是在低氮磷比时, 而在高氮磷比下种群密度显著降低(图 3); 与密度相似, 强壮前沟藻的最大和平均比生长率均是在氮磷比为 16时最高, 在氮磷比为64 和128等高氮磷比下较低。
氮磷比除影响微藻的种群密度和比生长率外,还影响了其脂类和碳水化合物等生化成分的含量。研究发现, 东海原甲藻Prorocentrum donghaiense在低氮磷比时的总脂和总碳水化合物含量是氮磷比16时的 2倍[20], 同时, 高氮磷比也会导致绿色巴夫藻Pavlova viridis脂类和碳水化合物的增加[25]; 也有研究发现, 虽然硅藻 Bacillariophyceae和普林藻Prymnesiophyceae在磷限制环境中脂类含量增加了,但绿色鞭毛藻N. atomus 和Tetraselmis sp.却降低了[26], 这可能是由于微藻生化成分对氮磷比的响应存在种间差异。在本研究中强壮前沟藻在适应期不同氮磷比下脂类和碳水化合物含量没有出现显著差异, 但在对数期和稳定期, 高氮磷比条件下其含量均显著升高, 而低氮磷比时的变化不明显(图3)。由于脂类和碳水化合物是微藻作为能量用来储存的,当环境中的营养盐匮乏或限制时, 其含量可能会升高, 以使微藻渡过恶劣环境[27]。在本研究中, 尽管氮磷比为 1时在稳定期微藻受到一定的氮限制, 但生化成分的变化不明显; 但在氮磷比为64和128等高氮磷比条件下, 在对数期和稳定期微藻受到磷限制, 导致其脂类和碳水化合物显著升高, 这可能是由于与氮限制相比, 强壮前沟藻的生长和生化成分含量对磷限制更为敏感。
3.3 微藻对有机污染物的富集与其生长和生化成分的关系
生物富集有机污染物的主要机制是有机化合物在生物的脂类物质中和水中的分配。研究发现, 多环芳烃、二氯联苯、有机氯等有机污染物通常富集在脂类含量丰富的水生生物中, 在同一生物中则脂类含量高的生物组织中富集因子较高[28—30]。本研究也发现, 微藻富集的 BDE-47与其脂类含量呈一定的正相关关系(图8)。营养盐结构导致了强壮前沟藻细胞中脂类的变化, 而脂类与微藻富集的有机物呈正相关关系, 因此, 营养盐结构最终导致其对BDE-47富集量的改变。此外, 微藻对有机物的富集还与其生长有关。研究发现, 当微藻的生长速率超过对有机物的吸收速率时, 微藻细胞内的有机物含量降低, 即生长稀释作用[31]。在本研究中, 当氮磷比为16时, 强壮前沟藻的最大和平均比生长率均最高(图 4), 这可能也是导致该氮磷比条件下的 BDE-47含量较低的原因。
4 结论
氮磷比对不同生长时期的强壮前沟藻富集多溴联苯醚具有影响, 在强壮前沟藻的适应期, 氮磷比16时的强壮前沟藻细胞对 BDE-47的富集量最低,为1.3 ng/(106cells); 在对数期和稳定期, 氮磷比64和 128的富集量显著高于其他氮磷比, 分别是其他氮磷比的1.5和2.4倍, 其中稳定期氮磷比128时的富集量高达3.6 ng/(106cells)。不同氮磷比下强壮前沟藻对 BDE-47的富集量与其生化成分含量之间呈一定的正相关关系, 其中与脂类含量的相关性较高,线性拟合回归系数近0.6。营养盐结构导致了强壮前沟藻的生长和脂类等生化成分变化, 而生化成分含量与BDE-47富集量呈正相关关系, 因此, 营养盐结构导致强壮前沟藻BDE-47富集量的改变。
[1] Lavandier R, Quinete N, Hauser-Davis R A. Polychlorinated biphenyls (PCBs) and Polybrominated Diphenyl ethers (PBDEs) in three fish species from an estuary in the southeastern coast of Brazil [J]. Chemosphere, 2013, 90(9): 2435—2443
[2] Mandalakis M, Atsarou V, Stephanou E G. Airborne PBDEs in specialized occupational settings, houses and outdoor urban areas in Greece [J]. Environmental Pollution, 2008, 155(2): 375—382
[3] Sjödin A, Patterson G D, Bergman A. A review on human exposure to brominated flame retardants-particularly polybrominated diphenyl ether [J]. Environment International, 2003, 29(6): 829—839
[4] Ikonomou M G, Rayne S, Addison R F. Exponential increases of the brominated flame retardants, polybrominated diphenyl ethers, in the Canadian Arctic from 1981 to 2000 [J]. Environmental Science & Technology, 2002, 36(9):1886—1892
[5] She J, Petreas M, Winkler J, et al. PBDEs in the San Francisco bay area: measurements in harbor seal blubber and human breast adipose tissue [J]. Chemosphere, 2002, 46(5): 697—708
[6] Besis A, Samara C. Polybrominated diphenyl ethers (PBDEs) in the indoor and outdoor environments - A review on occurrence and human exposure [J]. Environmental Pollution, 2012, 169: 217—229
[7] Li Q Z, Yan C Z, Luo Z X, et al. Occurrence and levels of polybrominated diphenyl ethers (PBDEs) in recent sediments and marine organisms from Xiamen offshore areas, China [J]. Marine Pollution Bulletin, 2010, 60(3): 464—469
[8] Guan Y F, Tu X Y, Wu H H. Distribution and source of polybrominated diphenyl ethers (PBDEs) in riverine water of the Pearl River Delta [J]. Ecology and Environmental Sciences, 2011, 20(3): 474—479 [管玉峰, 涂秀云, 吴宏海.珠江入海口水体中多溴联苯醚及其来源分析. 生态环境学报, 2011, 20(3): 474—479]
[9] Chen S J, Chen Z M, Mai B X, et al. Polybrominated diphenyl ethers in surface sediments of the Yangtze River Delta: Levels, distribution and potential hydrodynamic influence [J]. Environmental Pollution, 2006, 144(3): 951—957
[10] Guan Y F, Samuel Sojinu O S, Li S M, et al. Fate of polybrominated diphenyl ethers in the environment of the Pearl River Estuary, South China [J]. Environmental Pollution, 2009, 157(7): 2166—2172
[11] Guo J Y, Wu F C, Mai B X, et al. Polybrominated diphenyl ethers in seafood products of South China [J]. Journal of Agricultural and Food Chemistry, 2007, 55(22): 9152—9158
[12] Meng X Z, Yu L P, Guo Y, et al. Congener-specific distribution of polybrominated diphenyl ethers in fish of China: Implication for input sources [J]. Environmental Toxicology and Chemistry, 2008, 27(1): 67—72
[13] Lynn S G, Price D J, Birge W J, et al. Effect of nutrient availability on the uptake of PCB congener 2,2’,6,6’-tetrachlorobiphenyl by a diatom (Stephanodiscus minutulus) and transfer to a zooplankton (Daphnia pulicaria) [J]. Aquatic Toxicology, 2007, 83(1): 24—32
[14] Kilham S S. Effects of physiological state on the bioaccumulation of toxic chemicals in algae and their transfer to zooplankton [J]. Verhandlungen–Internationale Vereinigung für theoretische und angewandte Limnologie, 1998, 26(4): 1734—1736
[15] Datta S. Relationship Between PCB Uptake and Nutrient Limitation in Three Algal Species [D]. Ph.D. Thesis. Drexel University, Philadelphia, PA, USA. 2001
[16] Ge W, Chai C, Dong C. Effects of nitrogen concentration on bioconcentration of 2,2′,4,4′,5-pentabromodiphenyl ether by Chaetoceros muelleri [J]. China Environmental Science, 2012, 32(10):1882—1887 [葛蔚, 柴超, 董超. 氮浓度对牟氏角毛藻富集 2,2′,4,4′,5-五溴联苯醚的影响. 中国环境科学, 2012, 32(10):1882—1887]
[17] Chai C, Yin X D, Ge W, et al. Effects of nitrogen and phosphorus concentrations on the bioaccumulation of polybrominated diphenyl ethers by Prorocentrum donghaiense [J]. Journal of Environmental Sciences, 2013, 25(2): 376—385
[18] Holmes R M, McClelland J W, Peterson B J. Seasonal and annual fluxes of nutrients and organic matter from large rivers to the arctic ocean and surrounding seas [J]. Estuaries and Coasts, 2012, 35(2): 369—382
[19] Chai C, Yu Z M, Shen Z L, et al. Nutrient characteristics in the Yangtze River Estuary and the adjacent East China Sea before and after impoundment of the Three Gorges Dam [J]. Science of the Total Environment, 2009,407: 4687—4695
[20] Zhao Y F, Yu Z M, Song X X, et al. Biochemical compositions of two dominant bloom-forming species isolated from the Yangtze River Estuary in response to different nutrient conditions [J]. Journal of Experimental Marine Biology and Ecology, 2009, 3689(1): 30—36
[21] Justic D, Rabalais N N, Turner R E, et al. Changes in nutrient structure of river–dominated coastal waters: stoichiometric nutrient balance and its consequences [J]. Estuarine, Coastal and Shelf Science, 1995, 40(3): 339—356
[22] Redfield A C, Ketchum b H, Richards F A. The Influence of Organism on the Composition of Seawater [M]. In: Hill M N (Eds.), The Sea. New York: John Wiley. 1963, 26—77
[23] Hu Z X, Xun N, Li A F, et al. Effects of different N:P ratios on the growth of Pseudo-nitzschia pungens, Prorocentrum donghaiense and Phaeocystis globos [J]. Acta Hydrobiologica Sinica, 2008, 32(4): 482—487 [胡章喜, 徐宁, 李爱芬,等. 氮磷比率对3种典型赤潮藻生长的影响. 水生生物学报, 2008, 32(4): 482—487]
[24] Sun J, Liu D Y, Chen Z T, et al. Growth of Platymonas helgolandica var. tsingtaoensis, Cylindrotheca closterium and Karenia mikimotoi and their survival strategies under different N/P ratios [J]. Chinese Journal of Applied Ecology, 2004, 15(11): 2122—2126 [孙军, 刘东艳, 陈宗涛, 等. 不同氮磷比率对青岛大扁藻、新月柱鞘藻和米氏凯伦藻生长影响及其生存策略研究. 应用生态学报, 2004, 15(11): 2122—2126]
[25] Li M, Gong R, Rao X, et al. Effects of nitrate concentration on growth and fatty acid composition of the marine microalgae Pavlova viridis (Prymnesiophyceae) [J]. Annals of Microbiology, 2005, 55(1): 51—55
[26] Reitan K I, Rainuzzo J R, Olsen Y. Effect of nutrient limitation on fatty acid and lipid content of marine microalgae [J]. Journal of Phycology, 1994, 30(6): 972—979
[27] Lai J X, Yu Z M, Song X X, et al. Responses of the growth and biochemical composition of Prorocentrum donghaiense to different nitrogen and phosphorus concentrations [J]. Journal of Experimental Marine Biology and Ecology, 2011,405(1-2): 6—17
[28] Arnot J A, Gobas F A P C. A review of bioconcentration factor (BCF) and bioaccumulation factor (BAF) assessments for organic chemicals in aquatic organisms [J]. Environmental Reviews, 2006, 14(4): 257—297
[29] Rotander A, Bavel B V, Polder A. Polybrominated diphenyl ethers (PBDEs) in marine mammals from Arctic and North Atlantic regions, 1986—2009 [J]. Environment International, 2012, 40: 102—109
[30] Borga K, Fisk A T, Hoekstra P F, et al. Biological and chemical factors of importance in the bioaccumulation and trophic transfer of persistent organochlorine contaminants in arctic marine food webs [J]. Environmental Toxicology and Chemistry, 2004, 23(10): 2367—2385
[31] Swackhamer D L, Skoglund R S. Bioaccumulation of PCBs by algae: kinetics versus equilibrium [J]. Environmental Toxicology and Chemistry, 1993, 12(5): 831—838
EFFECTS OF N/P RATIOS ON BIOACCUMULATION OF 2,2’,4, 4’–TETRABROMODIPHENYL ETHER BY AMPHIDINIUM CARTERAE HULBURT IN DIFFERENT GROWTH PHASES
GE Wei1, CHAI Chao2, YIN Xun-Dong2and CHANG Jing2
(1. College of Life Science, Qingdao Agricultural University, Qingdao 266109, China; 2. College of Resource and Environment, Qingdao Agricultural University, Qingdao 266109, China)
In this study we explored the bioaccumulation of 2,2’,4,4’–Tetrabromodiphenyl ether (BDE-47) by Amphidinium carterae Hulburt under different N/P ratios (1, 4, 16, 64, 128) in different growth phases. Specifically we examined the algal specific growth rate and the biochemical composition including lipid and carbohydrate, as well as the relationship between the amount of bioaccumulated BDE-47 and the biochemical composition. The results showed that the amount of bioaccumulated BDE-47 was 1.3 ng/(106 cells) when the N/P ratio was 16 in the lag phase which was significantly lower than those under other N/P ratios. In the log and stationary phase, the bioaccumulated BDE-47 under N/P ratios of 64 and 128 was significantly richer than those under other ratios. Under the two N/P ratios mentioned above, the amounts of bioaccumulated BDE-47 in the log [2.5—2.6 ng/(106 cells)] and stationary phases were 1.5 and 2.4 times higher than those under other N/P ratios respectively. It reached to 3.6 ng/(106 cells) under N/P ratio of 128 in stationary phases. There was a positive correlation between the amount of bioaccumulated BDE-47 and cellular lipid, with the R2 value of nearly 0.6. Our results showed that the lipid content was positively correlated with the bioaccumulation of BDE-47; therefore the N/P ratio could affect the amount of bioaccumulated BDE-47 by altering the lipid content.
N/P ratio; Polybrominated diphenyl ethers (PBDEs); Bioaccumulation; Microalgae
X171.5
A
1000-3207(2014)05-0841-07
10.7541/2014.126
2013-07-10;
2013-12-22
国家自然科学基金项目(40906061); 山东省“两区”建设专项资金项目(2011-黄-19); 青岛市公共领域科技支撑计划(12-1-3-64-nsh); 青岛农业大学高层次人才启动基金项目(630642)资助
葛蔚(1971—), 男, 黑龙江省伊春人; 副教授; 主要从事生物化学方面研究。E-mail: gwi2050@126.com
柴超, E-mail: chaichao1999@126.com
- 水生生物学报的其它文章
- GILL MEDIATES IMMUNE RESPONSES AFTER GRASS CARP REOVIRUS CHALLENGE IN GRASS CARP (CTENOPHARYNGODON IDELLA)
- MORPHOLOGICAL OBSERVATION AND RBCL SEQUENCE ANALYSIS OF A NEW SPECIES FROM CHINA, GRATELOUPIA BOAOENSIS WANG ET LUAN SP. NOV.(HALYMENIACEAE, RHODOPHYTA)
- GILL MEDIATES IMMUNE RESPONSES AFTER GRASS CARP REOVIRUS CHALLENGE IN GRASS CARP (CTENOPHARYNGODON IDELLA)
- 养殖密度对俄罗斯鲟幼鱼的生长、生理和免疫指标的影响
- 一种快速构建集胞藻6803 petBD必需基因定点突变株的方法
- 大通湖环棱螺的次级生产力

