中国番茄黄化曲叶病毒利用根吸收法诱导基因沉默(VIGS)的初步研究
中国番茄黄化曲叶病毒利用根吸收法诱导基因沉默(VIGS)的初步研究
张召军 王晓彬 王慧 刘林 张心阁 何秀霞
(长春理工大学生命科学技术学院,长春 130022)
以含硫黄素酶Su基因的中国番茄黄化曲叶病毒卫星DNA作为载体,通过冻融法将其转化到农杆菌中,利用根部吸收法进行农杆菌侵染,对农杆菌介导的病毒诱导基因沉默体系进行了优化,探讨对病毒诱导基因沉默效率的影响。结果显示以OD600值为1.5的含质粒pBinPLUS-2mβ-Su,pBinPLUS-1.7A的农杆菌菌液1∶1混合进行根部吸收法侵染22-25 d的番茄幼苗,目的基因Su沉默导致番茄幼苗出现光漂白现象,半定量RT- PCR检测目的基因Su mRNA被显著降解,该体系的建立有利于对植物基因进行高通量功能分析。
病毒诱导基因沉默 硫黄素酶Su基因 根吸收法
植物病毒侵染植物体后,植物将启动转录后基因沉默机制(Post-transcriptional gene silencing,PTGS)进行防御,随着病毒基因组的复制而沉默掉病毒的某些功能基因。根据植物的这种防御机制,可对植物病毒进行改造,使其携带植物的内源性基因,随着PTGS的进行就可以将内源的同源基因沉默,从而引起植物表型变化,进一步根据表型变化来推测基因功能,这种利用病毒载体来使植物内源基因沉默的方法被称为病毒诱导的基因沉默(virus-induced gene silencing,VlGS)[1-4]。 国内 外在烟草(Nicotiana tabacum)[5,6]、番茄(Solanum lycopersicum)[7,8]、马铃薯(Solanum tuberosum)[9]、辣椒(Capsicum annuum)[10,11]等植物幼苗中已成功建立病毒诱导的基因沉默体系,但多采用传统的注射法,该方法会伤害到植物本身而造成沉默效率较低,不宜对幼苗进行操作,采取根部吸收法可以避免上述缺点。但利用根吸收法诱导基因沉默的研究报道还比较少[12,13],为此展开相关研究。
1 材料与方法
1.1 材料
番茄种子由市面上购买。大肠杆菌DH5α菌种,农杆菌EH101菌种由本实验室保存;pBinPLUS-2mβ-Su,pBinPLUS-1.7A质粒由浙江大学周雪平教授惠赠。PCR检测病毒组分中的1.7A和DNAmβ及Su基因引物参考陶小荣论文[14]。
1.2 方法
1.2.1 质粒DNA转化农杆菌 将质粒pBinPLUS-2mβ-Su,pBinPLUS-1.7A利用冻融法分别转化农杆菌EHA101感受态。转化后涂含50 mg/L卡那霉素和50 mg/L利福平的培养基平板,37℃倒置过夜培养。1.2.2 番茄幼苗的培养 番茄种子经75%酒精1 min,10%次氯酸钠15 min灭菌后,播种于1/2MS培养基上。10 d后,将生成的无菌苗无土培养,转到人工气候室中生长。
1.2.3 根部吸收法侵染番茄幼苗 挑取含pBinPLUS-2mβ-Su,pBinPLUS-1.7A质粒的农杆菌 EH101单菌落,接种于5 mL含有50 mg/L卡那霉素和50 mg/L利福平的LB液体培养基中,28℃过夜培养。按1∶1的比例混匀,室温放置2-3 h后,选取农杆菌OD600值依次为0.5,0.75,1.0,1.25,1.5,1.75,2.0,对21株番茄幼苗进行侵染效率分析,确定最佳侵染浓度。为了使番茄在侵染期能更好地吸收农杆菌菌液,先将要被侵染的番茄幼苗脱水1-2 d。侵染时,将番茄植株移入到装满农杆菌菌液4 mL的EP管中,暗室培养24 h,有利于农杆菌的侵染,后转入正常培养。沉默症状出现后进行统计,确定最佳农杆菌侵染浓度。以确定的最佳侵染浓度对生长16-40 d的番茄幼苗进行农杆菌侵染,确定最佳侵染苗龄。
1.2.4 植株基因组DNA提取 在硫黄素酶(Su)基因沉默植株症状表现后,1.5 mL的离心管扣取植株顶端的少许新叶,将1 mL 枪头用酒精灯熔化并凝固成圆头,充分研磨离心管中的叶片,利用CTAB法提取基因组DNA,溶于20 μL无菌离子水中。
1.2.5 PCR检测基因组DNA中的病毒成分 PCR筛选中国番茄黄化曲叶病毒诱导的硫黄素酶(Su)基因沉默植株中病毒组分中的1.7A 的引物为PA、PB。PCR 扩增程序为95℃,5 min;95℃,45 s,52℃,30 s,72℃,45 s,35 cycle;72℃,10 min。对所提取基因组DNA 进行病毒组分中DNAmβ的检测所用引物为Beta01和Beta02,PCR 扩增程序中除72℃,90 s外其余同1.7A扩增条件。两个PCR 反应使用同一体系。组分为:10 ×PCR buffer 2.5 μL:ddH2O 19.3 μL;Taq plus 0.2 μL;引物1(10 pmol/L)1 μL;引物2(10 pmol/L)1 μL;dNTP 0.5 μL;模板质粒0.5 μL;终体积为25 μL。
1.2.6 植株总RNA的提取与半定量RT-PCR检测根据Trizol试剂盒提供的操作手册进行总RNA的提取,提取完成后进行琼脂糖凝胶电泳鉴定。利用TaKaRa反转录试剂盒进行反转录:MgCl22 μL;RNase Free dH2O 3.75 μL;10×RT buffer 1 μL;dNTP Mixture( 各 10 mmol/L)1 μL;RNase Inhibitor 0.25 μL;AMV Random Transcriptase 0.5 μL;Oligo dTAdaptor Primer 0.5 μL;试验样品RNA(≤1 μg total RNA)1 μL;终体积为10 μL。反转录条件为:30℃,10 min;42℃,25 min;99℃,5 min;5℃,5 min;all 1 cycle。以延长因子-1-α(Elongation factor l-alpha 1 gene,EF-1-α)作为半定量RT-PCR的内参。以Su的引物对反转录合成的cDNA进行半定量RTPCR,在15、18、21、24、27和30个PCR循环时分别取出8 μL PCR反应产物。PCR产物经0.8%琼脂糖电泳检测后凝胶成像。
2 结果
2.1 农杆菌最佳接种浓度的测定
对21株幼苗进行不同浓度农杆菌侵染效率的分析,结果(图1)表明,农杆菌的OD600值在1.5时的沉默效率最高,农杆菌的OD600在1.0以下时沉默效率较低,在大于1.75左右时对植物细胞有一定的毒害作用,导致番茄幼苗萎蔫或者坏死。

图1 农杆菌浓度(OD值)与沉默效率的关系
2.2 番茄苗龄对VIGS效率的影响
选择生长16-40 d的番茄进行农杆菌侵染,沉默症状(图2)出现后进行统计,结果(图3)表明番茄幼苗在22-25 d时,用OD值在1.5附近的农杆菌侵染时,沉默效率可达84%。

图2 Su基因沉默症状的番茄植株

图3 番茄苗龄与沉默效率的关系
2.3 番茄基因组DNA的提取结果
将样品直接放入1.5 mL 的离心管中研磨,保证研磨充分。结果(图4)显示提取的DNA有降解,但是不会影响后续试验。
图4 接种Su 番茄植株基因组DNA.
2.4 PCR检测基因组DNA中的病毒成分
以提取的番茄叶片DNA 为模板,扩增中国番茄黄化曲叶病毒诱导的硫黄素酶(Su)基因沉默植株中病毒组分中的DNAmβ(图5)和1.7A(图6),片段大小分别为1 300 bp、500 bp。初步表明病毒成分已经整合到番茄基因组中,所检测含有两种病毒组分的植株在外观上都有硫黄素酶(Su)基因沉默的症状(植株黄化)表现(图2)。
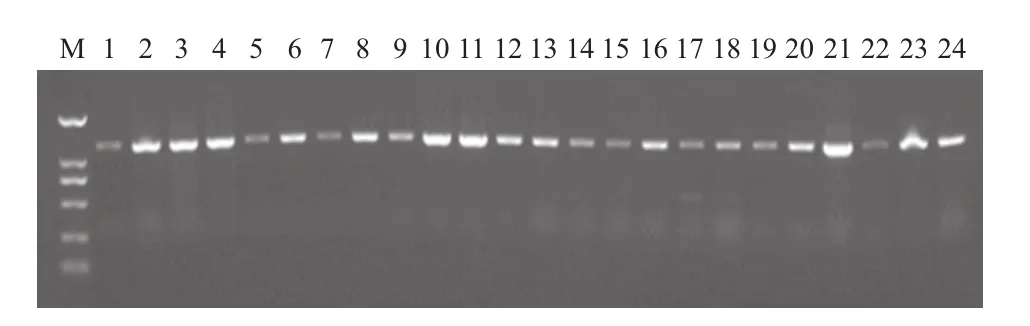
图5 接种Su番茄植株基因组中的DNAmβ组分的Beta 01、Beta 02的PCR鉴定

图6 接种Su番茄植株基因组中的DNA-A的1.7A片段的P A、P B 的PCR鉴定
2.5 转化植株半定量RT-PCR检测
Trizol法提取总RNA,琼脂糖凝胶电泳观察结果(图7)显示,所提取的总RNA完整未降解,有3条电泳带,从上到下分别为28S,18S和5S。
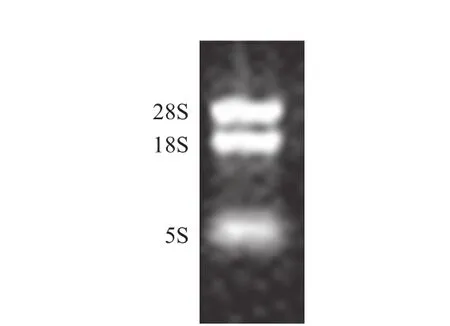
图7 总RNA提取结果
以Su的引物对反转录合成的cDNA进行半定量RT-PCR(图8),看到未接种植株的Su的表达量要显著高于Su基因沉默植株的表达量,差异显著。
3 讨论
农杆菌最佳侵染浓度OD600为1.5左右,高于常规农杆菌侵染菌液为OD600=0.5-1,分析原因可
能的是由于植物不断生长,侵染的农杆菌菌液浓度略高于常规的侵染浓度才能达到整体植物侵染的要求[15]。处于22-25 d的番茄幼苗具有最佳感受农杆菌的能力,农杆菌侵染要求植物细胞必须处于感受状态(即选择合适的苗龄),如果植物苗龄过大,除了番茄的细胞感受能力下降外,植物的节间变长,延长了病毒沉默信号传导的途径,导致沉默的效率下降。由此可见苗龄对沉默效率有重要的影响[16]。
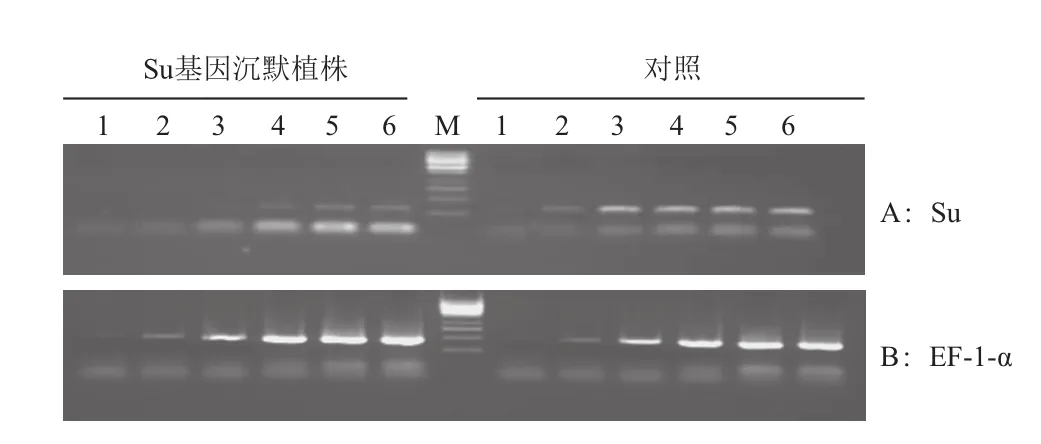
图8 Su基因沉默的番茄植株的半定量RT-PCR检测
传统的注射法是常用的病毒诱导基因沉默的农杆菌侵染方法,但这种方法会伤害到植物本身而造成沉默效率较低,不宜对幼苗进行操作。本试验采取的根部吸收法是通过植物的根浸润在携带有番茄黄化曲叶病毒卫星DNA载体的农杆菌重悬液中,利用植物本身的传递将沉默信号传递到叶茎部,成功地诱导了Su基因沉默,对植物本身没有伤害,可以对浸润注射无法接种的更小幼苗进行接种,因此适用的植物范围更广。例如,Ryu等[17]利用TRV病毒载体通过根吸收法成功的在本氏烟和其他重要的经济作物如番茄、辣椒、烟草、矮牵牛等茄科及豆科植物中诱导了八氢番茄红素脱氢酶PDS基因沉默。为此根吸收法有助于快速大规模cDNA文库分析。
4 结论
通过根吸收法进行农杆菌侵染诱导番茄植株发生RNA沉默,该体系的建立有利于对植物基因进行高通量功能分析。
[1] Baulcombe DC. Fast forward genetics based on virus-induced gene silencing[J].Curr Opin Plant Biol, 1999, 2(2):109-113.
[2] Dinesh-kumar SP, Anandalakshmi R, Marathe R, et al. Virus-induced gene silencing[J].Methods Mol Biol, 2003, 236:287-293.
[3] Fu DQ, Zhu BZ, Zhu HL, et al. Virus-induced gene silencing in tomato fruit[J].The Plant Journal, 2005, 43(2):299-308.
[4] 陶小荣, 周雪平, 崔晓峰, 等.病毒诱导的基因沉默及其在植物基因功能研究中的应用[J].生物化学与生物物理进展, 2004, 31(9):777-783.
[5] 周晓馥, 王兴智. 病毒载体诱导转录后基因沉默系统的建立及烟草基因功能的研究[J].分子植物育种, 2003, 1(3):423-424.
[6] 傅达奇, 朱本忠, 赵晓丹, 等. 病毒诱导烟草的基因沉默[J].西北植物学报, 2005, 25(8):1517-1520.
[7] Brigneti G, Martin-Hernandez AM, et al.Virus-induced gene silencing in Solanum species[J].Plant J, 2004, 39(2):264-272.
[8] 程维舜, 徐秋芳, 等. 适于烟草脆裂病毒诱导的本氏烟基因沉默分析的对照载体构建[J].浙江大学学报, 2012, 38(1):10-20.
[9] Brigneti G, Martín-Hernández AM, Jin H, et al. Virus-induced gene silencing in Solanum species[J].Plant J, 2004, 39(2):264-272.
[10] Chung E, Seong E, Kim YC, et al. A methodof high frequency virus-induced gene silencing in chili pepper Capsicum annuum Lcvbukang[J]. Mol Cell, 2004, 17(23):377-380.
[11] Constantin GD, Krath BN, MacFarlane SA, et al. Virus-induced gene silencing as a tool for functional genomics in a legume species[J]. Plant J, 2004, 40(4):622-631.
[12] 燕飞, 宋雪梅, 成卓敏.番茄丛矮病毒p19蛋白抑制转录后基因沉默作用机制[J].病毒学报, 2005, 21(5):403-405.
[13] 杨美英, 贺红霞, 王艳, 等.番茄茄红素β-环化酶基因高效沉默载体构建[J].分子植物育种, 2007, 5(1):43-46.
[14] 陶小荣, 钱亚娟, 等.卫星沉默载体的改良及其改变矮牵牛叶色和花色的研究[J].科学通报, 2006, 51(17):2041-2044.
[15] 黄昌军, 钱亚娟, 李正和, 等.病毒诱导的基因沉默及其在植物功能基因组研究中的应用[J].中国科学, 2012, 42(1):3-15.
[16] Fu DQ, Zhu BZ, Zhu HL, et al. Enhancement of virus-induced gene silencing through low temperature and low humidity in tomato[J]. Mol Cells, 2006, 21(2):153-160.
[17] Ryu CM, Anand A, Kang L, et al. Agrodrench:a novel and effective agroinoculation method for virus-induced gene silencing in roots and diverse Solanaceous species[J].Plant J, 2004, 40(2):322-331.
(责任编辑 李楠)
Study on Chinese Tomato Yellow Leaf Curl Virus-induced Gene Silencing( VIGS) via Root Absorption
Zhang Zhaojun Wang Xiaobin Wang Hui Liu Lin Zhang Xinge He Xiuxia
(College of Life Science,Changchun University of Science and Technology,Changchun 130022)
The tomato yellow leaf curl virus satellite DNA was used as vector which containing the Su gene, and transformed the plasmid into Agrobacterium by freeze thawing method. Agrobacterium infected plants via root absorption, and virus-induced gene silencing system was optimized, twexplore the influence to virus-induced gene silencing efficiency. The results showed infected 22-25 days tomato seedling via OD6001.5 Agrobacterium-mediated root-absorption which containing plasmid pBinPLUS-2mβ-Su and pBinPLUS-1.7A, the silencing of Su gene resulted in photo-blcached young leaves of tomato plants. Semi-quantitative RT-PCR analysis was employed to test the effect of Su gene silencing, which showed that Su gene was degraed significantly. This gene-silencing system would benefit for the high-throughput analysis of plant gene.
Virus-induced gene silencing Su gene Root absorption method
2013-09-18
大学生创新实验项目(2012X77),吉林省科技厅项目(20110244)
张召军,男,生物技术专业;E-mail:zhangzhaojunk@qq.com
何秀霞,博士,副教授,硕士生导师,研究方向:分子生物学及生物检测;E-mail:chinese_hxx@sohu.com

