农杆菌介导韭菜遗传转化相关因素的研究
农杆菌介导韭菜遗传转化相关因素的研究
常婧1高行英1李小东2侯雷平1李梅兰1
(1.山西农业大学园艺学院,太谷 030801;2.方兴现代农业有限公司,长治 046600)
以“汉中冬韭”韭菜品种为试验材料,用含有pCAMBIA3301质粒的根癌农杆菌菌株EHA105对影响韭菜遗传转化效率的多种因素进行研究。结果表明,诱导40 d的愈伤组织,GUS基因瞬时表达率达到93%,且最适宜于不定芽的分化;当乙酰丁香酮(AS)的浓度为100 μmol/L时,愈伤的GUS表达率达到91%,植株再生率为7.9%,AS浓度增加时其值也不会增加;菌液OD600值为0.6侵染10 min时,与其他组合相比,外植体受伤程度小,GUS表达率及再生率最高;侵染后的愈伤共培养3 d后,农杆菌生长较少,GUS表达率为91.1%,而再生率达到7.2%,为最佳的共培养时间。通过试验得到韭菜遗传转化因素的最佳条件,为今后的遗传转化提供一些参考。
韭菜 农杆菌 GUS染色 遗传转化
韭菜(Allium tuberosumRottl. Ex Spreng)别名草钟乳、起阳草,是百合科葱属多年生宿根草本植物,具有一种特殊而且强烈的韭香气味,主要以叶片、假茎供食,为我国特有的一种蔬菜[1]。韭菜不仅营养丰富,而且具有多方面的保健功能[2]。另外,韭菜的自然群体内缺乏有效的抗病、虫、草等基因,因此应用转基因技术进行韭菜新品种的开发是相当必要的。
目前国内外关于韭菜遗传转化的研究较少。仅张松等[3]以GUS报告基因建立了农杆菌介导韭菜转化体系,尚没有转基因品种成功的报道。但葱蒜类其他作物的遗传转化已经比较成熟,尤其是洋葱和大蒜[4]。迄今为止,已经成功获得了抗除草剂[5]、抗虫[6]和抗逆性[7]等多个品种,尽管转化的方法法有基因枪法和农杆菌介导法,但大多数采用的是农杆菌介导的方法。由于农杆菌介导法具有简便、
单拷贝等优点,已经广泛应用于植物的遗传转化中,但是该方法的建立需要高效的再生系统作为前提。因此,本试验就影响农杆菌介导韭菜遗传转化效率的主要因素包括愈伤组织大小、乙酰丁香酮(AS)浓度、菌液浓度和侵染时间及共培养时间等进行研究,得到韭菜遗传转化的最佳因素,为今后的研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株 试验采用韭菜品种“汉中冬韭”,种子购于山西省侯马市农人种业有限公司。供试根癌农杆菌菌株为EHA105,内含pCAMBIA3301载体,该载体携带有选择标记Bar 基因和GUS报告基因。
1.1.2 培养基 本试验过程中所用的培养基,见表1。

表1 韭菜遗传转化培养基
各种培养基配好后,在121℃高温高压灭菌20 min,其中AS、头孢霉素(Cef)和草丁膦(PPT)在培养基灭菌后降温到55℃时再加入。
1.2 方法
1.2.1 韭菜愈伤组织诱导 将韭菜种子冲洗干净,
在75% 乙醇中消毒30 s,无菌水冲洗3-5次,再用含0.1 % 升汞和0.1 % Tween-20的混合溶液消毒10 min,无菌水冲洗3-5次,消毒后的种子放置在播种培养基中,黑暗环境生长2 d后,转移到光照条件下培养。7 d左右,种子萌发生长获得1 cm左右无菌胚根,切取胚根尖1.5-2 mm放置诱愈培养基中诱导愈伤组织用于转化。
1.2.2 农杆菌培养与活化 取30 μL EHA105原菌接种到30 mL LB(含50 mg/L卡那霉素和100 mg/L利福平)液体培养基中,在28℃ 200 r/min震荡培养。16 h后,菌株处于对数生长期,此时活性最高,OD600值在1.2-1.5之间,5 000 r/min离心5 min。倒掉上清液,重新悬浮于诱导培养基中,于200 r/min震荡培养活化4 h即可用于转化。
1.2.3 愈伤组织大小对转化的影响 将分别培养10、20、30、40、60 d的愈伤组织(图1-A)切成2 mm大小,在活化的菌液(OD600=0.6)中侵染10 min,用滤纸吸干多余的菌液,放置在共培养基中25℃黑暗培养3 d。之后将愈伤组织转移到选择培养基中,选择培养7 d后,随机抽取20个愈伤外植体进行GUS染色,检测GUS基因的瞬时表达率。之后,2周转接一次,培养30 d左右后,统计韭菜愈伤组织的再生率(图1-B)。
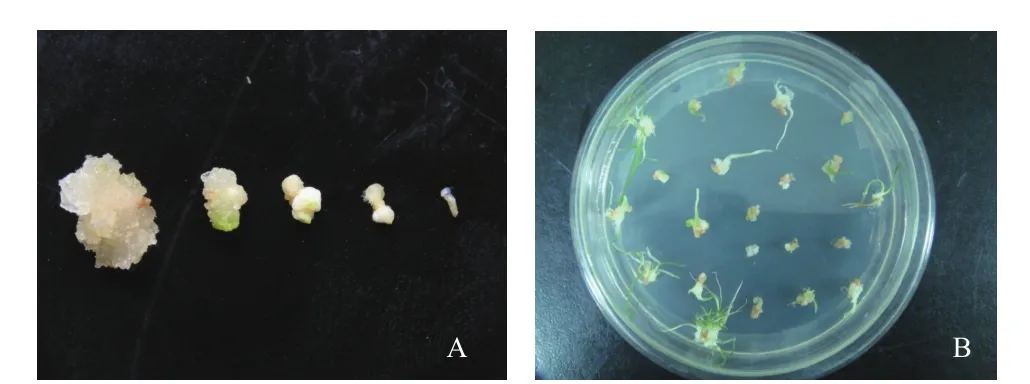
图1 愈伤组织及不定芽的分化
1.2.4 乙酰丁香酮浓度对转化的影响 在诱导培养基和共培养中分别加入0、100、200 μmol/L的AS用于侵染和共培养,共9个试验组合。将愈伤组织在含不同浓度AS的诱导培养基中侵染10 min,之后步骤及统计观察同1.2.3。
1.2.5 农杆菌菌液浓度对转化的影响 将摇好的菌液重悬于诱导培养基中活化后,将菌液OD600值分别调节到0.1、0.2、0.4、0.6、0.8和1.0,分别与40 d大小的愈伤组织(切成2 mm大小)侵染10 min,之后步骤及统计观察同1.2.3。
1.2.6 农杆菌侵染时间对转化的影响 将40 d大小的愈伤组织切成2 mm的小块,与OD600为0.6菌液分别侵染0、5、10、15、20 min,之后步骤及统计观察同1.2.3。
1.2.7 共培养时间对转化的影响 将40 d大小愈伤组织切成2 mm的小块,与OD600为0.6菌液侵染10 min,分别共培养0、1、2、3、4、5 d,之后步骤及统计观察同1.2.3。
1.2.8 愈伤组织的GUS染色 将愈伤组织浸没于GUS染色液中,置于37℃恒温箱中过夜,次日用70% 乙醇脱色,观察GUS染色的效果。
2 结果
2.1 韭菜愈伤组织大小对遗传转化的影响
由韭菜胚根尖诱导不同时期愈伤组织的GUS染色效果(图2)表明,愈伤培养10 d时,愈伤组织仅有很少面积呈现蓝色;培养20 d时,愈伤的染色面积明显增加;随着培养时间的增加,愈伤经过切割后,菌液侵染切面GUS染色的面积会更大。统计结果表明(表2),愈伤培养10 d时,GUS瞬时表达仅有55%;随着培养时间的增加,GUS瞬时表达显著提高;培养40 d时,GUS瞬时表达率达到93%;培养时间进一步延长,GUS瞬时表达率不再增加。
观察植株转化后的再生,培养10 d的愈伤经侵染后褐化严重,逐渐死亡,仅有1.07%再生;培养20和30 d的愈伤侵染后,愈伤组织褐化减少,植株再生率分别达到3.13%和4.93%;当愈伤培养40 d时,再生率达到最大为7.21%。培养60 d时,愈伤组织的褐化率较低,但愈伤分化不定芽反而下降。综上所述,在韭菜遗传转化过程中,采用培养40 d的愈伤组织为最佳。
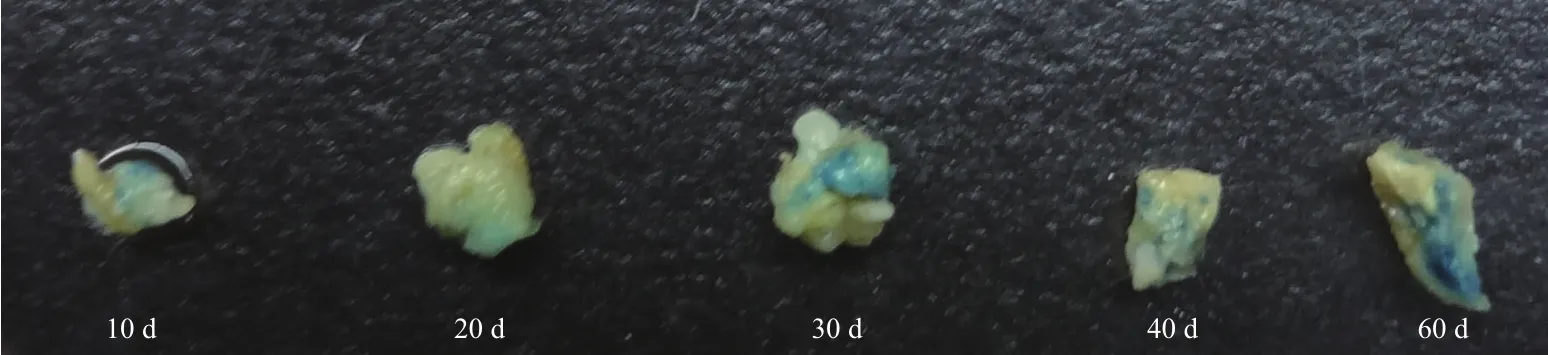
图2 不同愈伤组织大小GUS染色的效果

表2 愈伤组织大小对转化的影响
2.2 乙酰丁香酮对韭菜遗传转化的影响
不同乙酰丁香酮浓度下韭菜愈伤的GUS染色(表3)表明,当诱导和共培养基中都不含AS时,愈伤染色面积小且颜色较浅,GUS染色率仅有32.5%;仅在诱导培养基中加入AS时,当AS为100 μmol/L时染色率为53.6%,当AS为200 μmol/L时,染色率提高为72.9%,但颜色依然较浅;仅在共培养基中加入AS时,当AS为100 μmol/L时染色率为66.2%,当AS为200 μmol/L时,染色效果提高显著为84.4%,且随着浓度的升高颜色变深;当诱导和共培养基中同时加入AS时,GUS染色率达到91%以上,愈伤组织的染色面积增大,且蓝色很深。因此,从GUS染色的提高程度看,共培养基中添加AS对转化的影响效果更高。
统计植株再生的结果(表3)表明,当诱导和共培养基中都不含AS时,大部分愈伤组织选择培养1周后严重褐化,再生率仅有0.4%;当仅在诱导或共培养基中加入AS时,再生率都随着AS的增加不断地提高;当诱导和共培养基中AS浓度为100 μmol/L时,植株再生率达到7.9%;浓度进一步增加时,再生率达到8.0%左右与之前并没有显著增加。因此,在韭菜遗传转化中需要诱导和共培养基中同时加入100或200 μmol/L AS,考虑到成本,韭菜转化中AS最佳浓度为100 μmol/L。
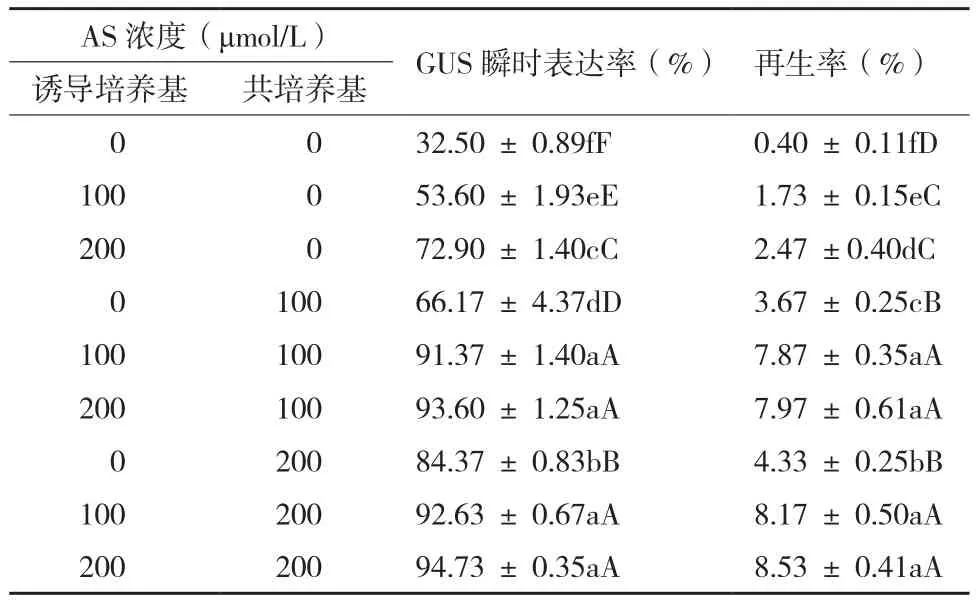
表3 乙酰丁香酮浓度对转化的影响
2.3 菌液浓度对韭菜遗传转化的影响
不同菌液浓度侵染后韭菜愈伤GUS染色效果及百分率表明,当菌液OD600为0.1时,组织染色面积小,颜色比较浅(图3),GUS基因的瞬时表达率为44.0%(表4);随着菌液浓度的增加,染色位点越多,颜色也越深,菌液OD600为0.6时,GUS瞬时表达率达到90%;当菌液OD600为0.8时,整个愈伤块已完全染色,但是GUS基因的表达没有显著增加。
从韭菜愈伤再生方面,当OD600为0.1时,愈伤的再生率仅有1.4%;当OD600为0.6时,愈伤的分化达到7%,显著的高于其他组合;浓度较低时,附着在愈伤表面的农杆菌较少,基因未整合到植株体内,在抗生素的作用下愈伤逐渐褐化死亡;菌液浓度过高时,附着在愈伤表面的菌液过多,不利除菌反而影响愈伤的再生效果。综合各方面因素,OD600值为0.6是最适的菌液浓度。
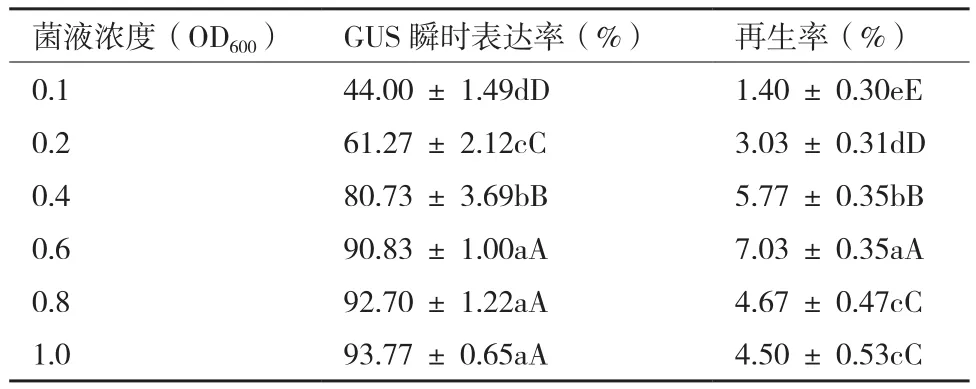
表4 菌液浓度对韭菜转化的影响
2.4 侵染时间对韭菜遗传转化的影响
不同侵染时间下愈伤的GUS染色效果(图4)表明,未经过侵染的愈伤染色后呈现白色,外植体无伤害,GUS瞬时表达率与再生率均为0;侵染5 min的组织呈现浅蓝色,GUS瞬时表达率为53.2%(表5),愈伤有较少切口变褐,再生率为3.26%;侵染10 min的愈伤呈现深蓝色,GUS表达率达到90%以上,有部分伤口变褐,组织再生率最高,达到5.92%;侵染15 min以上的愈伤颜色继续增大,GUS瞬时表达率并没有显著增加,愈伤褐化严重,再生率反而减低;总之,随侵染时间的增长,GUS基因瞬时表达率越高,但愈伤受菌液伤害的程度也越严重,再生就越困难。综合上述分析,愈伤组织在菌液中侵染10 min为最佳。外植体受伤程度轻,GUS基因瞬时表达率很高,再生率也最高。
2.5 共培养时间对韭菜遗传转化的影响

图3 不同菌液浓度下(OD600值)韭菜愈伤GUS染色的效果
不同共培养条件下愈伤组织的GUS染色(图5)
表明,共培养0 d时,GUS基因在愈伤组织即有表达,但染色效果较浅,GUS瞬时表达率为40.9%(表6);共培养3 d后,愈伤呈现深蓝色,GUS表达率接近最高值达到91.1%;共培养时间再长时,愈伤蓝色更深,GUS表达不再显著增加。另外,共培养2 d内,农杆菌生长不明显,愈伤分化率低;共培养3 d时,农杆菌生长菌落依稀可见,但不超过外植体周围,再生率达到7.2%;共培养4 d后,在外植体周围出现少量菌落,而共培养5 d后,在外植体周围出现大量菌落,植株再生率反而下降。综合上述分析,共培养3 d后,农杆菌菌落少,GUS瞬时表达率也较高,再生率最高,为转化时共培养的最佳时间。

图4 不同侵染时间下韭菜愈伤GUS染色效果

表5 侵染时间对韭菜转化的影响

图5 不同共培养时间下韭菜愈伤GUS染色效果
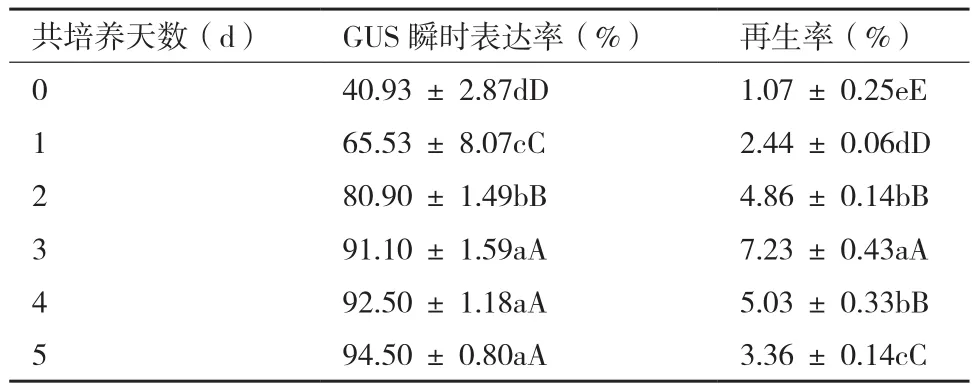
表6 共培养时间对韭菜转化的影响
3 讨论
3.1 愈伤组织培养时间对转化的影响
愈伤组织的大小是影响转化的重要因子,前人的研究表明应用直接诱导的愈伤进行转化效率较低,而愈伤组织经过多代培养后,可能产生体细胞突变且愈伤组织逐渐衰老死亡,不利于转化体筛选,转化效率反而大大降低,所以经过适当继代培养,使细胞处于最佳转化状态来提高转化效率[8]。郑杰[9]在水稻的研究中发现表面光滑、质地致密、粒形好的愈伤组织转化率最高。罗敬萍等[10]用不同龄期的甘蔗愈伤组织进行转化,25 d的愈伤组织为适龄的转化受体。杨爱国等[11]在玉米胚性愈伤的转化中,采用不超过2.0 mm大小的幼胚诱导愈伤组织,经过10-12周不断继代扩繁得到干燥松散、有结构、生长旺盛的愈伤组织进行遗传转化。Aswath等[12]在洋葱的遗传转化中,就采用6周大的愈伤分割成表面积为3 mm2的小块进行转化。本试验研究表明韭菜胚根尖诱导愈伤组织培养40 d后,愈伤组织直径达到5 mm,将其切为2 mm大小的转化效果最佳。
3.2 乙酰丁香酮对转化的影响
乙酰丁香酮是基因转化中提高转化频率及基因
稳定遗传和表达的重要试剂。在众多研究中,AS的浓度一般为50-00 μmol/L,浓度过高反而会影响转化效率或对外植体产生毒害作用[13]。Joubert等[14]研究了AS对洋葱转化的影响,当AS浓度为100 μmol/L时对转化的促进效果最高;而对洋葱幼胚进行转化,AS浓度为250 μmol/L,组织GUS表达率为60%,浓度过高时表达率反而下降。邸宏等[15]对玉米幼胚的转化体系进行优化,得到AS的适宜浓度为200 μmol/L。但是赵军良等[16]在酚类物质对大白菜遗传转化的研究中表明,其中AS转化的影响效果最佳且转化率提高明显,本试验的研究也表明了这一点。本试验在诱导和共培养基中同时加入100 或200 μmol/L时显著性不差异,考虑AS的伤害作用和成本问题,AS的最佳浓度为100 μmol/L,与Joubert等的研究基本一致。
3.3 菌液浓度和侵染时间对转化的影响
菌液浓度和侵染时间是影响遗传转化效率的重要因素。在葱蒜类蔬菜的遗传转化中大多采用的菌液OD600为0.6左右,谭伟等[17]研究表明,当菌液OD600为0.6时,大葱愈伤组织的转化率均值最大。Eady等[15]在韭菜和大蒜转化时,OD500下的菌液浓度为0.5-1.0时效果最佳。对于侵染时间,通常为5-20 min。刘海燕等[19]对洋葱表皮进行转化研究表明,菌液浓度OD600为0.6,侵染20 min时转化率最高;孙传波等[20]在玉米茎尖的转化中表明,当菌液OD600为0.5时,浸泡7 min后抗性芽的生成率最高。同时,张明洲等[21]等在高粱转化体系的优化中也表明,最佳的侵染时间和浓度为OD600为0.5侵染10 min,与本试验结果相一致。
3.4 共培养时间对转化影响
农杆菌共培养是农杆菌进入受体细胞并与其共生的过程,使细菌中的T-DNA转入到受体细胞利于农杆菌侵染受体。附着在外植体表面的农杆菌并不能立刻转化,而需要在组织停留一定时间。王沛雅等[22]的研究表明,当农杆菌与杨树叶盘共培养4 d后,分化率可达80%并可获得较多生长健壮的抗性再生芽。Kondo等[23]研究了共培养1-6 d对大葱愈伤转化的影响表明最佳时间为3 d。此外,王宏伟等[24]进一步研究了共培养时间与温度间的关系,温度为25℃时共培养3 d,GUS 表达率最高;而温度为22℃时共培养5 d,GUS 表达率也较高。本试验是在共培养温度25℃前提下,得到的最佳的共培养时间为3 d,与王宏伟的研究结果一致,而对于共培养温度和时间的关系有待进一步研究。
4 结论
韭菜愈伤组织培养时间40 d后,GUS基因瞬时表达率达到93%,且最适宜于不定芽的分化。侵染韭菜外植体的农杆菌重悬液和共培养基中添加AS能大大提高GUS表达率和再生率,同时AS浓度为100 μmol/L时,愈伤的GUS表达率达到91%,植株再生率为7.9%,AS浓度增加时其值也不会增加。当菌液OD600值为0.6侵染10 min后共培养3 d,外植体受伤程度小,农杆菌生长较少且容易抑制,GUS表达率及再生率最高,为最佳的转化。
[1] 张学智, 张彦良, 李梅兰, 等. 韭菜根再生相关因素的研究[J].分子植物育种, 2013, 11(1):113-118.
[2] 王志敏, 宋明. 韭菜组织培养研究进展[J]. 长江蔬菜, 2003, 9:32-34.
[3] 张松, 达克东, 姜璐琰, 等. 根癌农杆菌介导的韭菜基因转化体系的建立[J]. 园艺学报, 2003, 30(1):39-42.
[4] 高行英, 李梅兰, 王婷婷, 等. 葱蒜类蔬菜遗传转化研究进展[J]. 生物技术通报, 2013(5):1-6.
[5] Eady CC, Davis S, Farrant J, et al. Agrobaeterium tumefaciens-mediated transformation and regeneration of herrbicide resistant onion(Allium cepa)plants[J]. Annals of Applied Biology, 2003, 142:213-217.
[6] Zheng SR, Henken B, Ahn YK, et al. The development of a reproducible Agrobacterium tumefaciens transfomation system for garlic(Allium sativum L.)and transgenic garlic resistant to beet armyworm(Spodoptera exigua Hubner)[J]. Molecular Breeding, 2004, 14:293-307.
[7] 徐启江, 崔成日. 用基因枪法介导OSISAP1基因遗传转化洋葱[J]. 植物生理与分子生物学学报, 2007, 33(3):188- 196.
[8] 李笑寒, 李莉, 宋风顺, 等. 根癌农杆菌介导的水稻转基因技术体系的优化[J]. 生物学杂志, 2011, 28(2):13-16.
[9] 郑杰. 农杆菌介导的高效水稻遗传转化体系的研究[J]. 湖南
农业科学, 2008, 2:6-10.
[10] 罗敬萍, 张树珍, 杨本鹏. 农杆菌介导甘蔗基因转化技术的优化[J]. 热带作物学报, 2003, 24(4):23-28.
[11] 杨爱国, 刘爽, 赵琦, 等. 农杆菌介导玉米胚性愈伤的遗传转化研究[J]. 生物技术通报, 2008(4):104-121.
[12] Aswath CR., Mo SY, Kim DK, et al. Agrobacterium and biolistic transformation of onion using non-antibiotic selection marker phosphomannose isomerase[J]. Plant Cell Reports, 2006, 25:92- 99.
[13] 邓艺, 曾炳山, 赵思东, 等. 乙酰丁香酮在农杆菌介导的遗传转化中的作用机制及应用[J]. 安徽农业科学, 2010, 38(5):2229-2232.
[14] Joubert P, Sangwan RS, Elarabiaouad M, et al. Influence of phenolic compounds on Agrobacterium vir gene induction and onion gene transfer.[J]. Phytochemistry, 1995, 40(6):1623-1628.
[15] 邸宏, 刘昭军, 卢翠华, 等. 农杆菌介导bar 基因转化玉米幼胚的研究[J]. 东北农业大学学报, 2008, 39(2):150-154.
[16] 赵军良, 逯保德, 徐鸿林, 等. 酚类化合物对大白菜遗传转化效率的影响[J]. 华北农学报, 2005, 20(2):19-22.
[17] 谭伟, 赵东, 彭金环, 等. 根癌农杆菌介导的章丘大葱遗传转化体系研究[J]. 山东农业科学, 2009, 8:1-4.
[18] Eady C, Davis S, Catanach A, et al. Agrobacterium tumefaciensmediated transformation of leek(Allium porrum)and garlic(Allium sativum)[J]. Plant Cell Reports, 2005, 24:209-215.
[19] 刘海燕, 冯冬茹, 刘兵, 等. 农杆菌介导的MpASR蛋白在洋葱表皮细胞的定位研究[J]. 热带亚热带植物学报, 2009, 17(3):218- 222.
[20] 孙传波, 李海华, 郭嘉, 等. 农杆菌介导法向玉米茎尖导入抗草甘膦EPSPS基因的研究[J]. 生物技术通报, 2011(3):91-93.
[21] 张明洲, 崔海瑞, 舒庆尧, 等. 高粱茎尖再生体系及其遗传转化影响因子的研究[J]. 核农学报, 2006, 20(1):23- 26.
[22] 王沛雅, 杨晖, 杨涛, 等. 农杆菌介导的河北杨遗传转化体系的建立[J]. 生物技术通报, 2012(3):141-147.
[23] Kondo T, Hasegawa A, Suzuki M. Transformation and regeneration of garlic(Allium sativum L.)by Agrobacterium mediated gene transfer.[J]. Plant Cell Reports, 2000, 19:989-993.
[24] 王宏伟, 梁业红, 史振声, 等. 共培养环境对玉米遗传转化的影响[J]. 西北农业学报, 2011, 20(9):40-42.
(责任编辑 狄艳红)
Research on the Factors Related to Agrobacterium-mediated Genetic Transformation of the Chinese Chive
Chang Jing1Gao Xingying1Li Xiaodong2Hou Leiping1Li Meilan1
(1. College of Horticulture,Shanxi Agriculture University,Taigu 030801;2. Fangxing Modern Agriculture Co. Ltd, Changzhi 046600)
Using “Hanzhong Dongjiu” variety and the Agrobacterium EHA105 containing pCAMBIA3301 plasmid as the material, it studied the factors which could influence transformation efficiency of Chinese chive. The results showed that transient expression rate of GUS gene reached 93% with the callus cultured for 40 d as the explant and the adventitious buds differentiated well. When 100 μmol/L acetosyringone was added to the miedium, GUS expression rate of the callus reached 91% and the plant regeneration rate was 7.9%, but did not increase with increasing of the AS concentration. Compared with other combinations, the calli were soaked in Agrobacterium(OD600≈0.6)for 10 min, the injury degree of explants was slight and the GUS expression rate and regeneration rate were the highest. When the calli were co-cultured for 3 days after infection, the bacterium grew less than other period, GUS expression rate and the regeneration rate were 91.1% and 7.2% respectively. Through the experiment, the best conditions of genetic transformation factors for chinese chive were obtained.
Chinese chive Agrobacterium GUS staining Genetic transformation
2013-09-06
山西省农业科技攻关项目(20090311022,0110311015-1),山西省人事厅人才引进项目
常婧,女,硕士研究生,研究方向:蔬菜育种及生物技术;E-mail:412567956@qq.com
李梅兰,女,博士,教授,博士生导师,研究方向:蔬菜育种及生物技术;E-mail:limeilan_2@hotmail.com

