费尔干猪毛菜病程相关蛋白基因SfPR-1的表达规律和植物表达载体构建
费尔干猪毛菜病程相关蛋白基因SfPR-1的表达规律和植物表达载体构建
王艳 陈西 周莲洁 杨中敏
(新疆大学生命科学与技术学院 新疆生物资源基因工程重点实验室,乌鲁木齐 830046)
采用RT-PCR技术探究盐生植物费尔干猪毛菜病程相关蛋白基因SfPR-1(GenBank登录号:JQ670917)在不同发育时期、组织部位、植物激素、非生物胁迫及生物胁迫处理下的表达规律,以揭示该基因在费尔干猪毛菜生长发育和逆境胁迫下的作用。结果表明,不同组织(根、茎、叶)中,SfPR-1在根中表达量最高,预示该基因可能在根防御中发挥主要作用;SfPR-1在不同发育阶段(种子、种子萌发20 d幼苗、种子萌发30 d幼苗、种子萌发40 d幼苗)的表达特性显示,种子萌发30 d幼苗时,其表达差异最显著,表明其可能在植株后期生长发育中具有重要作用;SfPR-1对不同植物激素(水杨酸SA、茉莉酸JA、脱落酸ABA、乙烯合成前体ACC)均产生了响应,表明该基因在几条主要的抗病防御通路中均发挥作用。非生物胁迫(H2O2、盐、旱、冷)都能够诱导SfPR-1基因的表达,其中对盐响应程度最高。以植源性意大利青霉(Penicillium italicum)进行生物胁迫时,SfPR-1表达呈持续上升趋势。以上结果表明费尔干猪毛菜病程相关蛋白基因SfPR-1是生物与非生物逆境胁迫下均响应的基因,推测其在植物抵御逆境胁迫中发挥重要作用。
费尔干猪毛菜 SfPR-1基因 RT-PCR 表达模式 植物表达载体构建
植物往往暴露于各种各样的胁迫环境中,如病原体和食草动物的侵袭、不利的光照、水分、温度、营养或盐分胁迫。由于它们的固着生活方式,因而必须建立一种快速高效的适应机制[1]。胁迫信
号通常会导致植物体内合成一种或多种主要的次级信号分子如茉莉酸酯JAs[2-4]、乙烯ET[5,6]、水杨酸SA[7]和过氧化氢H2O2[8]。植物通过这些激素介导的信号转导网络促使大量防御相关基因表达引发一系列生理代谢活动从而应对外界胁迫,而其中许多基因在不同的信号通路中表达既有重叠也有差异,因而植物在响应不同刺激胁迫时可能具有相同的信号转导机制[9-11]。
病程相关蛋白(Pathogenesis-Related proteins,PRs)是植物受生物或非生物胁迫后诱导产生并积累的一类蛋白质总称,是植物防卫体系的重要组成部分,与过敏性坏死反应(Hypersensitive response,HR)及系统获得性抗性(Systematic acquired resistance,SAR)密切相关,它的诱导表达常作为SAR建立的标志[12]。病程相关蛋白在植物产生系统抗性、阻止病原物侵染、抵御疾病、响应外界压力以及适应不良环境等方面发挥着重要作用,已成为近年来抗性研究热点之一[13]。根据血清学和序列分析将植物病程关蛋白PRs分为两个亚类[14](酸性病程相关蛋白和碱性病程相关蛋白)和17个基因家族成员[15]。PR-1作为病程相关蛋白的重要家族成员,自1970年首次发现以来,越来越多的试验表明PR-1蛋白是PRs蛋白家族中独特且保守的一类成员[16]。
尽管大多数PR蛋白表现出抗病原菌的生物活性,然而有一些PR蛋白是受发育和植物特定组织器官调控,另一些则受环境刺激因素如机械损伤或冷胁迫等诱导表达。在拟南芥中过表达5种PR蛋白显示,过表达PR-1的植株显示出了对活体营养型和死体营养型两种病原菌的高水平抗性[17],而分别过表达PR-2,3,4,5的植株则与对照无显著性差异,从苹果中分离获得的类似PR-1的基因在受欧文氏菌感染或刺激剂诱导时也均未响应[18],因而目前对PR-1的生物学功能尚不明确[17]。
费尔干猪毛菜(Salsola ferganica)属C4藜科双子叶一年生草本盐生植物,生长于中亚荒漠地区,是适应盐碱生境为数不多的先锋植物之一,作为盐碱地的“生物脱盐器”,它可以在收获时将盐带走,降低土壤含盐量,具有重要的经济和生态价值[19]。课题组前期结合抑制差减杂交[20]和RACE技术[21]克隆获得了费尔干猪毛菜盐响应病程相关蛋白基因SfPR-1(GenBank登录号:JQ670917),本试验拟通过半定量RT-PCR技术探究该基因在不同组织部位、发育时期、植物激素、不同非生物胁迫和生物胁迫下的表达模式,同时构建该基因的植物过表达载体和亚细胞定位载体,将对阐述SfPR-1的生物学功能和作用机制奠定基础。
1 材料与方法
1.1 材料
1.1.1 植物材料 费尔干猪毛菜种子(Salsola ferganicaDrob.)采自新疆103团通古特沙漠,种子播翅后经0.1%升汞表面消毒8 min,灭菌水反复冲洗5-6遍后,于MS培养基中萌发生长。平均培养温度25℃,光照时间16 h/ d,相对湿度40%。除不同发育时期外,其他胁迫材料均取自生长20 d左右的费尔干猪毛菜,以互生叶前四节茎叶作为总RNA提取的材料。
1.1.2 主要试剂和仪器 大肠杆菌(Escherichia coli)DH5α 感受态细胞购于北京全式金生物技术有限公司;植物总RNA提取试剂盒RNAprep pure、RNAFree DNase I和DNA回收试剂盒购自TIANGEN公司;M-MLV 逆转录酶、Ex Taq DNA聚合酶、dNTP、限制性内切酶BamH I、PstI、NcoI、XohI和DL15 000+ 2 000 DNA Marker购自TaKaRa公司;茉莉酸JA、水杨酸SA、脱落酸ABA和卡那霉素购自Sigma-Aldrich公司;乙烯合成前体ACC购自Calbiochem公司;PCR引物由上海生工生物工程技术服务有限公司合成。试验使用的仪器有 PCR 扩增仪、电泳仪、凝胶成像系统、台式离心机、超净工作台等。DNA序列测定委托华大有限公司北京分公司完成。
1.2 方法
1.2.1 植物材料的处理 将无菌培养20 d的费尔干猪毛菜幼苗移至含有终浓度为500 μmol/L SA、50 μmol/L ABA、50 μmol/L ACC、100 μmol/L JA和600 mmol/L NaCl的MS固体培养基上进行胁迫处理;200 μmol/L H2O2则通过喷洒方式对植株胁迫并以只喷洒蒸馏水的植株作为对照,以上胁迫分别在1 h、6 h、24 h取茎叶混合样品。将无菌苗置于4℃进行1 d、3 d低温胁迫处理;将植株移到滤纸上作为干旱处理,胁迫1 h、6 h取茎叶混合样品。
用植源性真菌意大利青霉(Penicillium italicum)作为病原体,在马铃薯液体培养基中培养48 h后,喷洒在植物叶片边缘,处理时间分别为6 h、24 h、48 h,以只喷洒培养基的植株作为对照。
不同发育时期及不同组织部位的植株均以在相同培养条件下的无菌苗为材料,植物种子去翅。以上试验样品取0.1 g左右用锡箔纸包好后液氮速冻,存于-80℃冰箱用于总RNA的提取。每个取样点设3个技术重复,试验共设3次生物学重复。
1.2.2 总RNA的提取与第一链cDNA的合成 按照天根生化科技有限公司植物组织试剂盒(RNAprep pure Tissue Kit)的操作说明并结合该公司的RNAFree DNase I试剂提取植物总RNA,RNA的浓度和纯度用Nano DropTM分光光度计和琼脂糖凝胶电泳进行检测。根据TaKaRa公司M-MLV Reverse Transcriptase反转录的要求合成cDNA第一链(所有样品起始总RNA均为1 μg)。
1.2.3 半定量RT-PCR分析SfPR-1基因的表达模式 针对SfPR-1设计特异引物SfPR-1P1(5'-ATGGCTTTATCAAAAAAGT-3')和SfPR-1P2(5'- TTAGTAAGGTTTTTGGCCA -3'),内参采用费尔干猪毛菜βactin(上游引物β-actinP1:5'-AAGATCTGGCACCACACCTTC-3';下游引物β-actinP2:5'-CACACCATCACCAGAATCGA- 3')。以盐胁迫下处理24 h的cDNA为模板对β-actin基因和SfPR-1基因进行不同循环数的PCR扩增,确定适宜的循环数。采用20 μL扩增体系:上下游引物(10 U/μL)各0.5 μL,dNTP(2.5 mmol/μL)2 μL, 模 板cDNA 1 μL,TaqDNA聚合酶(5 U/μL)0.5 μL,10×buffer(含Mg2+)2 μL,ddH2O 17 μL。扩增程序为:95℃预变性3 min;95℃ 30 s,55℃ 40 s,72℃ 40 s,循环次数依次为23、26、28、30、33和36个循环;72℃延伸7 min,分别取6 μL扩增产物于1%琼脂糖凝胶电泳进行检测,选择SfPR-1和内参基因β-actin半定量RT-PCR处于对数期的循环数。
以各时期、各处理总RNA合成的cDNA为模板进行费尔干猪毛菜SfPR-1基因的半定量RT-PCR表达模式分析。所用引物同上,通过调整内参基因β-actin的亮度确定半定量RT-PCR各处理模板的cDNA用量。2 0 μL反应体系中包括:经内参调整适宜体积的cDNA模板,10×buffer(含Mg2+)2 μL,dNTP 2 μL,SfPR-1P1 0.3 μL,SfPR-1P2 0.3 μL,TaqDNA polymerase 0.3 μL,ddH2O补齐至20 μL,反应程序为:95℃预变性3 min;95℃ 30 s,55℃40 s,72℃ 40 s,共30个循环;72℃延伸7 min,扩增产物于1.5%琼脂糖凝胶电泳进行检测,溴化乙锭染色,凝胶成像系统进行成像。
用相关半定量软件Quantity one图像系统分析半定量结果中各条带的灰度得出灰度值,再用Excel软件求出目的基因条带灰度与内参基因灰度之间的比值。
1.2.4 植物表达载体的构建 用BamH I和PstI双酶切含有这两个酶切位点的SfPR-1PCR产物,将回收的酶切产物与经相同内切酶回收的植物表达载体pCAMIA1301-1连接,使其上游连有花椰菜花叶病毒35S启动子,下游连有NOS终止子,构建成植物表达载体pCAMIA1301-1- SfPR-1,连接产物转化大肠杆菌感受态细胞DH5α,在含有Kan(50 mg/L)的LB培养基上进行筛选,挑取单菌落提取质粒,进行BamH I和PstI双酶切鉴定。
为使SfPR-1基因融合于GFP的N端,在SfPR-1基因上下游引物中分别添加了NcoI酶切位点(下游引物去除密码子)。PCR产物用NcoI酶切后,连接到以相同酶切含有GFP基因的pCAMBIA1302载体上,构建成SfPR-1目的基因C端连有mGFP的融合表达载体pCAMBIA1302- SfPR-1-mGFP。连接产物的转化和筛选同上,挑取单菌落提取质粒,进行NcoI酶切鉴定,同时再以NocI和XohI对重组质粒pCAMIBA1302-SfPR-1-mGFP进行双酶切,鉴定正向插入的克隆。以上酶切正确的克隆送华大有限公司北京分公司进行测序。采用冻融法将pCAMIA1301-1- SfPR-1导入农杆菌EHAl05,为后续花序侵染拟南芥奠定基础。
2 结果
2.1SfPR-1基因在不同组织和发育时期的表达特性SfPR-1在不同组织根、茎、叶中均有表达,其中根中的表达量最高(图1)。以不同发育时期的植株为研究对象,分析SfPR-1是否参与植株的发育过程。图1显示,该基因在种子中表达量最低,萌发
20 d表达量虽有上升但与种子中的表达量并未有显著差异;当植株生长约30 d时,SfPR-1基因表达量出现急剧增加,而当植株长至40 d时,其表达又急剧下降。
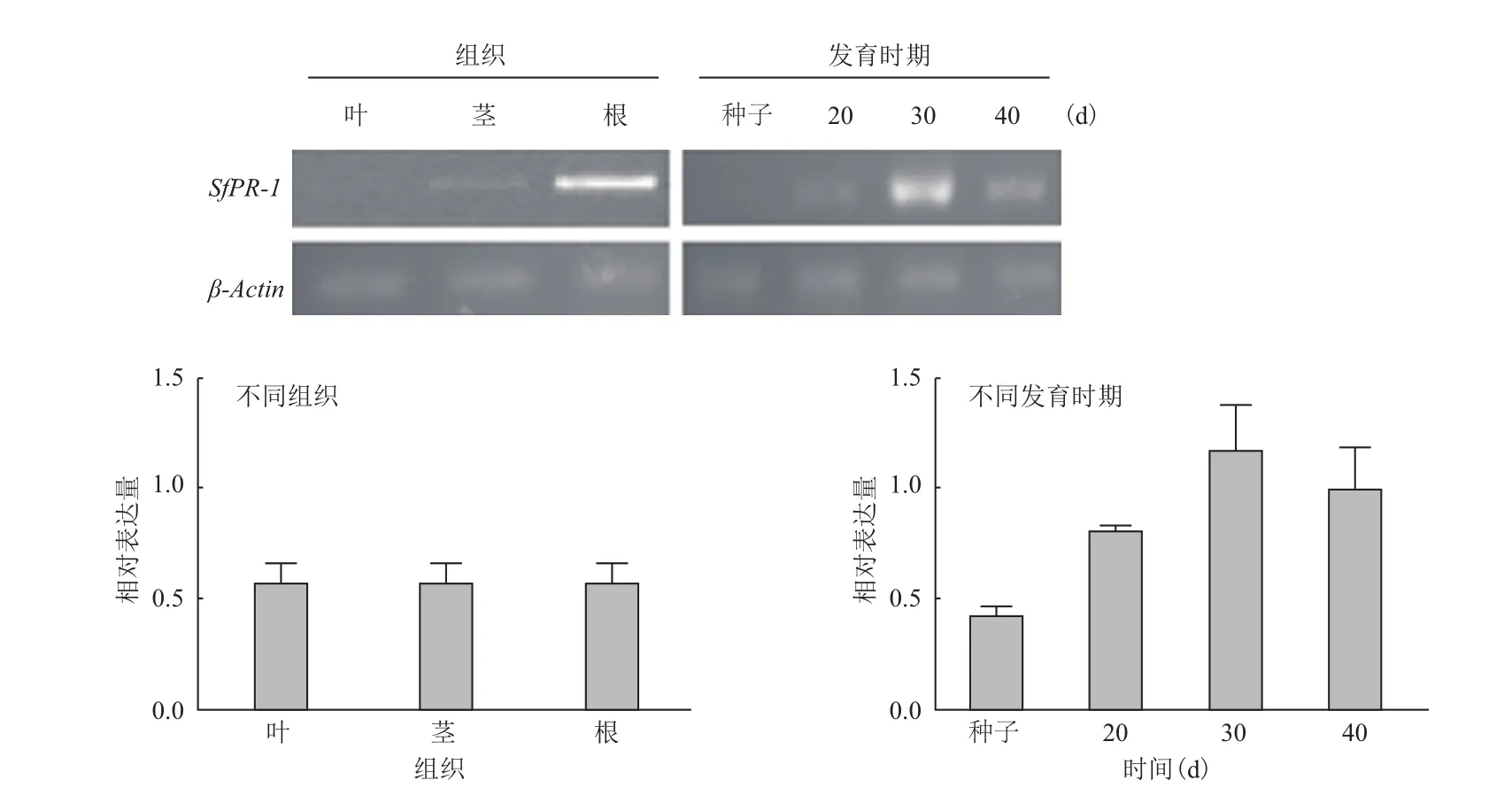
图1 SfPR-1在不同组织和发育时期的表达规律
2.2 SfPR-1在植物激素处理下的表达模式
图2显示,病程相关蛋白SfPR-1对4种植物激素处理均能产生一定程度的响应。50 μmol/L ABA处理时,呈现早期(1 h)响应后下调再上升的趋势,在24 h时表达量达到最高;SfPR-1对ACC和JA的响应都在6 h出现最大值,后期胁迫过程中表达量有所下降但仍高于对照。在所有激素胁迫处理中,只有SfPR-1对SA响应呈现逐渐上升的趋势,且在24 h时表达量最高。
2.3SfPR-1在非生物胁迫下的表达模式
对费尔干猪毛菜进行了4种非生物胁迫,图3显示,其中SfPR-1对盐的响应最为强烈。尽管其他3种胁迫下SfPR-1的响应强度非常近似,但表达模式有所不同。干旱胁迫时SfPR-1呈现持续上调表达;冷胁迫1 d时该基因响应程度达到最大并在处理3 d时下降到正常水平,与之相似的是在H2O2胁迫下,SfPR-1呈现早期响应,在1 h时与对照组出现显著差异,随后一直处于正常表达水平。
2.4 SfPR-1在生物胁迫下的表达模式
生物胁迫处理下,SfPR-1的表达呈持续上升的模式,48 h表达量最高(图4)。
2.5 植物表达载体pCAMBIA1301-1-SfPR-1和
pCAMBIA1302-SfPR-mGFP的构建
将SfPR-1构建至植物表达载体pCAMBIA1301-1中,酶切鉴定片段大小正确(图5),构建成植物表达载体pCAMBIA1301-1-SfPR-1(图6-A),经测序SfPR-1读码框正确。通过设计特异性引物扩增SfPR-1基因,使其融合于GFP的N端构建成融合表达载体pCAMBIA1302-SfPR-1-mGFP(图6-B),酶切鉴定片段大小正确。为进一步确定目的基因连接方向的正确性,采用限制性内切酶XohI和NocI切出了与预计大小一致的目的片段(图5)。
3 讨论
SAR在植物防御外来病原生物入侵中起着关键作用,其中主要通过PRs和植保素完成。在各种PRs中,主要存在于植物组织细胞间隙的PR-1功能尤为突出,因而常常把它作为SAR中重要的标志分子[22,23]。
SfPR-1是从藜科猪毛菜属盐生植物费尔干猪毛菜中分离得到的盐响应病程相关蛋白基因[21]。根据SfPR-1的组织表达特异性,其在根中的表达量最高。由于根与病原体数量最多的土壤接触最为密切,推
测SfPR-1蛋白在根的防御中发挥重要作用。而在不同发育时期SfPR-1表达量并无明显变化,主要在中后期(种子萌发30 d)时有急剧增加,有文献报道病程相关蛋白可能通过酶促反应产生信号分子,在植物形态发育中起内源激发子的作用[24],表明该基因可能与植株发育相关。
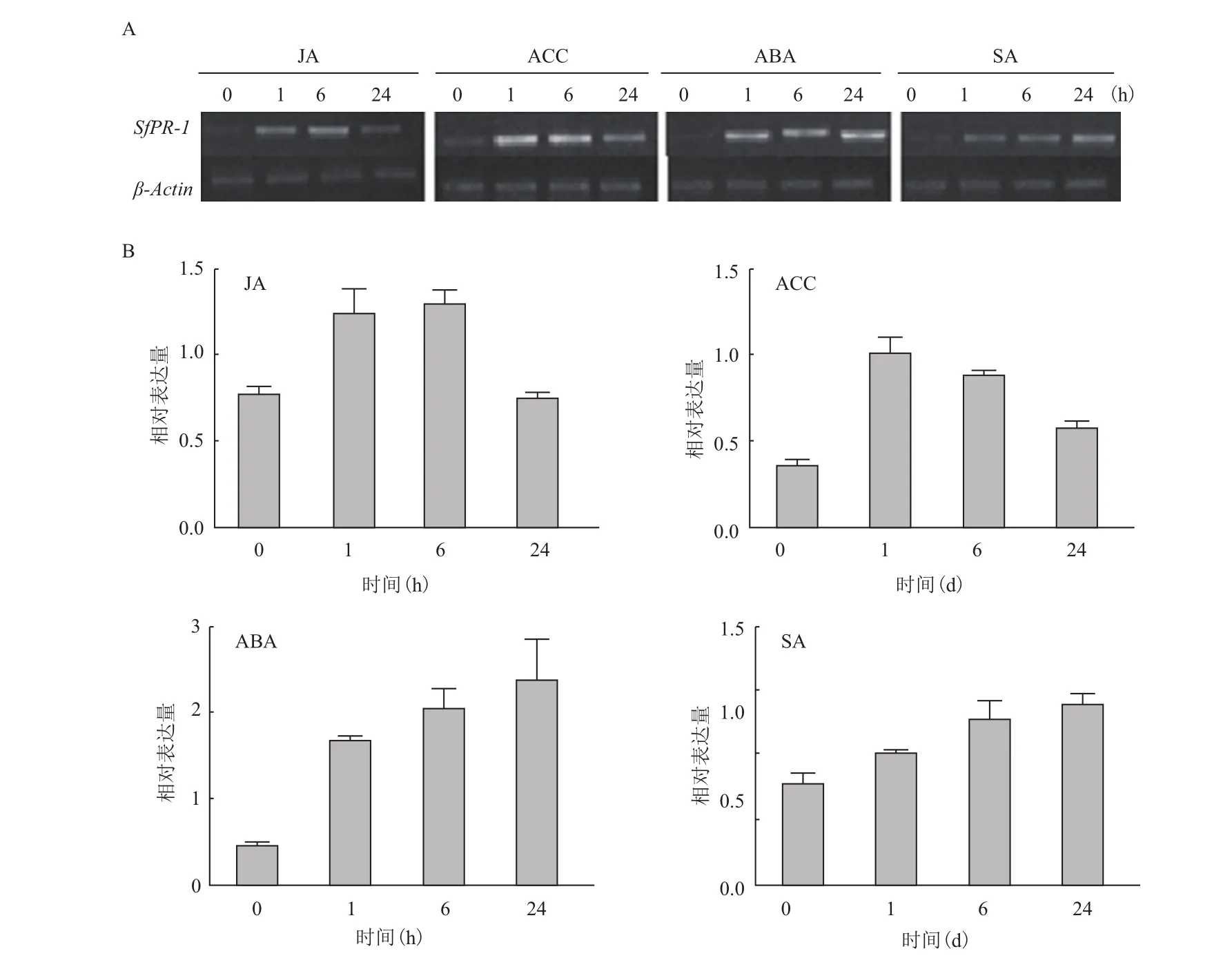
图2 SfPR-1在不同激素处理及不同处理时间下的表达规律
费尔干猪毛菜SfPR-1在不同植物激素、不同非生物胁迫和生物胁迫下的表达模式可归为4类。在冷、H2O2胁迫下,SfPR-1表达呈现早期显著响应的趋势,分别在处理早期1 d和1 h时表达量最高,随着处理时间的延长,其表达量逐渐下降到正常水平。而ACC、JA及NaCl处理下SfPR-1在1-6 h内表达量持续升高并达到最大值,当胁迫到24 h时,SfPR-1表达量有所下降但仍高于对照组。第3种模式是随着胁迫时间的延长SfPR-1表达量逐步升高,这种模式出现在SfPR-1对旱、SA和真菌的胁迫响应中,三者分别在6 h、24 h和48 h达到最大值。所有胁迫处理中只有ABA组中表现为早期(1 h)响应后下调再上升的趋势,6 h虽表达量较低但仍显著高于对照组,并在24 h时达到最高峰。
SA、JA、ACC、ABA和H2O2能够诱导植物防御和胁迫相关基因的表达,在植物系统获得性抗性SAR和非生物胁迫中发挥着重要作用[25]。水杨酸SA是广泛存在于植物体内的一种简单酚类物质,作为植物抗病反应的重要信号分子,激活植物抗逆反应相关的防御机制,在植物信号传导中起着关键作用[26,27],因此被广泛地应用于植物抗性研究。茉莉酸类物质JAs是与抗性密切相关的植物生长类物质,它作为内源信号分子参与植物在机械伤害、病虫害、干旱、盐胁迫、低温等条件下的抗逆反应[28]。当植物受到伤害时,植物体内茉莉酸及其衍生物的含量显著增加,进而诱导一系列与抗逆有关的基因表达。ABA与JA往往具有相似的结构,它们的生理作用也很相似,之间存在协同或者拮抗作用[29]。SfPR-1
在以上植物激素胁迫响应中,基因表达均发生显著增高,提示SfPR-1参与多种激素介导的植物抗病抗逆过程。H2O2是氧化胁迫下产生的一种活性氧物质。植物受到逆境或者伤害时会引起体内H2O2浓度的升高,从而调节PRs等防御相关基因表达,直接杀死入侵病原体或导致生理生化的改变做出植物的早期防御反应[30-32]。本试验中SfPR-1受H2O2早期诱导表达,说明该基因属于H2O2介导的下游响应基因。
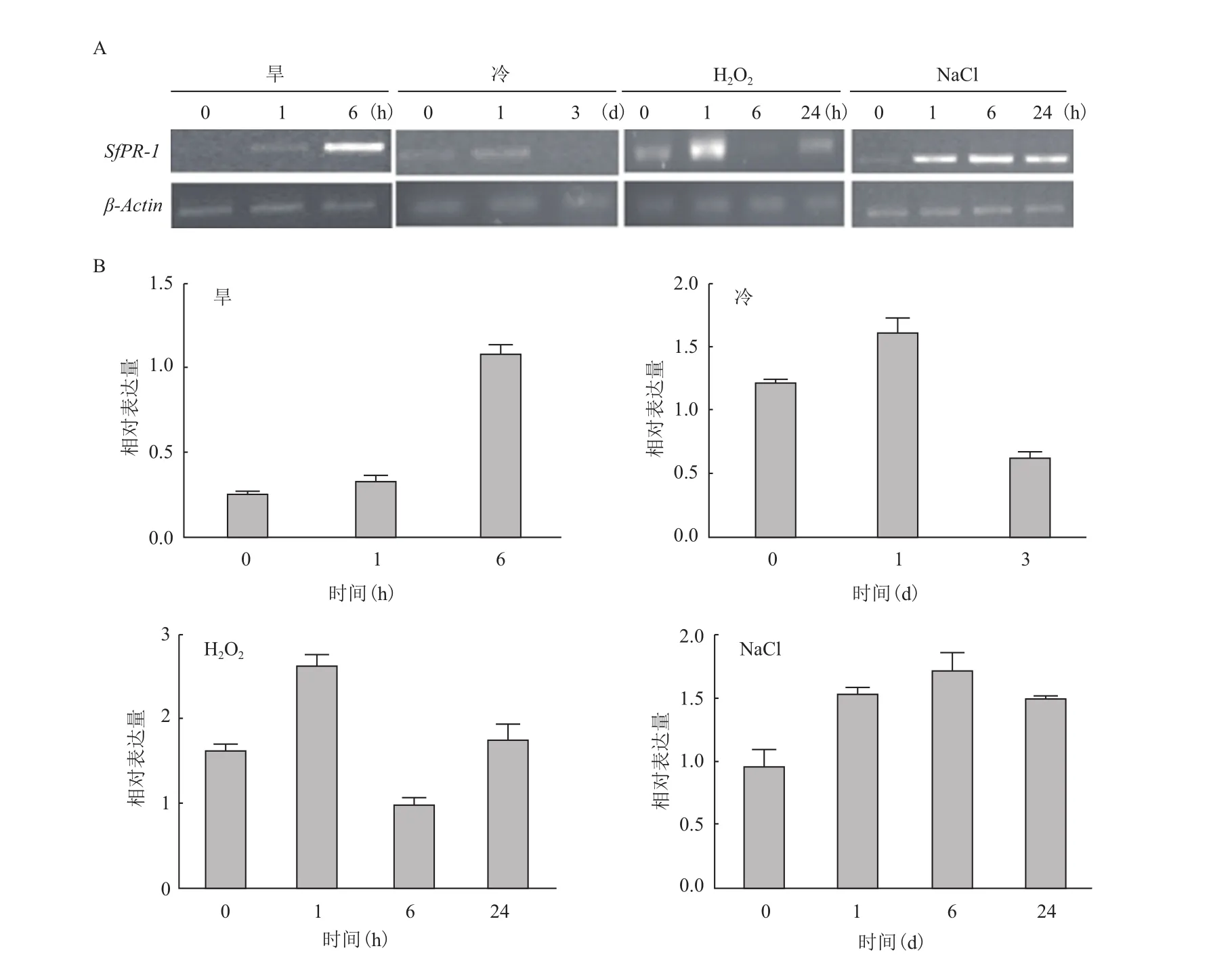
图3 SfPR-1在不同非生物胁迫处理及不同处理时间下的表达规律

图4 SfPR-1在生物胁迫处理不同时间下的表达规律

图5 SfPR-1植物表达载体的酶切鉴定
植物通过SA、JA、ACC和H2O2介导的防御信号通路以响应食草动物和病原体的伤害[33,34],这些通路彼此相互联系,能够以协同或相反的方式发挥
作用[35]。在一些关键信号结点(如PR-1等),可以通过信号通路优先利用最有效的系统对侵袭者进行防御[36]。除此之外,防御途径还与脱落酸ABA、生长素等信号通路相互联系共同作用以加强防御反应的范围和效果[37]。
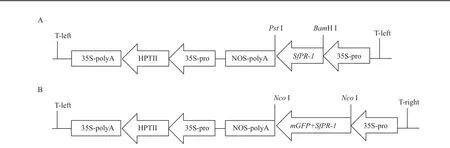
图6 SfPR-1植物表达载体pCAMBIA1301-SfPR-1(A)和pCAMIBA1302-SfPR-1-mGFP(B)构建示意图
SfPR-1在植源性真菌意大利青霉的胁迫下,表达量表现为持续上升并在胁迫后期(48 h)达到最大值,该结果直接证明了SfPR-1能够响应病原体侵袭,推测其在抗病过程中发挥着重要作用。
多数PR基因在植物受到病原体感染和昆虫啃食时表达会发生改变且在转基因植物中显示出对病原体的抗性[38],部分PR-1表现出不明确的受发育和环境的调控的生物学功能[15],如叶片衰老、花粉成熟及冷、渗透和光胁迫[39-41]。除此之外,近年来报道PR-1,PR-2和PR-5蛋白在过冬单子叶植物中大量合成表现出一定的抗冻活性[39,42],有些PR基因甚至能在植物离体组织中持续表达[43]。且高盐胁迫也会影响拟南芥PR-1,PR-2和PR-3的表达,但转基因拟南芥中仅过表达PR-3的植株在种子萌发阶段表现出对盐的抗性[44]。本研究结果显示SfPR-1在不同非生物胁迫如盐、旱、和冷处理下均被诱导表达,推测可能是由于外界刺激使植物内源激素积累从而引起了PR蛋白转录本的积累。
以上结果提示SfPR-1可能处于费尔干猪毛菜体内防御信号的结点位置,这种不同信号分子间的交叉和各个网络间的彼此联系,有助于植物更好地响应和调节各种不利胁迫条件[45,46],暗示其在植物抵御生物和非生物胁迫过程中发挥重要作用。
目前尚无有关盐生植物费尔干猪毛菜病程相关蛋白基因的详细报道,本课题组对SfPR-1基因在不同组织、发育时期及植物激素、不同非生物胁迫和生物胁迫下的表达规律进行研究,根据试验结果,推测费尔干猪毛菜病程相关蛋白基因SfPR-1是生物胁迫与非生物胁迫下交叉响应的基因,但其如何在逆境下发挥作用还有待于进一步深入研究。SfPR-1植物表达载体的构建为该基因的生物学功能鉴定奠定了基础,以上研究不仅对解析盐生植物费尔干猪毛菜耐盐机理和阐明植物适应其他生物逆境的机制有重要作用,也将为培育同时具有抗盐和抗病作物提供重要的候选基因。
4 结论
盐生植物费尔干猪毛菜病程相关蛋白基因sfPR-1在种子萌发30 d的幼苗中表达量增加;不同组织部位中根的表达量最大;该基因对防御信号通路中的几种主要激素和非生物胁迫及生物胁迫均响应。盐生植物费尔干猪毛菜病程相关蛋白基因sfPR-1是生物胁迫与非生物胁迫下交叉响应的基因。
[1] Johan M. Regulation of gene expression by jasmonate hormones[J]. Phytochemistry, 2009, 70:1560-1570.
[2] Balbi V, Devoto A. Jasmonate signalling network in Arabidopsis thaliana:crucial regulatory nodes and new physiological scenarios[J]. New Phytol, 2008, 177:301-318.
[3] Turner JG, Ellis C, Devoto A. The jasmonate signal pathway[J]. Plant Cell, 2002, 14:153-S164.
[4] Wasternack C. Jasmonates:an update on biosynthesis, signal transduction and action in plant stress response, growth and development[J]. Ann Bot, 2007, 100:681-697.
[5] Wang KL, Li H, Ecker JR. Ethylene biosynthesis and signaling
networks[J]. Plant Cell(Suppl.), 2002, 14:S131-S151.
[6] Guo H, Ecker JR. The ethylene signaling pathway:new insights[J]. Curr Opin Plant Biol, 2004, 7:40-49.
[7] Shah J. The salicylic acid loop in plant defense[J]. Curr Opin Plant Biol, 2003, 6:365-371.
[8] Laura MT, Flor de Dalia DF, Angela María CO, et al. Oxidative and molecular responses in Capsicum annuum L. after hydrogen peroxide, salicylic acid and chitosan foliar applications[J]. Int J Mol Sci, 2013, 14:10178-10196.
[9] Kunkel BN, Brooks DM. Cross talk between signaling pathways in pathogen defense[J]. Curr Opin Plant Biol, 2002, 5:325-331.
[10] Pieterse CMJ, Leon-Reyes Avander ES, Van Wees SCM. Networking by small-molecule hormones in plant immunity[J]. Nat Chem Biol, 2009, 5:308-316.
[11] Lai Y, Dang FF, Lin J, et al. Overexpression of a Chinese cabbage BrERF11 transcription factor enhances disease resistance to Ralstonia solanacearum in tobacco[J]. Plant Physiol Bioch, 2013, 62:70-78.
[12] Heath MC. Hypersensitive response-related death[J]. Plant Mol Biol, 2000, 44:321-334.
[13] Edreva AA. Novel strategy for plant protection:induced resistance[J]. J Cell Mol Biol, 2004, 3:61-69.
[14] Sato F, Koiwa H, Sakai Y, et al. Synthesis and secretion of tobacco neutral PR-5 protein by transgenic tobacco and yeast[J]. Biochem Biophys Res Commum, 1995, 211:909-913.
[15] Van Loon LC, Rep M and Pieterse CM. Significance of inducible defense-related proteins in infected plants[J]. Annu Rev Phytopathol, 2006, 44:135-162.
[16] 包丽媛, 张家为. 植物病程相关蛋白1基因家族特性的研究进展[J]. 甘肃农业科技, 2009, 1:34-36.
[17] Hamamouch N, Li C, Seo PL, et al. Expression of Arabidopsis pathogenesis-related genes during nematode infection[J]. Mol Plant Pathol, 2011, 12(4):355-364.
[18] Bonasera JM, Kim JF, Beer SV. PR genes of apple:identification and expression in response to elicitors and inoculation with Erwinia amylovora. BMC Plant Biol, 2006, 6:23.
[19] 黄俊华.中国猪毛菜属植物的地理分布特点[J]. 干旱区地理, 2005, 28(3):325-329.
[20] Guan B, Jiang GQ, Wang YX, et al. Identification of differentially expressed transcripts involved in the salt-stress response of Salsola ferganica by suppression subtractive hybridization[J]. Plant Cell Tiss Org, 2010, 103(3):343-352.
[21] 王艳, 陈西, 杨中敏, 等. 费尔干猪毛菜病程相关蛋白基因(SfPR-1)的克隆及在盐胁迫下的表达[J]. 植物科学学报, 2013, 31(2):164-170.
[22] Tanabe S, Hayashi N, Nishizawa Y, et al. Elicitor and catalase activity of conidia suspensions of various strains of Magnaporthe grisea in suspensions-cultured cells of rice[J]. Biosci Biotechnol Biochem, 2008, 72:889-892.
[23] Sahebani N, Hadavi N. Induction of H2O2and related enzymes in tomato roots infected with root knot nematode(M. javanica)by several chemical and microbial elicitors[J]. Biocontrol Sci Technol, 2009, 19:301-313.
[24] 郭金芳, 潘俊松, 王琛. 病程相关蛋白与植物抗病性关系的研究及其在草坪草抗病育种中的应用[J].草业学报, 2008, 17(6):156-163.
[25] Hwang HJ, Kim H. Gene encoding PR-10 protein of Lithospermum erythrorhizom is responsive to exogenous stimuli related to the plant defense system[J]. Plant Sci, 2003, 165:1297-1302.
[26] Zhao SQ, Guo JB. Systemic acquired disease resistance and signal transduction in plant[J]. Aca Bot sin, 2003, 2(5):539-548.
[27] 王勇刚. 植物诱导抗病性与病程相关蛋白[J]. 湖南农业大学学报, 2002, 28(2):77-82
[28] Cheong JJ, Yang DD. Methyl jasmonate as vital substance in plants[J]. Trends Genet, 2003, 19(7):409-413.
[29] 蔡昆争, 董桃杏, 徐涛. 茉莉酸类物质(JAs)的生理特性及其在逆境胁迫中的抗性作用[J]. 生态环境, 2006, 15(2):397-404.
[30] Fones H, Preston GM. Reactive oxygen and oxidative stress tolerance in plant pathogenic Pseudomonas[J]. FEMS Microbiol Lett, 2011, 327:1-8
[31] Inzé A, Vanderauwera S, Hoeberichts FA, et al. Subcellular localization compendium of hydrogen peroxide-induced proteins[J]. Plant Cell Environ, 2012, 35:308-320.
[32] Chen Z, Silva H. Active oxygen species and induction of plant systemic acquired resistance by SA[J]. Science, 2003, 262:1883-1886.
[33] Glazebrook J. Contrasting mechanisms of defense against biotrophic and necrotrophic pathogens[J]. Annu Rev Phytopathol, 2005, 43:205-227.
[34] Walling LL. Adaptive defense responses to pathogens and pests Adv[J]. Bot Res, 2009, 51:551-612.
[35] Mur LAJ, Kentom P, Atzorn R. The outcomes of concentrationspecific interactions between salicylate and jasmonate signaling include synergy, antagonism, and oxidative stress leading to cell death[J]. Plant Physiol, 2006, 140:249-262.
[36] Koornneef A, Pieterse CMJ. Cross talk in defense signaling[J]. Plant Physiol, 2008, 146:839-844.
[37] Lopez MA, Bannenberg G, Casterana C. Controlling hormone signaling is a plant and pathogen challenge for growth and survival[J]. Curr Opin Plant Biol, 2008, 11:420-427.
[38] Li ZT, Dhekney SA, Gray DJ. PR-1 gene family of grapevine:a uniquely duplicated PR-1 gene from a Vitis interspecific hybrid confers high level resistance to bacterial disease in transgenic tobacco[J]. Plant Cell Rep, 2011, 30:1-11.
[39] Hon WC, Griffith M, Mlynarz A, et al. Antifreeze proteins in winter rye are similar to pathogenesis-related proteins[J]. Plant Physiol, 1995, 109:879-889.
[40] Broekaert WF, Terras FRG, Cammue BPA. Induced and performed antimicrobial protein[C]//Slusarenko AJ, Fraser RSS, van Loon LC. Mechanisms of resisitance to plant diseases. Dordrecht:Kluwer Academic Publishers, 2000, 371-477.
[41] Zeier J, Delledonne M, Mishina T, et al. Genetic elucidation of nitric oxide signaling in incompatible plant-pathogen interactions[J]. Plant Physiol, 2004, 136, 2875-2886.
[42] Griffith M, Yaish WF. Antifreeze proteins in overwintering plants:a tale of two activities[J]. Trends Plant Sci, 2004, 9:399-405.
[43] Liu B, Zhang SH, Zhu XY, et al. Candidate defense genes as predictors of quantitative blast resistance in rice[J]. Mol Plant-Microbe Interact, 2004, 17:1146-1152.
[44] Seo PJ, Lee AK, Xiang FN. Molecular and functional profiling of Arabidopsis pathogenesis-related genes:insights into their roles in salt response of seed germination[J]. Plant Cell Physiol, 2008, 39(3):334-344.
[45] Ghanta S, Bhattacharyya D, Sinha R, et al. Nicotiana tabacum overexpressing γ-ECS exhibits biotic stress tolerance likely through NPR1-dependent salicylic acid-mediated pathway[J]. Planta, 2011, 233:895-910.
[46] Sharma R, Vleesschauwer DD, Manoj K, et al. Recent advances in dissecting stress regulatory crosstalk in rice[J]. Mol Plant, 2013, 6(2):250-260.
(责任编辑 李楠)
Expression Profiles of Pathogen-related Protein Gene( SfPR-1)from Salsola ferganica and Construction of Plant Expression Vectors
Wang Yan Chen Xi Zhou Lianjie Yang Zhongmin
(Xinjiang Key Laboratory of Biological Resources and Genetic Engineering,College of Life Science and Technology,Xinjiang University,Urumqi 830046)
To investigate the potential roles of SfPR-1 at different developmental stages, tissues, phytohormones treatment, different abiotic stresses and biotic stress treatment, semi-quantitative RT-PCR method was employed to explore the expression profiles of pathogenesisrelated protein gene SfPR-1(GenBank accession number:JQ670917)from halophytes Salsola ferganica. The results displayed that SfPR-1 gene was mainly expressed in root tissue with low expression in the stem and leaves, suggesting that the gene may play a major role in the root defense. The expression characteristic of SfPR-1 at different developmental stages(seed, 20 d shoots after seed germination, 30 d shoots after seed germination, 40 d shoots after seed germination)showed the highest level was in 30 d shoots after seed germination, indicating that may play an important role in the plant late growth. The expression of SfPR-1 generated with the application of phytohormones including salicylic acid(SA), jasmonate(JA), 1-aminocyclopropane-1-carboxylate(ACC), and abscisic acid(ABA). This response can also be induced by abiotic stresses including H2O2, salt, drought, cold, and biotic stresses such as Penicillium italicum infection. The transcript levels of SfPR-1 substantially increased during biotic stress during 48 h treatment. These results suggested that SfPR-1was a key gene to the biotic and abiotic response and may play an important role in host plant defense and environmental stress.
Salsola ferganica SfPR-1 gene RT-PCR Expression profiles Construction of plant expression vectors
2013-07-19
“973”计划前期研究专项(2012CB722204),新疆自治区青年自然科学基金项目(2012211B06)
王艳,女,博士,副教授,研究方向:植物抗逆的生理生化与分子机制;E-mail:wangyanxju@126.com

