香蕉ASR的特征和采后表达分析
香蕉ASR的特征和采后表达分析
贾彩红1徐碧玉1刘菊华1张建斌1冯仁军1金志强2
(1.中国热带农业科学院热带生物技术研究所 农业部热带作物生物学与遗传资源利用重点实验室,海口 570101;2.中国热带农业科学院海口试验站 海南省香蕉遗传改良重点实验室,海口 570101)
从香蕉cDNA文库中获得香蕉ASR全长cDNA序列,命名为MaASR。构建遗传进化树发现MaASR与单子叶植物中的芭蕉科植物的亲缘关系较近。对正常成熟和乙烯处理的香蕉果实各时期内源ABA的含量进行测定,结果表明,在正常成熟的香蕉果实中,成熟早期(0-2 d),内源ABA含量相对较低,第8天ABA含量达到最大,随后迅速下降。在乙烯处理的香蕉果实中,ABA含量急剧上升,第3天ABA含量达到高峰,随后逐渐下降。利用荧光定量RT-PCR对MaASR在正常成熟和乙烯处理后的果实中的表达情况进行分析,在自然成熟的果实中,MaASR在采后2 d达到高峰,而后迅速下降,在6-16 d时一直保持较低水平。在经外源乙烯诱导的果实中,MaASR表达水平没有表现出剧烈变化的趋势,整体表达量较低。表明MaASR对乙烯信号有应答,但应答强度较低,其表达趋势与ABA的含量或者信号强度呈负相关。
香蕉 ASR 特征 表达分析
ASR编码的蛋白是一类分子量小,亲水性强,具有较高热稳定性的蛋白。所有植物中的ASR都具有两个高度保守的结构域:一是位于N端的含有大量组氨酸的依赖于Zn2+的DNA结合序列,二是位于C端的一个核定位信号[1]。对最早克隆到的番茄中的Asr1进行研究发现,Asr1蛋白定位于番茄细胞的细胞核中,说明ASR多数是定位在细胞核中[1,2]。
近年来,从马铃薯(Solanum tubersum)[3],玉米(Zea mays)[4],松树(Pinus taeda)[5],水稻(Oryza sativa)[6],百合(Lilum longifera)[7]和葡萄(Vitis vinifera)[8]等植物中都克隆到了该基因。但是,不同物种中的ASR的表达方式不尽相同。例如,ASR在番茄[9]、甜瓜[10]和葡萄[8]的果实中表达,也在马铃薯的块茎[3]、松树的根部[11]、水稻[6]和玉米[4]
的叶片和茎,以及百合的花粉[12]中表达,这说明ASR可能参与了植物发育的各个过程。由于材料的可操作性限制,虽然在番茄[9],甜瓜[10]和草莓[13]等植物中等发现了ASR的表达,但其在果实成熟方面的功能研究进展要缓慢得多。
香蕉是生长于热带和亚热带地区的一种重要的经济作物,对其果实的后熟机制研究有着重大的实际意义。前期我们从香蕉果实成熟早期差异表达cDNA microarray中筛选到上调表达的ASR,并发现在果实呼吸跃变前的芯片数据中,该基因的表达水平较低,说明该基因可能在果实成熟早期发挥作用。因此研究该基因在香蕉果实成熟过程中的作用,可以为研究该基因在果实成熟发育中的作用奠定一定的基础。
1 材料与方法
1.1 材料
香蕉(Musa acuminateL. AAA group cv. Brazilian)果实(开花后100-120 d)从中国热带农业科学院热带生物技术研究所澄迈香蕉种植园获得。
1.2 方法
1.2.1MaASR基因的获得 根据苏伟[14]的SSH试验结果中的CX-BF81(61)片段(该片段与ABA成熟与胁迫诱导蛋白基因同源)来设计序列特异性引物,利用本实验保存的香蕉果实cDNA文库扩增基因。所用BR61 5'端引物:5'-caagcatcccacactcaatac-3',BR61 3'端引物:5'-cacaagcacaagatcgagg-3'。所用接头引物pTr5':5'-ctccgagatctggacga-gc-3';pTr3',5'-taatacgactcactcactataggg-3'。
1.2.2MaASR基因的生物信息和系统发生分析 利用ORF(Open reading frame)Finder软件对MaASR基因cDNA序列的开放阅读框和编码的氨基酸序列进行分析。并通过Conserve Domain Research软件分析MaASR推导氨基酸序列的保守结构域。在NCBI中利用blastx进行序列的同源性分析,并从中选取相似性较高的9个同源序列用Vector NTI软件进行氨基酸序列的多重比对。另外,为了确定MaASR与其他物种中同源基因的亲缘关系,选择了ASR基因家族中已发表的23个同源序列,用NJ法构建系统发生树。
1.2.3 果实采后的处理方法 将采收的开花后100-120 d的香蕉果实切割成单蕉指,用0.1%次氯酸钠表面消毒10 min,抹掉果实顶部的干花。晾干后,随机选取果实分为两组。第1组:正常成熟的果实;第2组:外源乙烯诱导成熟的果实;每组30个果实。每一取材时期每组中取3个果实。第一组果实置于22℃恒温条件下自然成熟;第二组果实置于充有100 μL/L乙烯的密闭保鲜盒中,22℃放置18 h后开盖,在22℃恒温条件下成熟[15]。
1.2.4 香蕉果实采后乙烯释放量的测定 对处理的香蕉果实在正常成熟的采后0、2、4、6、8、10、12、14、16、18 d,外源乙烯诱导后0、1、2、3、4、5、6、7 d时分别取样,测定乙烯的释放速率。
果实乙烯释放速率测定的方法如下:将3个果指放入体积为0.5 L的密封罐中,封罐3 h。用1 mL注射器抽出气体,用日本岛津GC2010型气相色谱仪测定果实乙烯释放速率,每个样品测定3次。气相色谱的工作条件为:火焰离子化检测器(FID),载体为60-80目AI2O2,柱温90℃,进样气温度100℃,载气为N2,流速为25 mL/min[16]。测定完成后,量取果实的体积和质量,计算香蕉果实单位体积质量下的乙烯的释放速率。
1.2.5 香蕉果实采后内源ABA的测定 取采后0、2、6、10、12、14、16 d自然成熟和乙烯处理的0、1、2、3、4、5、6 d的果实0.5 g,加入2 mL预冷的80%甲醇溶液,在冰浴下研磨成匀浆。将匀浆液转入10 mL试管,再用2 mL提取液分次将研钵冲洗干净,一并转入试管中。摇匀后,将试管放置在冰箱中4℃下提取4 h,1 000 g离心15 min,取上清液。然后,再在沉淀中加入1 mL提取液,重复提取 1 h,合并上清液并记录体积,弃去残渣。吸取上清液过C18植物色素固相吸附柱除去叶绿素,转入5 mL塑料管中,真空抽干。采用ELISA法测定激素含量,试剂盒购自中国农业大学。所有指标的测定都重复3次,取其平均值。
1.2.6 果实采后不同阶段总RNA提取和cDNA第一链的合成 分别在香蕉果实正常成熟的采后0、2、6、10、12、14、16 d,外源乙烯诱导后的0、1、2、3、4、5、6 d取材,将材料切成小块,迅速置于液氮中冷冻,于-70℃冰箱中贮存,用于总RNA提取。RNA提取参照改良的CTAB方法[17]。取4 μg总RNA,
用Invitrogen的SuperScriptTMⅢ Reverse Transcriptase合成cDNA第一链,具体操作参照Invitrogen的SuperScriptTMⅢ Reverse Transcriptase Kit说明书。
1.2.7 荧光定量PCR分析香蕉果实在不同处理下MaASR在mRNA水平上的表达 利用荧光定量PCR对MaASR在香蕉不同处理下的表达进行分析。反应体系为:12.5 μL的2XSYBR Green PCR Master Mix,0.5 μL的ROX,100 ng的反转录RNA。MaASR引物为:5'端引物:5'-AGAAGCATCACCACCATCTC-3'(10 pmol),3'端引物:5'-CAAGCATCCCACACTCAACAC -3'(10 pmol)。Actin引物为:5'端引物:5'-CGAGGCTCAATCAAAGA-3'(10 pmol),3'端引物:5'-ACCAGCAAGGTCCAAAC-3'(10 pmol)。反应程序为:94℃预变性 3 min,94℃变性7 s,55℃ 退火15 s,72℃ 延伸20 s,40个循环。Actin作为内对照,每个反应重复3次。
2 结果
2.1 MaASR的获得
MaASRcDNA扩增结果如图1所示。对所获得的基因片段送上海生物工程有限公司测序,测序结果用BLASTx比对发现该基因与水稻、甘蔗和百合的Asr1的同源性分别为86%、84%和86%,因此将其命名为MaASR。
图1 PCR扩增
2.2 MaASR推导氨基酸序列与其他物种中ASR序
列的比对
本研究从香蕉cDNA文库中获得MaASR全长cDNA序列,该基因在香蕉成熟早期上调表达。ASR基因是特异存在于高等植物中的一类调控基因,用Vector NTI软件对从8种植物中获得11个ASR家族成员进行多序列比对分析,结果(图2)显示,MaASR推导的氨基酸序列与番茄(LeAsr1、LeAsr2、LeAsr3,登录号分别为AAA34137、CAA52873和CAA52874)、葡萄(VvMSA,登录号AAK69513)、松树(LP3,AAB07493)、水稻(OsASR1,AAB96681)和玉米(ZmASR1,CAA72998)等植物中的ASR氨基酸序列相比,在N端和C端各有一个较为保守的区域。图2中位于N端的A区域编码该家族成员所特有的依赖于Zn2+的DNA结合位点,而位于C端的B区域则代表一个核定位信号。
2.3 MaASR推导的氨基酸序列的系统发生分析
根据ASR家族中已发表的序列,用NJ法构建系统发生树,结果如图3,MaASR推导的氨基酸序列与单子叶植物中芭蕉科植物中的亲缘关系较较近,与双子叶植物中的亲缘关系较远,与单子叶植物中的禾本科植物亲缘关系最远。
2.4 香蕉果实采后成熟过程中内源乙烯释放速率
测定
图4中的结果显示,正常成熟条件下,香蕉果实采后成熟前期(0-8 d)乙烯的释放速率很低,仅不到0.2 ng/ (g·h)。并且在采后8 d内,其变化非常缓慢。10 d时,乙烯释放速率开始升高。随着成熟时间的推移,上升幅度逐渐增大,在采后14 d达到峰值,此时的释放速率约是第8 d的20倍,达到26.212 ng/(g·h)。14 d后,乙烯的释放速率开始降低,在采后18 d下降到最低值。用外源乙烯处理香蕉诱导成熟时,内源乙烯的释放不经过采后成熟前期长达8 d的低水平阶段,而是在采后第1天就开始增加,达到2.358 ng/(g·h),并在第3天达到最大值29.052 ng/(g·h),比正常成熟的乙烯高峰提前了11 d。
2.5 香蕉果实采后成熟各时期的内源ABA含量测定
对香蕉果实采后自然成熟各时期内源ABA的含量进行测定,结果(图5)表明,在正常成熟的香蕉果实中,成熟早期(0-2 d),内源ABA含量相对较低。2 d后,ABA的水平逐渐升高。在采后10 d时达到最高峰,含量为725.77 ng/g FW。10-12 d间,果实中内源ABA的积累迅速减少,到12 d时含量仅为101.6534 ng/g FW。在乙烯处理的香蕉果实中,ABA含量在贮藏过程中急剧上升,第3天ABA含量
已到达高峰,含量为1345.64 ng/g FW。

图2 MaASR推导的氨基酸序列的多序列比对
2.6 MaASR在香蕉果实不同处理下的表达分析
利用qRT-PCR对MaASR在正常成熟和乙烯处理后的果实中的表达情况进行分析,结果(图6)显示在自然成熟的果实中,MaASR在采后2 d达到表达高峰(表达量为5.38),而后迅速下降,在10-16 d时一直保持较低水平。在经外源乙烯诱导的果实中,MaASR表达水平没有表现出剧烈变化的趋势,整体表达量较低。其中,在乙烯诱导后3 d时表达量小幅度上升,且该表达水平一直保持到第6天完成整个成熟过程。
3 讨论
本研究从香蕉cDNA文库中获得MaASR全长cDNA序列,命名为MaASR。多序列比对发现该基因在N端和C端各有一个较为保守的区域。进化树分析表明,MaASR与与单子叶植物中芭蕉科植物中的亲缘关系较较近,与双子叶植物中的亲缘关系较远,与单子叶植物中的禾本科植物亲缘关系最远。这表明香蕉虽然属于单子叶植物中的芭蕉科,但香蕉中的该类基因在聚类分析上并不能代表香蕉属于单子叶植物中的特性,这种关系还需要进一步的研究证明。
MaASR的表达并没有受到外源乙烯地大量诱导,只是在采后第3天时表达水平稍有升高,为0 d时的2倍。而内源乙烯的生物合成在3 d时也达到高峰。这说明外源乙烯诱导内源乙烯的生物合成提前达到最大峰值时,也对MaASR的表达有促进作用。这说明MaASR对乙烯信号有应答,但应答强度较低。
而且,MaASR对乙烯的应答是通过直接作用还是通过间接途径来相互影响还不能确定。Hong等[19]分离香瓜中的Asr1的启动子区,发现在ABRE上游不远处存在乙烯应答元件(Ethylene responsive element,ERE),说明ASR家族一些基因可能对乙烯有直接应答。但是陈尚武等[20]认为ABA生物合成抑制剂Fluridone可以通过抑制果实组织ABA的合成、降低果实内源ABA的浓度,干预ABA对乙烯合成过程和细胞壁软化过程的关键酶活性调控作用,而实现影响果实成熟,说明ABA可能是果实成熟过程中位于乙烯上游的内源调控因子。所以,MaASR对乙
烯的应答也可能是通过参与ABA途径来间接实现的。MaASR基因对乙烯的应答机制还有待于进一步地研究。
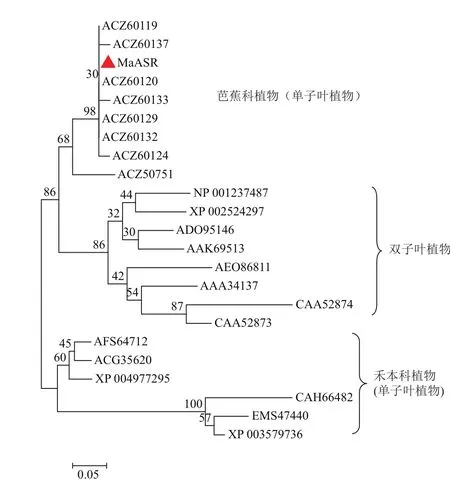
图3 MaASR推导氨基酸序列与其它植物ASR氨基酸序列的系统发生分析
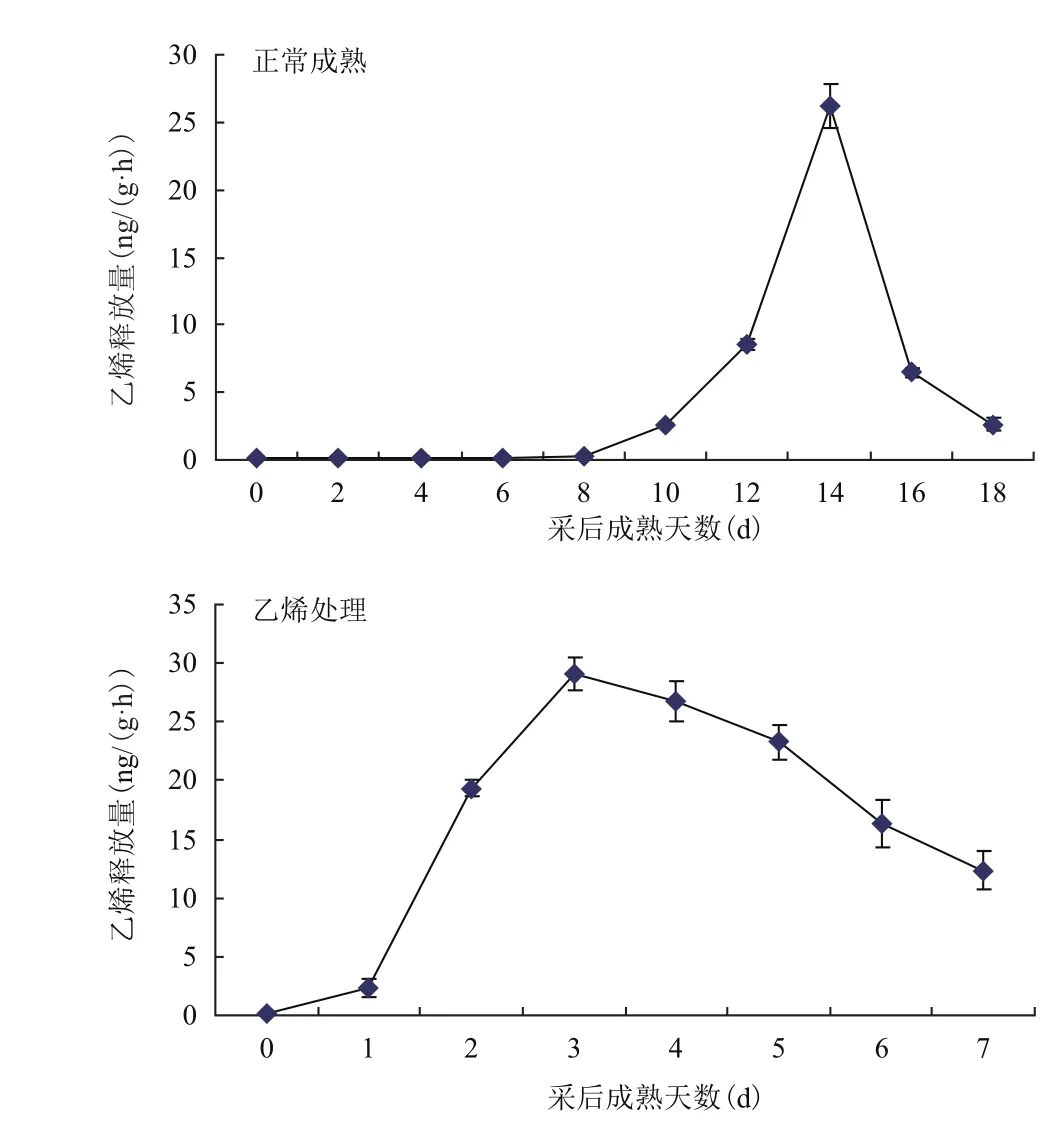
图4 香蕉果实正常成熟和外源乙烯处理处理下内源乙烯的释放速率

图5 果实采后自然成熟和乙烯处理内源ABA含量变化曲线
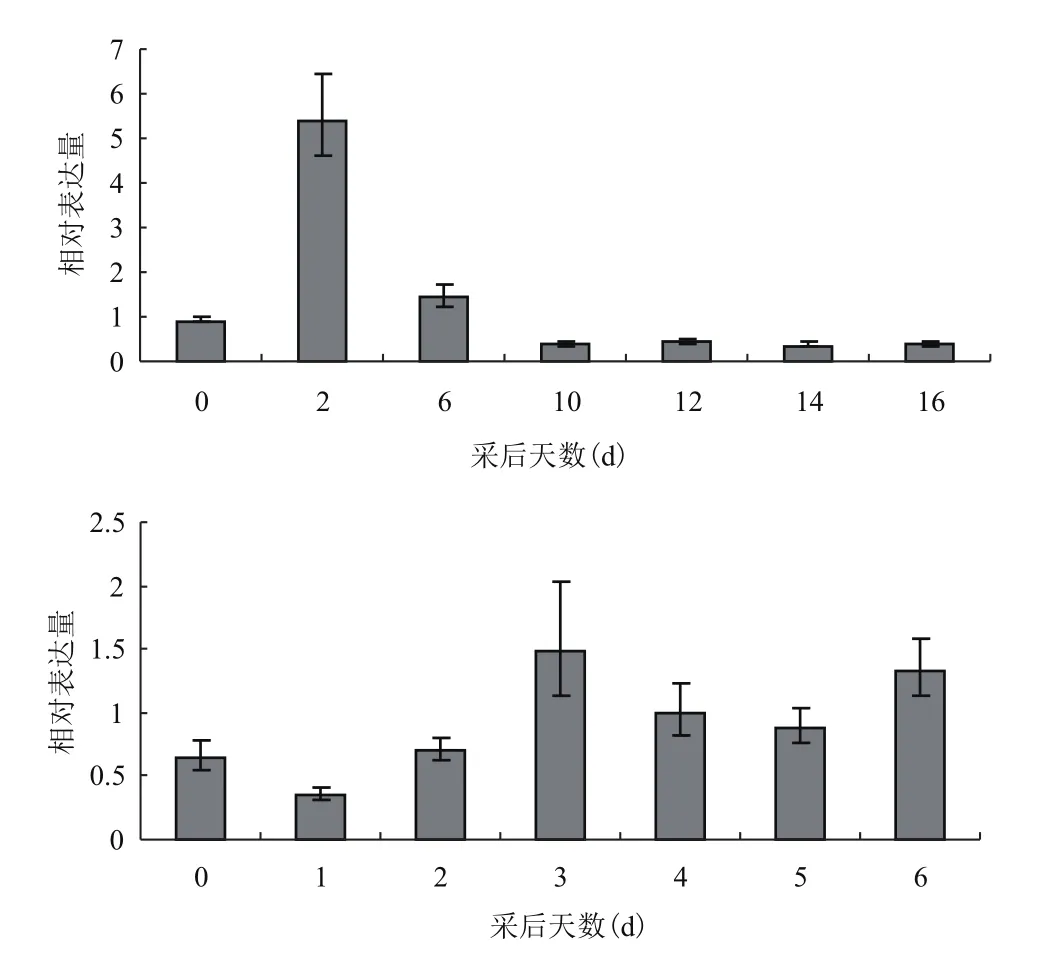
图6 MaASR在果实正常成熟和乙烯处理下的表达
由于MaASR在香蕉成熟早期显著上调,为了探索MaASR与香蕉果实成熟的关系,检测了MaASR与香蕉果实成熟过程最重要的两大激素——ABA和乙烯之间的关系。在正常成熟的果实中,MaASR在采后成熟早期(采后2 d)的上调表达较为明显,这与草莓中的研究结果相似[13],但是在2 d后迅速下降,直到完成整个成熟过程,而在乙烯处理的香蕉果实中的表达变化不明显,一直处于较低的水平。对果实自然成熟过程和乙烯处理的不同时期的内源ABA含量进行测定,发现在自然成熟的香蕉果实中,早期(0-2 d)内源ABA含量相对较低,2 d后ABA的水平逐渐升高,在采后8 d时达到最高峰,8-10 d间,果实中内源ABA的积累迅速减少;在乙烯处理的香蕉果实中,ABA的含量逐渐升高,到第3天时含量达到最大,随后逐渐降低,但乙烯处理的催熟果实的ABA含量峰值高于正常成熟果实的,且高峰出现的比正常成熟的早,本研究结果与蒋跃明等[21]的研究结果一致。根据内源ABA含量变化与MaASR的表达变化趋势,我们推测MaASR在果实成熟早期可能诱导ABA的的生物合成,但在内源ABA含量达到高峰后,又反馈抑制了MaASR的表达。以上结果表明,MaASR可能是通过参与香蕉果实采后早期的ABA途径来影响果实的成熟过程。
通过对MaASR的研究发现该基因与ABA之间的关系非常密切,由于ABA参与调控植物生长发育的各个层面,尤其是逆境胁迫,种子萌发和果实成熟等方面,所以认为MaASR可能是通过参与到ABA的信号或合成过程来在不同的器官中发挥调节作用,这一推测还需要进一步的证据来验证。
4 结论
MaASR基因与单子叶植物中芭蕉科植物的亲缘关系较近,与双子叶植物的亲缘关系较远,与单子叶植物中的禾本科植物关系最远。
MaASR对乙烯信号有应答,但应答强度较低,其表达趋势与ABA的含量或者信号强度呈负相关。
[1] Kalifa Y, Gilad A, Konrad Z, et al. The water- and salt-stress regulated Asr1 gene encodes a zinc-dependent DNA- binding protein[J]. Biochem J, 2004, 381:373-378.
[2] Maskin L, Frankel N, Iusem ND, et al. Dimerization and DNA-binding of ASR1, a small hydrophilic protein abundant in plant tissues suffering from water loss[J]. Biolchemical and Biophysical Communications, 2007, 352:831-835.
[3] Schneider, A, Salamini, F, Gebhardt, C. Expression patterns and promoter activity of the coat-regulated gene ci21A of potato[J]. Plant Physiol, 1997, 113:335-345.
[4] Shen B, Carneiro N, Torres-Jerez I, et al. Partial sequencing and mapping of clones from two maize cDNA libraries[J]. Plant Mol Biol, 1994, 26(4):1085-1101.
[5] Chang S, Puryear JD, Dias MADL, et al. Gene expression under water deficit in loblolly pine(Pinus taeda L.):Isolation and characterization of cDNA clones[J]. Physiol Plantarum, 1996, 97:139- 148.
[6] Vaidyanathan R, Kuruvilla S, Thomas G. Characterization and expression pattern of an abscisic acid and osmotic stress responsive gene from rice[J]. Plant Sci, 1999, 140:25-36.
[7] Chang FC, Wang CS. Lily(Lilium longiflorum)transcript(Accession No. AF077629)induced by desiccation during pollen development[J]. Plant Physiol, 1999, 121:99-159.
[8] Cakir B, Agasse A, Gaillard C, et al. A grape ASR protein involved in sugar and abscisic acid signaling[J]. Plant Cell, 2003, 15:2165-2180.
[9] Silhavy D, Hutvagner G, Barta E, et al. Isolation and characterization of a water-stress-inducible cDNA clone from Solanum chacoense[J]. Plant Mol Biol, 1995, 27:587-595.
[10] Hong SH, Kim IJ, Yang DC, Chung WI. Characterization of an abscisic acid responsive gene homologue from Cucumis melo[J]. J Exp Bot, 2002, 53(378):2271-2272.
[11] Padmanabhan V, Dias DM, Newton RJ. Expression analysis of a gene family in loblolly pine(Pinus taeda L.)induced by water deficit stress[J]. Plant Mol Biol, 1997, 35:801-807.
[12] Wang CS, Liau YE, Huang JC, et al. Characterization of a desiccation-related protein in lily pollen during development and stress[J]. Plant Cell Physiol, 1998, 39:1307-1314.
[13] Chen JY, Liu DJ, Jiang YM, et al. Molecular characterization of a
strawberry FaASR gene in relation to fruit ripening[J]. PLoS One, 2011, 6(9):1-14.
[14] 苏伟. 香蕉采后果实成熟特异表达基因的分离与鉴定[D].儋州:华南热带农业大学, 2003:78-85.
[15] Liu X, Shiomi S, Nakstsuka A, et al. Characterization of ethylene biosynthesis associated with ripening in banana fruit[J]. Plant Physiol, 1999, 121(4):1257-1265.
[16] 胡位荣, 朱西儒, 王正询. 香蕉果实采后及贮藏的效应及生理研究[J].广州大学学报, 2003, 3:228-234.
[17] 李燕强, 金志强, 徐碧玉. 香蕉果实RNA提取方法的改进和比较[J].福建热作科技, 2005, 30(2):237-240.
[18] Xu BY, Su W, Liu JH, et al. Differentially expressed cDNAs at the early stage of banana ripening identified by suppression subtractive hybridization and cDNA microarray[J]. Planta, 2007, 226(2):529-539.
[19] Hong SH, Kim IJ, Chung WI. Identification of fruit-specific cDNA in a ripened inodorous melon using differential screening and the characterization of an abscisic acid responsive gene homologue[J]. Plant Biotechnology, 2002, 4(1):7-15.
[20] 陈尚武, 张大鹏. ABA和Fluridone对苹果果实成熟的影响[J].植物生理学报, 2000, 26(2):123-129.
[21] 蒋跃明, 陈芳, 张东林, 等. ABA对香蕉果实的呼吸作用及其与乙烯的关系[J]. 热带作物学报, 1994, 15(2):35-38.
(责任编辑 李楠)
Characteristic and Expression Analysis of ASR Gene from Banana
Jia Caihong1Xu Biyu1Liu Juhua1Zhang Jianbin1Feng Renjun1Jin Zhiqiang2
(1. Key Laboratory of Biology and Genetic Resources of Tropical Crops,Ministry of Agriculture,Haikou 570101;2. Haikou Experimental Station,Institute of Banana,Chinese Academy of Tropical Agricultural Sciences,Haikou 570101)
ASR gene was obtained from banana cDNA libraries in this study and ws named as MaASR. Phylogenetic analysis revealed MaASR was close relatives to Musaceae of Monocotyledons. Endogenous ABA content was determined in naturally ripened bananas and ethylenetreated bananas. In naturally ripened bananas, endogenous ABA content is relatively low at mature early(0-2 d), and increase maximum at 8 day, then drop rapidly. In ethylene- treated bananas, ABA content rise sharply peak at 3 days and then gradually decline. Real-time quantitative PCR analysis expression of MaASR in naturally ripened bananas and ethylene- treated bananas. In naturally ripened bananas, MaASR expression increased and peaked 2 days after harvest, then fell rapidly and remained low at 6-16 d. While in ethylene- treated bananas, MaASR expression levels do not show the dramatic change trend, the expression is overall low. The results showed that MaASR was responding to ethylene signal, but response intensity is low, its expression trend was negatively correlated with the content of ABA or signal strength.
Banana ASR gene Characteristic Expression analysis
2013-10-16
国家自然科学基金项目(31071788),‘十二五’农村领域国家科技计划课题(2011AA10020605),现代农业产业技术体系建设专项资金资助项目(CARS-32)
贾彩红,女,副研究员,硕士,研究方向:香蕉分子生物学;E-mail:jiach9@163.com
金志强,男,研究员,博士生导师,研究方向:香蕉分子生物学;E-mail:18689846976@163.com

