不同挤压温度对糙米体外抗氧化活性的影响
杨凌霄,程李琳,张 晖,花 丹,谷中华,齐希光,王 立,钱海峰
(江南大学食品学院与技术国家重点实验室,江南大学食品学院,江苏无锡214122)
不同挤压温度对糙米体外抗氧化活性的影响
杨凌霄,程李琳,张 晖*,花 丹,谷中华,齐希光,王 立,钱海峰
(江南大学食品学院与技术国家重点实验室,江南大学食品学院,江苏无锡214122)
以糙米为原料,采用不同的挤压温度加工糙米,分别提取糙米中的游离态和结合酚,并对提取物中的酚含量、ABTS+自由基清除能力及铁离子还原能力进行了测定,并对各个指标间进行了相关性分析,同时测定了挤压后糙米的淀粉糊化度。结果表明:挤压前后糙米的游离酚和结合酚含量范围分别为210.48~747.70μg/g(GAE/DW)和260.77~ 470.94μg/g(GAE/DW);游离态提取物的ATBS自由基清除能力和铁离子还原能力的范围分别为1.15~4.52μmol/g(Trolox/DW)和2.57~9.86μmol/g(FeSO4/DW);结合酚的ABTS+自由基清除能力和铁离子还原能力的范围分别为3.09~ 4.97μmol/g(Trolox/DW)和4.53~7.03μmol/g(FeSO4/DW);糙米的淀粉糊化度随挤压温度的上升而升高,当温度大于130℃后糊化度变化不再显著。相关性分析表明:游离态提取物中的酚含量与抗氧化能力之间不存在显著的相关性,而结合态提取物中的酚含量与抗氧化能力之间具有显著性的相关性。
糙米,酚,抗氧化,挤压,糊化度
流行病学研究表明,全谷物的摄入对降低冠心病、II型糖尿病、癌症等慢性疾病的风险有一定的贡献[1]。而这与全谷物皮层和胚芽中的酚类物质等多种抗氧化物质有着密切的联系[2-3]。因此,合理摄入全谷物对人体健康有诸多益处。全谷物中多酚类物质可分为游离酚和结合酚[4],但有不少研究忽略了结合酚的提取。虽然近几年国内外关于谷物抗氧化的研究均将结合酚考虑在内,但大部分仍局限于未加工谷物的抗氧化研究,对加工后谷物的抗氧化研究却甚少。众所周知,未加工的谷物无法直接食用,因此考察加工对谷物的抗氧化活性的影响就显得较为重要。挤压技术是集混合、搅拌、破碎、加热、蒸煮、杀菌、膨化等工序为一体的高新技术,具有原料利用率高、营养损失小等诸多优势,在食品行业中得到了广泛的应用[5]。Bouzaza等[6]研究了挤压条件下不同模头对谷物膨胀度的影响。陈雪梅等[7]利用挤压机将多种谷物粉加入面粉中,可使面粉团的延伸性、韧性、抗拉阻力和粉力都下降。虽然周小理等[8]对挤压前后荞麦麸皮的抗氧化研究进行了研究,但是却未进行深入的探讨。因此本文以糙米为原料,不仅考察了糙米在不同的挤压温度下游离酚和结合酚的变化情况及各自对ABTS自由基清除能力和铁离子还原能力的测定,同时分析了淀粉糊化度与结合态酚类物质及其抗氧化之间的相互关系,而国内外均未对这方面有过研究。这为合理加工全谷物产品提供了理论依据。
1 材料与方法
1.1 材料与仪器
糙米(brown rice) 购于江苏中江种业股份有限公司,挤压后的谷物及未经挤压的谷物均用粉碎机粉碎并过60目筛,并置于-20℃保存;福林酚(Folin& Ciocalteu,FC)试剂 2mol/L,购于上海荔达生物科技有限公司;水溶性维生素E(6-hydroxy-2,5,7,8-tetramethylchroman-2-carboxylic acid,Trolox),2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulphonic acid),ABTS),三吡啶基三嗪(2,4,6-tri(2-pyridyl)-striazine,TPTZ) 购于Sigma公司;其他试剂及药品 均为国产分析纯。
FW100粉碎机 天津泰斯特仪器有限公司;RV10 basic旋转蒸发仪 广东IKA科学仪器有限公司;DHG240L鼓风干燥箱 上海一恒科学仪器有限公司;TP214电子天平 丹佛仪器公司;Delta 320酸度计 梅特勒-托利多(上海)仪器有限公司;S25-12D超声波清洗器 宁波新芝生物科技股份有限公司;722S分光光度计 无锡科达智能仪器有限公司;CR21GⅢ高速冷冻离心机 日本日立公司;POLYLAB双螺杆挤压机 美国赛默飞世尔科技公司。
1.2 实验方法
1.2.1 挤压工艺 谷物磨粉过60目筛,调节谷物水分至25%,螺杆转速设为100r/min,进料量为60g/min,挤压温度分别为110、120、130、140℃。挤压膨化后的谷物冷却至室温,置于40℃烘箱中烘干。
1.2.2 游离酚的提取 称取10g谷物[9],100mL 80%(v/v)乙醇常温提取10min,离心得上清液,重复提取2次合并上清液。40℃下旋转蒸发,用水定容至100mL备用。
1.2.3 结合酚的提取 向游离酚提取后所得的谷物残渣中加入100mL 2mol/L NaOH[9],搅拌均匀,在氮气保护下,置于超声仪中超声1h,水解所得物调节pH至6,用正己烷按1∶1(v/v)除去脂溶性成分,再用乙酸乙酯按1∶1(v/v)萃取5次,合并乙酸乙酯萃取液,旋转蒸发至干,用水定容至100mL备用。
1.2.4 酚含量的测定 取1mL提取液[10](适当稀释)加入3mL 7.5%Na2CO3混匀,再加入1mL 0.2mol/L福林酚试剂,室温反应30min后在765nm处测定吸光值,以水为空白对照,根据不同浓度没食子酸(10、20、30、40、50μg/mL)制得的标准曲线计算总酚含量。没食子酸在浓度范围为10~50μg/mL内与其吸光值具有较好的线性关系,标曲方程为y=0.0163x+0.0651,线性相关系数为0.9990。结果以μg/g(gallic acid equivalent/ dry weight,GAE/DW)计算。
1.2.5 淀粉糊化度的测定 采用Taka淀粉酶法测定[11]。1.2.6 ABTS抗氧化能力测定 配制ABTS母液[12],加水调节波长在743nm处的ABTS溶液的吸光值至0.7± 0.02,记为Acontrol,空白以水为对照。向5mL稀释后的ABTS溶液中加入50μL提取液(适当稀释),摇匀,放置室温下反应10min后测定吸光值,记为Asample。以下列公式计算清除率。

以不同浓度的Trolox溶液做标准曲线,根据清除率计算得到抗氧化能力TEAC(trolox equivalent antioxidant capacity)值。Trolox在浓度范围为200~ 2000μmol/L内与其吸光值具有较好的线性关系,标曲方程为y=0.0004x+0.00002,线性相关系数为0.9996。结果以μmol/g(trolox equivalent/dry weight,Trolox/DW)表示。
1.2.7 铁离子还原能力测定 制备FRAP试剂[13],取3mL FRAP试剂与0.1mL提取液(适当稀释)混匀,38℃水浴锅中反应30min后在波长为593nm下测定吸光值,空白对照为3mL FRAP试剂+0.1mL水。以不同浓度的FeSO4溶液做标准曲线,根据吸光值计算得到ferric reducing antioxidant power potential(FRAP)值,FeSO4在浓度范围为50~1000μmol/L内与其吸光值具有较好的线性关系,标曲方程为y=0.0007x+0.0056,线性相关系数为0.9999结果以μmol/g(FeSO4/DW)表示。
1.2.8 数据处理与分析 采用SPSS 19、Excel 2003和Origin 9.0软件进行数据分析及图像处理,实验均进行3次重复,数值以均值±标准偏差表示。
2 结果与讨论
2.1 游离酚、结合酚含量及糙米糊化度
糙米挤压前后的游离酚和结合酚的含量如图1所示。结果显示,加工后的糙米其游离酚和结合酚的含量与未加工的糙米相比均显著降低(p<0.05)。未加工的糙米中游离酚含量为747.70μg/g(GAE/DW),而经过110、120、130、140℃挤压后的糙米中游离酚的含量分别降至275.38、260.23、236.38、210.48μg/g(GAE/DW),损失率分别为63%、65%、68%和72%。即随着挤压温度的升高,游离酚的含量逐渐下降。Henryk等[14]也发现挤压对谷物的游离酚含量下降作用明显,这主要是因为热处理引起游离酚的降解所导致。
未加工的糙米中结合酚含量为470.94μg/g(GAE/ DW),经过110、120、130、140℃挤压后的糙米中结合酚的含量分别降至320.22、353.10、425.86、260.77μg/g(GAE/DW),损失率分别为32%、25%、10%和45%。从图1中可以看出,当温度达到110℃时结合酚含量下降明显,但随着温度的不断上升结合酚含量又逐渐升高,当温度超过130℃后结合酚含量又开始显著下降(p<0.05),统计结果显示,温度对结合酚含量的变化是显著的(p<0.05)。Susanne等[15]研究发现谷物经过加工后其酚酸含量会降低,这主要是由于加工使得谷物中酚酸类物质从结合态转变为游离态,从而降低了结合酚的含量。而实验结果显示,挤压温度为130℃时糙米的结合酚含量显著高于其他挤压温度下结合酚含量(p<0.05),因此挤压过程中必定有某一个因素能提高结合酚的含量,由于实验过程中未出现人为添加抗氧化剂的情况,因此只有可能是糙米在加工过程中其本身的性质的改变所造成的,而在挤压过程中糙米除了受到热的影响同时其本身的糊化度也随之发生变化,因此该因素很有可能与挤压过程中淀粉的糊化度的变化有关。
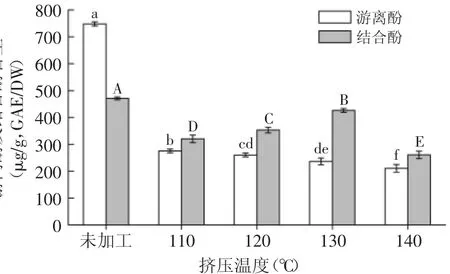
图1 糙米游离态和结合态的酚含量Fig.1 Free and bound total phenolic content of brown rice
Davis等[16]研究发现,挤压能显著地提高谷物营养物质的消化率,而这与加工过程中淀粉糊化度之间有着密切联系。通过对挤压后糙米的糊化度进行测定(见图2),可以发现,当挤压温度为110℃时,糙米的淀粉糊化度为84.16%,随着温度的上升糊化度显著上升(p<0.05),当温度达到130℃时淀粉糊化度为97.05%,且再升高温度,糊化度不再显著变化(p>0.05)。结合图1的结果,有理由推测糊化度的上升对结合酚含量的提高有显著作用,这可能是因为经过挤压膨化后糊化的糙米更有利于结合酚的充分释放,而当糙米糊化完全后,继续升高温度结合酚含量反而下降,这主要是因为热处理会导致结合酚从结合态转变为游离态。此外,游离酚易被破坏,即使结合酚转化为游离态也会因外界因素导致含量的减少。
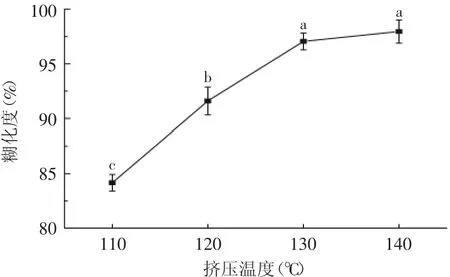
图2 挤压后糙米的淀粉糊化度Fig.2 Degree of brown rice starch gelatinization after extrusion
2.2 ABTS+自由基清除能力
糙米挤压前后的TEAC值如图3所示。结果显示,加工后的糙米其游离态和结合态的提取物的TEAC值与未加工的糙米相比均显著降低(p<0.05)。未加工的糙米中游离态提取物的TEAC值为4.52μmol/g(Trolox/DW),而经过110、120、130、140℃挤压后的糙米中游离态提取物的TEAC值分别降至1.15、1.77、1.83、1.87μmol/g(Trolox/DW),损失率分别为75%、61%、60%、59%。当挤压温度为110℃时,TEAC值降为最低,随着挤压温度的不断上升,TEAC值逐渐上升。
未加工的糙米中结合态提取物的TEAC值为4.97μmol/g(Trolox/DW),而经过110、120、130、140℃挤压后的糙米中游离态提取物的TEAC值分别降至3.53、3.91、4.43、3.09μmol/g(Trolox/DW),损失率分别为29%、21%、11%和38%。当温度达到110℃时TEAC值显著下降,随着温度的不断上升TEAC值又逐渐升高,当温度超过130℃后TEAC值又开始显著下降,统计结果显示,温度对结合态提取物的TEAC值的变化影响显著(p<0.05)。
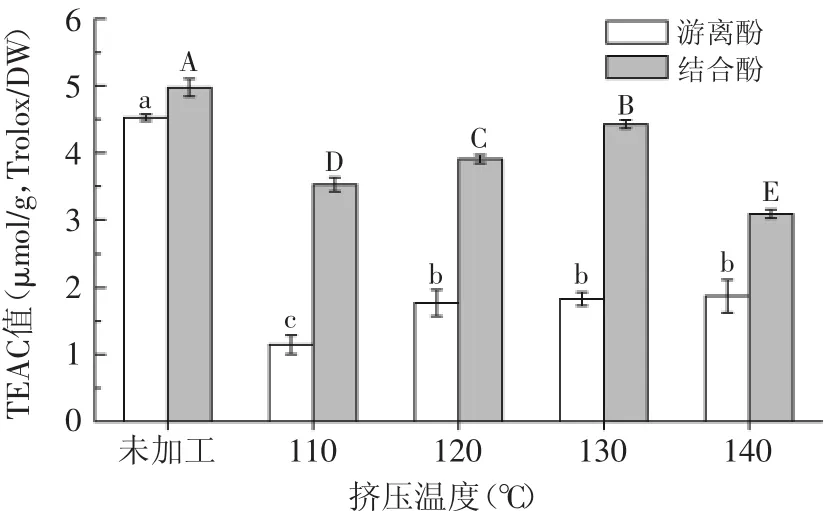
图3 糙米游离态和结合态提取物的TEAC值Fig.3 TEAC value of free and bound extracts of brown rice

图4 糙米游离态和结合态提取物的铁离子还原能力Fig.4 The FRAP value of free and bound extracts of brown rice
2.3 铁离子还原能力
糙米挤压前后的FRAP值如图4所示。结果显示,加工后的糙米其游离态和结合态的提取物的FRAP值与为加工的糙米相比均显著降低(p<0.05)。未加工的糙米中游离态提取物的FRAP值为9.86μmol/g(FeSO4/DW),而经过110、120、130、140℃挤压后的糙米中游离态提取物的FRAP值分别降至2.57、2.95、3.46、3.18μmol/g(FeSO4/DW),损失率分别为74%、70%、65%、68%。当挤压温度为110℃时,FRAP值降为最低,随着挤压温度的不断上升,FRAP值逐渐上升,当温度达到140℃时,FRAP值又有小幅下降,但变化并不显著(p>0.05)。
未加工的糙米中结合态提取物的FRAP值为7.03μmol/g(FeSO4/DW),而经过110、120、130、140℃挤压后的糙米中游离态提取物的TEAC值分别降至4.84、5.49、6.41、4.53μmol/g(FeSO4/DW),损失率分别为31%、22%、9%、36%。当温度达到110℃时FRAP值显著下降,随着温度的不断上升FRAP值又逐渐升高,当温度超过130℃后FRAP值又显著下降,统计结果显示,温度对结合态提取物的FRAP值的变化显著(p<0.05)。
2.4 相关性分析
酚类物质与其抗氧化能力之间的相关性如表1所示,结果显示,游离态提取物中游离酚与ABTS自由基清除能力和铁离子还原能力之间的相关性不显著(p>0.05)。而这与其他学者的研究不尽一致,Adom等[9]研究发现全谷物游离态提取物中的酚含量与抗氧化能力之间不存在显著性的相关性,而Min等[17]的研究却发现,游离酚与抗氧化能力之间存在显著的相关性,这主要是因为采用的统计学方法不同造成的,但也不排除是不同的谷物品种导致的。Liyana等[18]的研究结果显示,谷物中含有植酸等非酚类物质的抗氧化成分,从而导致游离酚和抗氧化指标之间的相关性不显著,这说明游离态提取物中的酚类物质对抗氧化能力的影响并不显著,可能还存在其他抗氧化物质。

表1 酚类物质与其抗氧化性的相关性分析Table 1 Correlation analysis of phenolic content and antioxidant activity
结合态酚类物质与抗氧化指标之间呈极显著的正相关性(p<0.01),这说明结合态提取物中的酚类物质对抗氧化有重要贡献,这与Adom和Min等的研究结果一致[9,17]。还有研究表明,结合态中的酚类物质主要是酚酸,且阿魏酸和p-香豆酸是其主要成分[19]。此外,谷物中的结合态酚类物质可以通过胃肠,完整的抵达结肠,并在结肠中被肠道菌群发酵并充分发挥对人体有益的生物活性[1]。
分析结果显示,游离态与结合态提取物的TEAC值与FRAP值之间具有极显著的正相关性(p<0.01)。TEAC值是反映抗氧化物质对ABTS自由基的清除能力,而FRAP值是反应抗氧化物质还原三价铁离子的能力,但二者在测定的过程中均涉及电子对的转移[20]。因此糙米中的抗氧化物质对自由基清除能力和对金属离子的还原能力具有较高的一致性。
3 结论
不同的挤压温度对糙米的游离酚和结合酚含量的影响显著。游离酚经过挤压后损失率在63%~72%之间,而结合酚的损失率在10%~45%之间。相比较而言,糙米中游离酚比结合酚更易受到挤压的影响。糙米淀粉糊化度与结合酚的含量之间具有一定联系,糊化度的上升对结合酚含量的提高作用明显。但当淀粉糊化度不再显著上升后,结合酚含量随着温度的上升显著下降。挤压操作对糙米的抗氧化能力的影响也十分显著。游离态提取物的抗氧化能力损失率高于结合态提取物的抗氧化能力,这表明游离态提取物中的抗氧化成分更容易在挤压过程中受到破坏。相关性分析结果显示,游离酚对抗氧化能力的贡献并不显著,可能还存在其他抗氧化物质。而结合酚对抗氧化能力的贡献十分显著。
综上所述,挤压操作虽显著降低糙米的抗氧化能力,但研究发现,糊化度的提升能显著提升结合态提取物抗氧化能力并有效减少抗氧化能力的损失,因此本研究对合理加工全谷物产品提供了一定的理论依据。
[1]Liu RH.Whole grain phytochemicals and health[J].Journal of Cereal Science,2007,46(3):207-219.
[2]龚二生,罗舜菁,刘成梅.全谷物抗氧化活性研究进展[J].食品工业科技,2013,34(2):364-369.
[3]Miller HE,Rigelhof F,Marquart L,et al.Antioxidant content of whole grain breakfast cereals,fruits and vegetables[J].Journal of the American College of Nutrition,2000,19(3):312S-319S.
[4]Sosulski F,Krygier K,Hogge L.Free,esterified,and insolublebound phenolic acids 3 Composition of phenolic acids in cereal and potato flours[J].Journal of Agricultural and Food Chemistry,1982,30(2):337-340.
[5]张泽庆.食品挤压技术[J].粮食加工,2008,33(2):63-64.
[6]Bouzaza D,Arhaliass A,Bouvier JM.Die design and dough expansion in low moisture extrusion-cooking process[J].Journal of Food Engineering,1996,29(2):139-152.
[7]陈雪梅,张映斌,邓金星,等.利用挤压膨化技术开发高蛋白营养膨化粉的研究[J].食品科技,2005,5:18-21.
[8]周小理,钱龒芳,周一鸣,等.不同处理工艺对苦荞麸皮膳食纤维体外抗氧化活性的影响[J].食品科学,2011,32(8):1-4.
[9]Adom KK,Liu RH.Antioxidant activity of grains[J].Journal of Agricultural and Food Chemistry,2002,50(21):6182-6187.
[10]吕群金,衣杰荣,丁勇.Folin-Ciocalteu比色法测定杨桃的多酚含量[J].湖南农业科学,2009(7):99-101.
[11]庄海宁,夏智,李军德,等.挤压方便米的径向膨胀率与其复水率、糊化度关系的研究[J].现代食品科技,2010,26(10):1057-1062.
[12]Re R,Pellegrini N,Proteggente A,et al.Antioxidant activity applying an improved ABTS radical cation decolorization assay [J].Free Radical Biology and Medicine,1999,26(9):1231-1237.
[13]Benzie IF,Strain JJ.The ferric reducing ability of plasma(FRAP)as a measure of“antioxidant power”:the FRAP assay[J].Analytical Biochemistry,1996,239(1):70-76.
[14]Zieliński H,Michalska A,Piskuła MK,et al.Antioxidants in thermally treated buckwheat groats[J].Molecular Nutrition& Food Research,2006,50(9):824-832.
[15]Bryngelsson S,Dimberg LH,Kamal-Eldin A.Effects of commercial processing on levels of antioxidants in oats(Avena sativa L.)[J].Journal of Agricultural and Food Chemistry,2002,50(7):1890-1896.
[16]Davis DA,Arnold C.Effects of two extrusion processing conditions on the digestibility of four cereal grains for Penaeus vannamei[J].Aquaculture,1995,133(3):287-294.
[17]Min B,Gu L,McClung AM,et al.Free and bound total phenolic concentrations,antioxidant capacities,and profiles of proanthocyanidins and anthocyanins in whole grain rice(Oryza sativa L.)of different bran colours[J].Food Chemistry,2012,133(3):715-722.
[18]Liyana-Pathirana CM,Shahidi F.Antioxidant activity of commercial soft and hard wheat(Triticum aestivum L.) as affected by gastric pH conditions[J].Journal of Agricultural and Food Chemistry,2005,53(7):2433-2440.
[19]Pan GX,Bolton JL,Leary GJ.Determination of ferulic and p-coumaric acids in wheat straw and the amounts released by mild acid and alkaline peroxide treatment[J].Journalof Agricultural and Food Chemistry,1998,46(12):5283-5288.
[20]Yang Z,Zhai W.Identification and antioxidant activity of anthocyanins extracted from the seed and cob of purple corn(Zea mays L.)[J].Innovative Food Science&Emerging Technologies,2010,11(1):169-176.
Effect of extrusion on the antioxidant ability of brown rice in vitro
YANG Ling-xiao,CHENG Li-lin,ZHANG Hui*,HUA Dan,GU Zhong-hua,Qi Xi-guang,WANG Li,QIAN Hai-feng
(China State Key Laboratory of Food Science and Technology,School of Food Science and Technology,Jiangnan University,Wuxi 214122,China)
Extrusion was employed for the process of the brown rice in the present study.Free and bound phenolics were respectively extracted from processed and unprocessed brown rice.The content of total phenols,scavenging ability of ABTS radicals,and ferric reducing antioxidant potential(FRAP)of the extracts was determined for both free and bound extracts.The relationship between phenols and their antioxidant properties was analyzed.Degree of brown rice starch gelatinization of extruded brown rice was also determined. Results showed that the free and bound phenol contents ranged from 210.48 to 747.70μg/g(GAE/DW)and 260.77 to 470.94μg/g(GAE/DW),respectively.The scavenging ability on ABTS+radicals and FRAP value of the free and bound extracts ranged from 1.15 to 4.52μmol/g(Trolox/DW)and 3.09 to 4.97μmol/g(Trolox/DW),2.57 to 9.86μmol/g(FeSO4/DW)and 4.53 to 7.03μmol/g(FeSO4/DW),respectively.Degree of brown rice starch gelatinization increased with the temperature of extrusion,when the temperature was higher than 130℃,no significant change was observed.The correlation analysis indicated that no significant correlation was observed between free phenolics and antioxidant ability,whereas a significant correlation was observed between bound phenolics and antioxidant ability.
brown rice;phenol;antioxidant;extrusion;degree of starch gelatinization
TS202.1
A
1002-0306(2014)08-0135-05
10.13386/j.issn1002-0306.2014.08.021
2013-07-22 *通讯联系人
杨凌霄(1988-),男,硕士研究生,主要从事粮食深加工及资源利用方面的研究。

