黄参茎叶中酚类提取物的抗氧化活性研究
马婷婷,田呈瑞,马锦锦,张 娟,张颖娜,赵 珮,宋溪子
(陕西师范大学食品工程与营养科学学院,陕西西安710062)
黄参茎叶中酚类提取物的抗氧化活性研究
马婷婷,田呈瑞*,马锦锦,张 娟,张颖娜,赵 珮,宋溪子
(陕西师范大学食品工程与营养科学学院,陕西西安710062)
为研究黄参茎叶中酚类提取物的抗氧化活性,本文以分光光度法测定黄参茎叶中酚类提取物的总还原力、亚铁离子螯合能力、对β-胡萝卜素/亚油酸自氧化体系的抑制作用、对亚硝酸盐的清除作用,及对DPPH自由基(DPPH·)、羟基自由基(·OH)、超氧阴离子(O2-·)的清除作用,并与人工合成的抗氧化剂2,6-二叔丁基-4-甲基苯酚(BHT)和天然抗氧化剂VC进行对比。结果表明:黄参茎叶多酚具有较好的体外抗氧化性能,部分指标甚至优于阳性对照;相同浓度下黄参茎叶多酚粗提物和纯化物在不同测定体系中的清除能力有显著性差异(p<0.05)。黄参茎叶中酚类提取物可作为天然抗氧化剂进一步开发和利用。
黄参,茎叶,酚类提取物,抗氧化活性
大量研究表明,活性氧自由基与机体的衰老、肿瘤、心血管和炎症疾病等有密切关系,一些外源性天然抗氧化剂能拮抗体内过量的自由基,从而预防相关疾病的产生,维护人体的健康[1]。因此,寻找合适有效的外源抗氧化剂尤其是天然抗氧化剂便成了科技工作者研究的兴趣所在[2]。植物多酚则是一类来源丰富的天然抗氧化剂。
黄参(Sphallerocarpus gracilis),系伞形科迷果芹属植物迷果芹,多年生草本,根块状或圆锥形,通体金黄色,可食[1],是一种极具开发前景的药食兼用植物,整个植株均可入药或食用,是一种传统的藏药,用于治疗风湿性关节痛[3]。根据《本草纲目》和《晶珠本草》记载,黄参有补气养血、滋阴壮阳、通经活络、舒肝健胃的功效,并且对黄水病,腰肾寒症有很好的疗效,被誉为“小人参”。黄参在我国分布广、资源丰富,然而,目前有关黄参的研究、开发较少,仅有的文献报道也只局限于黄参根部、籽中的化学成分、微量元素的分析及功效作用[4-7]。而有关黄参茎叶抗氧化方面的研究国内外未有报道,本研究以黄参茎叶为原料,采用7种体外抗氧化体系全面评价黄参茎叶多酚的抗氧化活性,以期为黄参茎叶的开发利用提供理论依据和技术参数。
1 材料与方法
1.1 材料与仪器
黄参茎叶 于2012年7月采自甘肃山丹军马场,采第二年茎叶;没食子酸标准品、碳酸钠、福林酚试剂,无水乙醇、亚硝酸钠、硝酸铝、氢氧化钠、三氯化铁、三氯乙酸、氯仿、铁氰化钾、二氯化亚铁、水杨酸、三羟甲基氨基甲烷(Tris)、盐酸、邻苯三酚、对氨基苯磺酸、盐酸萘乙二胺、硫酸亚铁、菲洛嗪、β-胡萝卜素、亚油酸、吐温40、磷酸氢二钠、磷酸二氢钠、双氧水等 均为分析纯,西安化学试剂厂;BHT、抗坏血酸 食品级,西安化学试剂厂。
BS200S-WEl电子分析天平 北京赛多利斯;电热恒温鼓风干燥箱 上海福玛;LXJ-II B型高速离心机 上海安亭;SG4050C恒温水浴锅;RE-52旋转式蒸发器 上海安亭;722型可见分光光度计 上海光谱;FW100型高速万能植物粉碎机;其他均为实验室常用设备与仪器。
1.2 样品制备工艺流程
黄参茎叶→去除杂物→洗净→晒至半干→烘箱内40℃烘干→植物粉碎机粉碎→过60目筛→70%乙醇70℃超声提取30min→滤液真空30℃旋转蒸发浓缩至近干→真空冷冻干燥→多酚粗提物→经X-5大孔树脂纯化(上样流速2mL/min,上样浓度1mg/mL,上样温度30℃,70%乙醇解析)→多酚纯化物。
分别将黄参茎叶多酚粗提物和纯化物的冻干样品用70%的乙醇配成浓度分别为0.1、0.2、0.4、0.6、0.8、1.0mg/mL的溶液即为待测液;用相同浓度的抗坏血酸和BHT溶液作阳性对照。
1.3 样品总酚含量的测定
采用Folin-Ciocalteu法测定。取0.2mL提取液于10mL容量瓶中,加入1.0mL的福林酚试剂,再加入7.5%的碳酸钠2mL,用蒸馏水定容至10mL摇匀,暗室放置60min后在765nm波长条件下测定吸光度(A),以没食子酸标准溶液质量浓度(μg/mL)为横坐标x、吸光度(A)为纵坐标绘制标准曲线,标准曲线方程为:A=0.1159x+0.0045,相关系数R2=0.999。将吸光值带入标准曲线方程,求得试样中总多酚的浓度。
1.4 清除DPPH自由基能力的测定
参照Brandwilliams等[8]的方法,稍作修改以测定黄参茎叶多酚粗提物和纯化物对DPPH自由基的清除能力。实验测定前,配制0.1mmol/L的DPPH乙醇溶液。精确吸取2.0mL的不同浓度多酚样品溶液(0.1~ 1.0mg/mL)和6.0mL新配制的DPPH溶液于试管中混匀,避光反应30min于517nm处测定其吸光度。空白对照用等体积的蒸馏水代替多酚样品液测定乙醇溶液中未反应之前DPPH的吸光度。用与样品溶液同浓度的抗坏血酸溶液和BHT溶液作为阳性对照。以样品液浓度为横坐标,自由基清除率为纵坐标作图分析样品清除自由基的能力。对DPPH自由基的清除能力按式(1)计算:

其中:I表示对自由基的清除率,%;Ai表示样品溶液和DPPH溶液混合液的吸光度(2mL样品溶液+ 6mL的DPPH溶液);Aj表示未加DPPH溶液的样品溶液的吸光度(2mL样品溶液+6mL的乙醇溶液);A0表示未加样品时DPPH溶液的吸光度(2mL乙醇溶液+ 6mL的DPPH溶液)。
1.5 β-胡萝卜素/亚油酸体系中抗氧化能力的测定在Siddhuraju等[9]的方法的基础上稍作修改:将5mg的β胡萝卜素溶于10mL氯仿中,再加入0.125mL的亚油酸和2mL的Tween-20,将此混合物移入圆底瓶中于50℃旋转蒸发4min之后加入500mL蒸馏水。向各试管中加入2mL不同浓度的待测液和8mL反应液,置于50℃水浴中每隔25min测其在470nm处的吸光度(分别在不同浓度待测液构成的体系中,以蒸馏水作为空白调零),共测量150min。抗氧化能力按下列式(2)计算:

其中:S为样品的抗氧化能力,%;A0表示样品溶液在零反应时刻的吸光值;A0’表示空白对照溶液在零反应时刻的吸光值;At表示样品溶液在t反应时刻对应的吸光值;At’表示空白对照t反应时刻对应的吸光值。
1.6 还原能力的测定
黄参茎叶多酚样品液还原能力的测定在Vaquero等[10]的方法基础上稍作修改:取2.5mL的样液加入装有2.5mL磷酸缓冲液(0.2mol/L,pH=6.6)的试管中,再加入2.5mL 1%的铁氰化钾溶液混合均匀。50℃反应20min后,加入2.5mL 10%的三氯乙酸在3000r/min的转速下离心10min,取上清液5mL与4mL的蒸馏水和0.5mL 0.1%的三氯化铁溶液混合。反应10min后,在700nm处测其吸光度。混合液的吸光度越高表示黄参茎叶多酚样品提取液的还原能力越强。
1.7 清除羟基自由基能力的测定
按照Yan等[11]的方法测定黄参茎叶多酚样品提取液对羟基自由基的清除能力。将2mL的样品溶液与2mL氯化亚铁(2mmol/L)、2mL的过氧化氢溶液(2mmol/L)和2mL的水杨酸(6mmol/L)混合,再加入10mL蒸馏水,在37℃的水浴锅中反应30min,在510nm处设置空白对照测其吸光值。阳性对照为抗坏血酸和BHT。以样品浓度为横坐标,清除率为纵坐标作图分析对羟基自由基的清除能力。清除率(SA)按以下式(3)计算:

其中:A0表示未加样品混合液的吸光度(2mL的氯化亚铁+2mL过氧化氢+2mL水杨酸);Ai表示样品的吸光度(2mL的氯化亚铁+2mL过氧化氢+2mL水杨酸+2mL的样品溶液);Aj未加过氧化氢溶液样品的吸光度(2mL的氯化亚铁+2mL水杨酸+2mL的样品溶液);SA为样品对羟基自由基的清除率,%。
1.8 清除超氧阴离子自由基能力的测定
根据稍作修改的Marklund等[12]的方法测定样液清除超氧阴离子的能力。取4.5mL Tris-HCL(0.05mol/L,pH=8.2)的缓冲液,25℃水浴预热20min,然后加入1mL不同浓度的样品溶液和0.4mL邻苯三酚溶液(0.025mol/L)混合均匀。将混合液置于25℃水浴反应4min。加入1.0mL盐酸溶液(8mmol/L)终止反应。设置空白对照于320nm处测定混合液的吸光值。以抗坏血酸和BHT作阳性对照。样品液清除超氧阴离子的能力按以下式(4)计算:以蒸馏水作参比,420nm波长下测定其吸光度。
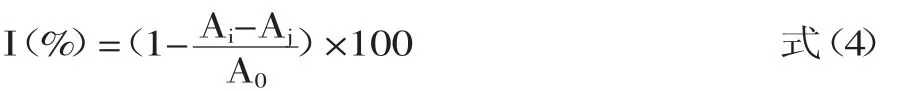
其中:I表示清除率,%;A0表示未加样品混合液的吸光值;Ai表示测试样品的吸光值;Aj表示不含邻苯三酚混合液的吸光值。
1.9 对亚硝酸盐清除作用的测定[13]
取不同浓度的样品液2mL于25mL容量瓶,加入NaNO2标准溶液(5μg/mL)3mL,加入柠檬酸-磷酸缓冲溶液(pH=3.0)5mL,37℃下反应30min,立即加入2mL 0.4%对氨基苯磺酸溶液,混匀,静置3~5min后,加入1mL 0.2%盐酸萘乙二胺溶液,加蒸馏水至刻度,混匀,静置15min,以5mL提取液为参比调零,在544 nm处测吸光度。按式(5)计算NO2-的清除率。
M(%)=(A0-A)/A0×100 式(5)
其中:M表示清除率,%;A0表示未加样品时亚硝酸盐的吸光值;A表示加样品时亚硝酸盐的吸光值。
1.10 亚铁离子鳌合能力 移取1mL不同浓度的样品液,加入1mL 0.1mmol/L硫酸亚铁和1mL 0.25mmol/L菲洛嗪。反应混合物静置10min,在562nm下测定吸光度[14]。用1mL 70%的乙醇代替提取物作为对照,亚铁离子鳌合能力用式(6)计算:
D(%)=(A0-A)/A0×100 式(6)
其中:D表示亚铁离子螯合率,%;A0表示未加样品液时的吸光值;A表示加样品液时的吸光值。
1.11 统计分析 采用EXCEL2007、SPSS等软件进行数据处理及分析。
2 结果与分析
2.1 黄参茎叶多酚提取物中总酚含量
经Folin-Ciocalteu法测定,黄参茎叶多酚粗提物中总多酚含量为8.29%,纯化物中总多酚含量为32.62%。
2.2 清除DPPH自由基的能力
不同质量浓度的样品和阳性对照清除DPPH自由基能力如图1所示。黄参茎叶多酚粗品、纯品、BHT清除DPPH自由基的能力在低浓度范围内量效关系增加明显,但在高浓度范围内清除能力增加较为平缓,而VC在整个浓度范围内均表现出超强的抗氧化性;显著性分析显示纯品对DPPH自由基的清除力高于同浓度下的粗品和BHT,在1mg/mL时其清除率高达92.32%,但略低于VC(95.86%);粗品在(0.1~0.6mg/mL)浓度范围内对DPPH自由基的清除能力高于BHT,而在(0.6~ 1.0mg/mL)浓度范围内低于BHT;综上比较可知,黄参茎叶中多酚类物质具有较强的DPPH自由基清除能力。

图1 样品、BHT和VC对DPPH自由基的清除效果Fig.1 Scavenging effects of sample,BHT and VCon DPPH radical

图2 样品、BHT和VC在β-胡萝卜素/亚油酸体系中的抗氧化能力Fig.2 Antioxidant activity of sample,BHT,and VCby β-carotene-linoleate model system

图3 样品、BHT和VC对β-胡萝卜素漂白的抑制效果Fig.3 Bleaching inhibitory effect of sample,BHT,and VCon the β-carotene
2.3 β-胡萝卜素/亚油酸体系中的抗氧化能力
图2显示了抗氧化剂存在的情况下,与β-胡萝卜素/亚油酸体系耦合氧化过程中,β-胡萝卜素吸光值逐渐降低的过程。从图2可看出,与VC相比,各浓度样品、BHT均具有显著的抗氧化作用。多酚样品在亚油酸体系中具有较高的过氧化抑制能力,这与文献[15]中的研究报道相一致。VC作为一种亲水性抗氧化剂,在水包油乳化体系中,效果不明显。相反的,亲脂性抗氧化剂(酚酸、黄烷酮、黄烷醇等)在上述水包油体系中具有较强的抗氧化性能。按照式(2)计算150min时不同质量浓度的黄参茎叶多酚样品、BHT和抗坏血酸在β-胡萝卜素/亚油酸体系中的抗氧化能力,其结果如图3所示。由图3可知,质量浓度为0.9mg/mL的VC溶液在此体系中的抗氧化能力很小,仅为12.16%,而质量浓度为0.5mg/mL的BHT溶液在此体系中具有显著的抗氧化效果,其抑制效果为87.64%。黄参茎叶多酚提取物在此体系中也具有较显著的抗氧化能力,当其粗品质量浓度为0.5mg/mL时,清除率为61.78%,当其浓度增加到0.9mg/mL时,其清除率增加到76.64%。纯品质量浓度为0.5mg/mL时,清除率为67.37%,当其浓度增加到0.9mg/mL时,其清除率增加到84.56%。此外还可得出,在此体系中,各浓度的多酚纯品的抗氧化性均高于粗品。
2.4 样品的还原能力
黄参茎叶多酚、抗坏血酸和BHT的还原能力如图4所示。从图4中可得出,随各组质量浓度的增加,其还原力也随之增加。在实验浓度范围内,还原力与浓度呈现一定的量效关系,同等浓度条件下,还原能力的大小顺序为VC>BHT>纯品>粗品。此外,显著性分析显示相同浓度下黄参茎叶多酚粗品和纯品的还原力差异较小,且两者的还原能力均较低。说明黄参茎叶多酚具有较弱的还原能力。

图4 样品、BHT和VC的还原能力Fig.4 Reducing power of sample,BHT and VC
2.5 清除羟基自由基的测定
从图5可发现,在测试浓度范围内,黄参茎叶多酚粗提物、纯化物、BHT清除羟基自由基的能力随样品浓度增大而逐渐增强,VC对羟基自由基的清除能力明显大于其他三者,在0.4mg/mL时其清除率便高达98.45%;同时还可看出:黄参茎叶多酚粗品、纯品、BHT对羟基自由基的清除能力无显著性差异(p>0.05),在测试浓度范围内,三者对羟基自由基的清除率基本保持在21.25%~49.46%,说明黄参茎叶酚类提取物具有一定的清除羟基自由基的能力,且其清除能力与BHT相当。

图5 样品、BHT和VC对羟基自由基的清除能力Fig.5 Scavenging effects of sample,BHT and VCon hydroxyl radical
2.6 清除超氧阴离子的能力
图6所示为黄参茎叶多酚提取物、抗坏血酸和BHT对超氧阴离子的清除效果。从图中可知,VC对超氧阴离子具有较高的清除能力,在1mg/mL时其清除率高达86.18%,且在实验范围内呈现明显的量效关系;粗品、纯品、BHT对超氧阴离子基本没有清除能力,某些浓度点甚至出现负清除的现象,说明实验样品浓度较低时不但不能有效清除超氧阴离子自由基,反而能促进其生成,可能原因是由于被测物质体系中含有与产生超氧阴离子自由基物质—邻苯三酚相似的物质,从而促进了超氧阴离子自由基的产生,具体原因及机理有待于进一步研究[16]。

图6 样品、BHT和VC对超氧阴离子的清除效果Fig.6 Scavenging effects of sample,BHT and VCon superoxide free radical
2.7 对亚硝酸盐的清除作用
图7所示为黄参茎叶多酚提取物、抗坏血酸和BHT对亚硝酸盐的清除效果。从图7中可以看出,黄参茎叶多酚提取物对亚硝酸盐具有一定的清除效果,并随着其质量浓度的增加,清除率也随之升高,具有明显的量效关系,并且同浓度下清除亚硝酸盐的大小顺序为VC>BHT>纯品>粗品。同时还可得出:黄参茎叶多酚粗品、纯品对亚硝酸盐的清除能力无显著性差异(p>0.05),在实验浓度范围内,其清除率在7.39%~46.18%之间。
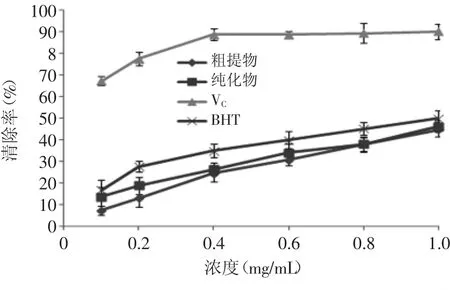
图7 样品、BHT和VC对亚硝酸盐的清除效果Fig.7 Scavenging effects of sample,BHT and VCon nitrite
2.8 样品的亚铁离子螯合能力
测定亚铁离子螯合能力的大小也是评价氧化剂抗氧化性能常用的方法。螯合能力越强表示被评价的抗氧化剂潜在的抗氧化性就愈强[17]。从图8可知,黄参茎叶多酚粗品的亚铁离子螯合能力显然高于同浓度下纯品、BHT和VC。VC在实验浓度范围内显示很弱的亚铁离子螯合能力(5%以下),而BHT和纯品在实验浓度范围内均表现为无亚铁离子螯合能力,粗品和纯品对亚铁离子螯合能力的不同可能是由于不同纯度的酚类提取物中酚类化合物组成不同所致。

图8 样品、BHT和VC的亚铁离子螯合能力Fig.8 Ferrous ion chelating ability of sample,BHT and VC
3 结论
本文分别采用7种体外抗氧化体系,对黄参茎叶多酚粗提物、纯化物的抗氧化活性进行综合评价。结果表明:黄参茎叶多酚具有较高的清除DPPH自由基的能力、脂质抗氧化能力;较好的清除羟基自由基、亚硝酸盐的能力;一定的还原能力;基本不具有清除超氧阴离子的作用,但具有较弱的亚铁离子螯合能力。综上所述,黄参茎叶多酚提取物显示具有较好的抗氧化性能,部分指标甚至比阳性对照效果还好,可作为天然抗氧化剂进一步开发利用。
[1]Yu H H,Liu X G,Xing R E,et al.In vitro determination of antioxidantactivity ofproteins from jellyfish Rhopilema esculentum[J].Food Chemistry,2006,95(1):123-130.
[2]Terashima M,Nakatani I,Harima A,et al.New method to evaluate water-soluble antioxidant activity based on protein structural change[J].Journal of Agriculture Food Chemistry,2007,55:165-169.
[3]中国科学院西北高原生物研究所.青海经济植物志[M].西宁:青海人民出版社,1987:417-418.
[4]Gao C Y,Lu Y H,Tian C R,et al.Main nutrients,phenolics,antioxidantactivity, DNA damage protective effect and microstructure of Sphallerocarpus gracilis root at different harvest time[J].Food Chemistry,2011,127:615-622.
[5]Gao C Y,Tian C R,Lu Y H,et al.Essential oil composition and antimicrobial activity of Spha llerocarpus gracilis seeds against selected food-related bacteria[J].Food Control,2011,22(3-4):508-516.
[6]Shi R M,Pe D,Liu J X,et al.Chemical constituents from Sphallerocarpus gracilis[J].Biochem Syst Ecol,2012,127:1-3.
[7]郝果,田呈瑞,高春燕,等.不同采收期黄参功效成分及甲醇提取物抗氧化性研究[J].食品工业科技,2012,33(5):131-133.
[8]Brandwiliams W,Cuvelier M E,Berset C.Use of a freeradical method to evaluate antioxidant activity[J].Food Science and Technology-Lebensmittel-Wissenschaft& Technology,1995,28(1):25-30.
[9]Siddhuraju P,Becker K.Studies on antioxidant activities of mucuna seed(Mucuna pruriens var utilis)extract and various non-protein amino/imino acids through in vitro models[J]. Journal of the Science of Food and Agriculture,2003,83(14):1517-1524.
[10]Vaquero M J R,Serravalle L R T,de Nadra M C M,et al. Antioxidantcapacity and antibacterialactivity ofphenolic compounds from argentinean herbs infusions[J].Food Control,2010,21(5):779-785.
[11]Li Y H,Jiang B,Zhang T,et al.Antioxidant and free radical-scavenging activities of chickpea protein hydrolysate[J]. Food Chemistry,2008,106(2):444-450.
[12]Marklund S,Marklund G.Involvement of the superoxide anion radical in the autoxidation of pyrogallol and a convenient assay for superoxide dismutase[J].European Journal of Biochemistry,1974,47(3):469-474.
[13]薛长晖,王佩维,姚晨之.苦荞粉提取液对NO2-清除作用的体外实验研究[J].粮油加工与食品机械,2002(10):48-49.
[14]Gülçin I,Berashvili D,Gepdiremen A.Antiradical and antioxidant activity of total anthocyanins from Perilla pankinensis decne[J].Journal of Ethnopharmacology,2005,101:287-293.
[15]Siddhuraju P,Becker K.Antioxidant properties of various solvent extracts of total phenolic constituents from three different agroclimatic origins of drumstick tree(Moringa oleifera Lam.)leaves[J].Journal of Agriculture and Food Chemistry,2003,51(8):2144-2155.
[16]张清安,范学辉,张志琪,等.沙苑子酚类提取物的抗氧化能力研究[J].天然产物研究与开发,2012,24(5):955-958.
[17]李均,陈炳华,苏安玲.中华补血草根提取物抗氧化活性的初步研究[J].福建师范大学学报:自然科学版,2008,24(3):83-87.
Antioxidant capacity of phenolic extracts from Sphallerocarpus gracilis stem leaves
MA Ting-ting,TIAN Cheng-rui*,MA Jin-jin,ZHANG Juan,ZHANG Ying-na,ZHAO Pei,SONG Xi-zi
(College of Food Engineering and Nutritional Science,Shaanxi Normal University,Xi’an 710062,China)
The antioxidant activity of phenolic extracts from Sphallerocarpus gracilis stem leaves was studied. The antioxidant activity of the extract was evaluated by spectrophotometry on its ability of scavenging 1-diphenyl-2-picrylhydrazy(DPPH·),hydroxyl radical(·OH),superoxide anion radical(O2-·),nitrite,β-carotene bleaching test,and total reducing power.BHT and VCwere used as positive control.Results indicated that the polyphenol extracts had a good antioxidant capacity,some indicators even better than the positive control.In addition,polyphenol extracts and purified in a different measurement system in the scavenging ability were quite different at the same concentration(p<0.05).It could be used as natural antioxidants further developed and utilized.
Sphallerocarpus gracilis;stem leaves;phenolic extracts;antioxidant
TS201.2
A
1002-0306(2014)08-0109-05
10.13386/j.issn1002-0306.2014.08.015
2013-08-02 *通讯联系人
马婷婷(1987-),女,博士研究生,研究方向:食品新资源开发利用。
陕西师范大学研究生培养创新基金(2013CXS005)。

