新生儿窒息后血清髓鞘碱性蛋白、促红细胞生成素受体、胰岛素样生长因子-1的表达及临床意义
张肖 兰海霞
内蒙古医科大学,内蒙古呼和浩特010051
新生儿窒息后血清髓鞘碱性蛋白、促红细胞生成素受体、胰岛素样生长因子-1的表达及临床意义
张肖 兰海霞
内蒙古医科大学,内蒙古呼和浩特010051
目的研究血清髓鞘碱性蛋白(MBP)、促红细胞生成素受体(EPOR)、胰岛素样生长因子.1(IGF.1)在诊断新生儿窒息的意义,以及MBP、EPOR、IGF.1之间的相关性及其临床意义。方法选择74例有窒息病史的新生儿为观察组,37例无窒息病史的新生儿为对照组,均于出生后24 h内采集静脉血,离心取上清,ELISA法检测其EPOR、MBP、IGF.1含量,并作统计学分析。结果足月窒息组血清MBP[(5.81±1.83)μg/L]及EPOR[(404.98± 152.75)ng/L]较足月新生儿组血清MBP[(2.57±0.77)μg/L]及EPOR[(269.58±51.36)ng/L]显著升高(t=6.974,P<0.01;t=3.541,P<0.01);血清IGF.1[(36.29±11.43)μg/L]较足月新生儿组血清IGF.1[(62.25±11.97)μg/L]显著降低(t=7.529,P<0.01)。早产窒息组血清MBP[(7.81±2.38)μg/L]及EPOR[(338.85±104.64)ng/L]较早产儿组血清MBP[(3.41±1.32)μg/L]及EPOR[(216.14±45.70)ng/L]显著升高(t=7.676,P<0.01;t=4.995,P<0.01);血清IGF.1[(26.99±8.65)μg/L]较早产儿组血清IGF.1[(52.56±15.36)μg/L]显著降低(t=8.262,P<0.01)。IGF.1与MBP、EPOR呈明显的负相关(r=.0.694,P<0.01;r=.0.489,P<0.01),MBP与EPOR呈明显的正相关(r=0.687,P<0.01)。结论EPOR、MBP、IGF.1早期的联合检测对评估新生儿缺血缺氧程度具有一定的意义,对脑损伤的早期诊断有一定的辅助意义。
髓鞘碱性蛋白;促红细胞生成素受体;胰岛素样生长因子-1;脑损伤;窒息;新生儿
大脑是全身耗氧量最大的器官,对缺氧最敏感。如果脑动脉血流中断10~30 s,脑细胞由于缺血缺氧将受到轻度损害;若血流中断3~5 min,大脑细胞将受到严重损害且较难修复;假如血流持续完全中断达30 min,将发生不可逆的损害,细胞坏死,功能丧失。因此,早期诊断新生儿窒息引起的缺氧缺血性脑损伤性疾病非常重要。若早期进行干预治疗,可明显减小并发症及后遗症的发生率。目前临床上对新生儿窒息缺氧等脑损伤性疾病的临床判断主要依赖于Apgar评分,影像学检查,血清NSE检测等。Apgar评分是国际上公认的评价新生儿临床状况的方法,被广泛应用于新生儿的窒息诊断[1],有研究表明,Apgar评分的高低与窒息程度并不存在正比例关系[2],因此单依据Apgar评分来诊断早产儿窒息是不可靠的。传统的影像学检查对于脑损伤的检测使用已久,但是对缺血性脑损伤的诊断在时间上存在一定的局限性。近几年,神经元特异性烯醇化酶(neuron.specific enolase,NSE)研究较热,为神经细胞、神经内分泌细胞内的一种γ烯醇化酶。但是中枢神经系统之外的一些组织或器官的病变或损伤也可引起NSE升高,如心脏损伤、严重软组织损伤、乳腺癌、黑色素瘤、神经母细胞瘤、小细胞肺癌、结直肠癌、胆道阻塞、慢性阻塞性肺疾病等,在一些正常人中也可出现一定比例的假阳性反应[3]。因此,单独检测血清NSE水平对诊断新生儿窒息特异性不高。寻找其他更敏感的检测缺氧脑损伤的检测因子或联合几个检测因子提高其诊断率显得尤为必要。本文旨在探讨新生儿窒息后血清MBP、EPO.R、IGF.1的联合检测的意义,结合目前已有检测手段,或许可以进一步完善窒息缺氧等脑损伤的检测方法。
1 资料与方法
1.1 一般资料
观察组74例患儿均为2012年3月~2013年3月于解放军第253医院及内蒙古自治区妇幼保健院新生儿科住院患儿,按照胎龄分为足月窒息组与早产窒息组。足月窒息组34例,胎龄37~42周;体重2.5~4.0 kg;男婴16例,女婴18例。早产窒息组40例,胎龄32~37周;体重1.8~2.5 kg;男婴22例,女婴18例。根据Apgar评分及头颅CT和核磁检查足月窒息组及早产窒息组又分别分为轻度窒息组、中度窒息组及重度窒息组。生后1 min Apgar评分6~7分为轻度窒息组,生后1 min Apgar评分4~5分为中度窒息组,生后1 min Apgar评分0~3分为重度窒息组。对照组37例为同期出生无缺氧窒息史且Apgar评分为8~10分的新生儿,按照胎龄及体重分为足月新生儿组与早产儿组。其中足月新生儿组17例,孕龄37~42周;体重2.5~4.0 kg;男婴9例,女婴8例。早产儿组20例,孕龄32~37周;体重1.8~2.5 kg;男婴4例,女婴16例。均无严重感染、肝脏疾病、先天性畸形及代谢性疾病、染色体异常、母亲内分泌性等疾病。各新生儿组性别、分娩方式、胎龄比较,差异无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会通过,并经家属同意签署知情同意书。
1.2 方法
1.2.1 标本采集观察组与对照组均于生后24 h内取静脉血5 mL,室温静置2 h离心(3000 r/min,10 min,离心半径10 cm),分离血清,并分置于Eppendorf管中,.70℃冰箱保存待测。
1.2.2 检测方法采用双抗体夹心酶联免疫法测定血清MBP、EPOR、IGF.1含量,试剂盒购自美国CUSABIO公司,测量范围分别为0.156~15 μg/L,47~3000 ng/L,7.8~500 μg/L。实验步骤严格按照试剂盒说明书要求进行。
1.3 统计学方法
采用SPSS 13.0统计软件包进行统计学处理,计量资料以均数±标准差(s)表示,两样本均数比较采用t检验,多样本均数比较采用单因素方差分析(one. way ANOVA)。MBP、EPOR、IGF.1之间的相关性分析采用Pearson相关,以P<0.05为差异有统计学意义。
2 结果
2.1 足月窒息组患儿与足月新生儿组患儿血清MBP、EPOR、IGF-1水平的比较
足月窒息组MBP、EPOR血清水平明显高于足月新生儿组,差异有高度统计学意义(t=6.974,P<0.01;t=3.541,P<0.01);IGF.1水平窒息组与对照组比较显著降低,差异有高度统计学意义(t=7.529,P<0.01)。见表1。
表1 足月窒息组与足月新生儿组患儿血清MBP、EPOR、IGF-1水平比较(±s)
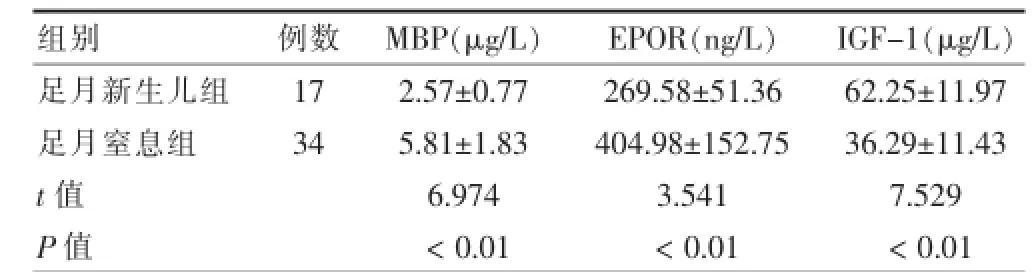
表1 足月窒息组与足月新生儿组患儿血清MBP、EPOR、IGF-1水平比较(±s)
注:MBP:髓鞘碱性蛋白;EPOR:促红细胞生成素受体;IGF.1:胰岛素样生长因子.1
组别例数M B P ( μ g / L ) E P O R ( n g / L ) I G F . 1 ( μ g / L )足月新生儿组足月窒息组1 7 3 4 t值P值2 . 5 7 ± 0 . 7 7 5 . 8 1 ± 1 . 8 3 6 . 9 7 4<0 . 0 1 2 6 9 . 5 8 ± 5 1 . 3 6 4 0 4 . 9 8 ± 1 5 2 . 7 5 3 . 5 4 1<0 . 0 1 6 2 . 2 5 ± 1 1 . 9 7 3 6 . 2 9 ± 1 1 . 4 3 7 . 5 2 9<0 . 0 1
2.2 足月窒息组各亚组(轻、中、重)患儿血清MBP、EPOR、IGF-1水平比较
重度窒息组血清MBP、EPOR水平明显高于轻、中度窒息组(P<0.01),中度窒息组血清MBP、EPOR水平高于轻度窒息组(P<0.01、P<0.05)。轻度窒息组血清IGF.1水平高于中、重度窒息组(P<0.05、P<0.01),且中度窒息组血清IGF.1水平显著高于重度窒息组(P<0.01)。见表2。
2.3 早产窒息组与早产儿组患儿血清MBP、EPOR、IGF-1水平比较
早产窒息组MBP、EPOR血清水平明显高于早产儿组,差异有高度统计学意义(t=7.676,P<0.01;t= 4.995,P<0.01),IGF.1较早产儿组显著降低,差异有高度统计学意义(t=8.262,P<0.01)。见表3。
表2 足月窒息组各亚组(轻、中、重)患儿血清MBP、EPOR、IGF-1水平比较(s)
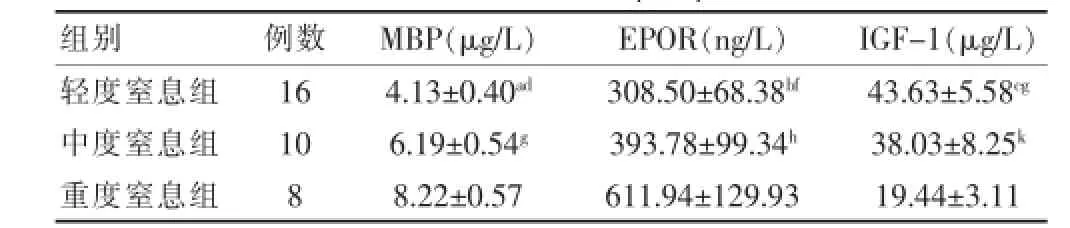
表2 足月窒息组各亚组(轻、中、重)患儿血清MBP、EPOR、IGF-1水平比较(s)
注:与中度组比较,t=.6.648,aP<0.01;t=.2.599,bP<0.05;t= 2.070,cP<0.05。与重度组比较,t=.13.202,dP<0.01;t=.7.029,gP<0.01;t=7.574,fP<0.01;t=11.325,gP<0.01;t=6.010,kP<0.01;MBP:髓鞘碱性蛋白;EPOR:促红细胞生成素受体;IGF.1:胰岛素样生长因子.1
组别例数M B P ( μ g / L ) E P O R ( n g / L ) I G F . 1 ( μ g / L )轻度窒息组中度窒息组重度窒息组1 6 1 0 8 4 . 1 3 ± 0 . 4 0ad6 . 1 9 ± 0 . 5 4g8 . 2 2 ± 0 . 5 7 3 0 8 . 5 0 ± 6 8 . 3 8bf3 9 3 . 7 8 ± 9 9 . 3 4h6 1 1 . 9 4 ± 1 2 9 . 9 3 4 3 . 6 3 ± 5 . 5 8cg3 8 . 0 3 ± 8 . 2 5k1 9 . 4 4 ± 3 . 1 1
表3 早产窒息组与早产儿组患儿血清MBP、EPOR、IGF-1水平比较(±s)
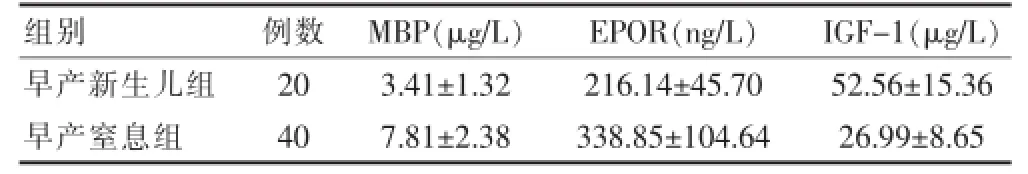
表3 早产窒息组与早产儿组患儿血清MBP、EPOR、IGF-1水平比较(±s)
注:MBP:髓鞘碱性蛋白;EPOR:促红细胞生成素受体;IGF.1:胰岛素样生长因子.1
组别例数M B P ( μ g / L ) E P O R ( n g / L ) I G F . 1 ( μ g / L )早产新生儿组早产窒息组2 0 4 0 3 . 4 1 ± 1 . 3 2 7 . 8 1 ± 2 . 3 8 2 1 6 . 1 4 ± 4 5 . 7 0 3 3 8 . 8 5 ± 1 0 4 . 6 4 5 2 . 5 6 ± 1 5 . 3 6 2 6 . 9 9 ± 8 . 6 5
2.4 早产窒息组各亚组(轻、中、重)患儿血清MBP、EPOR、IGF-1水平比较
重度窒息组血清MBP、EPOR水平高于轻、中度窒息组,差异有统计学意义(P<0.01或P<0.05);中度窒息组血清MBP、EPOR水平较轻度窒息组血清MBP、EPOR水平明显升高(P<0.01)。轻度窒息组血清IGF.1水平高于中、重度窒息组(P<0.01或P<0.05),中度窒息组血清IGF.1水平显著高于重度窒息组(P<0.01)。见表4。
表4 早产窒息组各亚组(轻、中、重)患儿血清MBP、EPOR、IGF-1水平比较(±s)
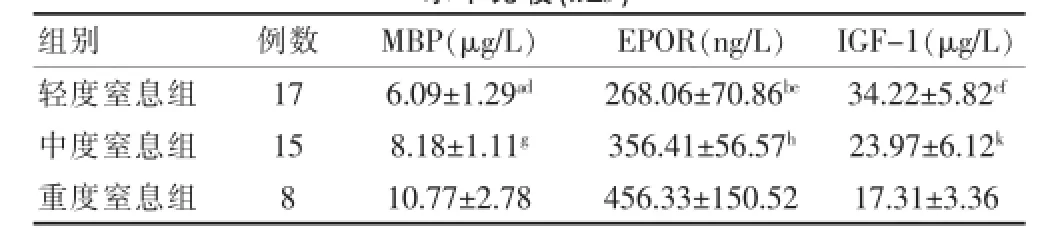
表4 早产窒息组各亚组(轻、中、重)患儿血清MBP、EPOR、IGF-1水平比较(±s)
注:与中度组比较,t=4.892,aP<0.01;t=3.863,bP<0.01;t= 4.855,cP<0.01。与重度组比较,t=5.830,dP<0.01;t=4.937,eP<0.01;t=7.592,fP<0.01;t=3.214,gP<0.01;t=2.733,hP<0.05;t= 2.937,kP<0.05;IGF.1;MBP:髓鞘碱性蛋白;EPOR:促红细胞生成素受体;IGF.1:胰岛素样生长因子.1
组别例数M B P ( μ g / L ) E P O R ( n g / L ) I G F . 1 ( μ g / L )轻度窒息组中度窒息组重度窒息组1 7 1 5 8 6 . 0 9 ± 1 . 2 9ad8 . 1 8 ± 1 . 1 1g1 0 . 7 7 ± 2 . 7 8 2 6 8 . 0 6 ± 7 0 . 8 6be3 5 6 . 4 1 ± 5 6 . 5 7h4 5 6 . 3 3 ± 1 5 0 . 5 2 3 4 . 2 2 ± 5 . 8 2cf2 3 . 9 7 ± 6 . 1 2k1 7 . 3 1 ± 3 . 3 6
2.5 相关性分析
对血清MBP、EPOR、IGF.1水平进行相关性分析,IGF.1与MBP、EPOR呈明显的负相关(r=.0.694,P<0.01;r=.0.489,P<0.01),MBP与EPOR呈明显的正相关(r=0.687,P<0.01)。从三种因子的相关性关系可以看出随血清IGF.1降低,MBP及EPOR均升高,但二者升高的幅度不一致。
3 讨论
很多研究已经证明缺氧缺血引起的迟发性脑损伤以细胞凋亡为主,通常自缺氧缺血后6~12 h开始。在发生缺血缺氧的病理过程中,如果及时恢复血流可避免神经细胞死亡。但是在长时间的严重缺血缺氧后恢复血流反而加剧其损伤程度[4],可见及时发现窒息的存在并早期评估其窒息程度非常重要。围生期窒息引起的新生儿缺氧缺血性脑病(HIE)是儿科常见病多发病,也是儿童时期如脑瘫、智力障碍、癫痫等的常见原因之一,给社会和家庭带来沉重的负担,同时也降低了国民素质。HIE逐渐成为近年来国内外研究的热点,尤其在早期血清学的检测上。现在研究较多的是MBP、NSE等,可作为判断中枢神经系统破坏程度的指标,对判断病情严重程度和预后及指导治疗有重要意义。窒息新生儿产后12 h血清NSE升高,第1、3天仍维持较高水平,轻度HIE患儿7 d后恢复正常,而中重度HIE患儿7 d后仍保持较高水平[5]。本实验通过免疫酶联反应检测EPOR血清水平旨在寻找一种较NSE敏感或可弥补NSE的潜在缺陷的检测指标。Nagdyman等[6]研究发现,窒息后24 h内血清NSE水平不能预测窒息新生儿的长期预后且存在一定的假阳性率[3]。张志敏等[7]通过结扎足月妊娠待产母鼠双侧子宫动脉制作宫内窘迫大鼠模型,发现新生大鼠脑组织内EPOR蛋白及mRNA在生后2 h内即迅速增加,且3 d内持续增加,7 d仍维持较高水平。EPOR联合MBP、IGF.1的血清水平,可能对于辅助诊断新生儿脑损伤具有一定的临床意义。
EPOR在脑内不仅表达于神经细胞而且表达于非神经细胞,介导促红细胞生成素(EPO)的神经保护作用及抗凋亡作用。EPOR表达缺乏的鼠可以因选择性表达的EPOR而免受缺氧脑损伤,但是此种EPOR由造血组织控制表达而不是大脑的神经组织[8]。用NO培养神经细胞可诱导EPOR的表达,即使在没有外源性EPO存在的情况下,仍然可以发挥其神经保护作用,使得神经细胞免受缺氧损害[9]。本研究发现围生期发生窒息的患儿生后24 h内血清EPOR水平较正常足月儿升高,这与Spandou等[10]、Chen等[11]报道的发生缺血缺氧时EPOR蛋白表达增加相同。不少实验研究[12.15]均表明,重型颅脑损伤患者血清及脑脊液中EPOR的浓度较对照组明显升高,血清EPOR浓度在24 h升至高峰,7 d EPOR浓度下降不明显,仍维持在较高水平。这说明成人与新生儿一样颅脑损伤后EPOR的表达均增加,国外有研究证明神经祖细胞较发育成熟的神经细胞EPOR的表达水平明显升高[16],但不能排除其他组织损伤引起的EPOR升高。组织、脑脊液以及血清中EPOR的检测水平在发生缺血缺氧后可能存在一定程度的一致性尚需进一步研究。
IGF.1是一组具有生长激素样促生长作用、又具有胰岛素样调节代谢功能的蛋白。近年来发现IGF.1在中枢神经系统疾病中起重要作用[17],与新生儿窒息病理过程、HIE发病机制均密切相关。有研究发现胎鼠发育成成年鼠的各个阶段脑组织中都可检测到IGF.1且明显高于成年鼠[18]。本实验中,血清IGF.1在足月窒息组较足月新生儿组低,早产窒息组较早产新生儿组低,这与奚宝珊等[19]、Satar等[20]、Gazzolo等[21]报道相似。MBP是髓鞘蛋白的主要成分之一,在髓鞘的形成中起着重要作用,并维持中枢神经系统髓鞘结构和功能的稳定。生理状态下,脑组织MBP的含量很低,一般很难测出,当脑损伤病变累及髓鞘时,MBP可释放入脑脊液和血液中,导致其含量升高,故MBP含量变化能特异地反映髓鞘脱失程度进而反映神经组织病损程度,是中枢神经系统损害和急性脱髓鞘的有效生化指标[22]。本实验研究表明相同胎龄有窒息病史的患儿较同胎龄正常儿MBP、EPOR升高,IGF.1降低,且差异有高度统计学意义(P<0.01)。国外有研究发现EPO及其受体(EPOR)在胚胎和中枢神经系统有表达,但胎龄越小其在中枢神经系统内表达水平越低[23]。这与本文检测结果相同。早产儿脑损伤主要表现为脑白质损害。早产儿由于其特殊的解剖生理结构,其脑损伤临床表现与足月儿有很大差别,在病因、发病机制、神经生理学等方面也有很大不同。新生儿尤其是早产儿血脑屏障发育不完善,这些均可能成为早产儿MBP、EPOR高于足月儿,IGF.1较足月儿有所降低的原因[24.27]。也有研究表明低体重儿较正常出生体重儿IGF.1低或小于胎龄儿较适于胎龄儿IGF.1低[28]。本文的不足之处在于没有动态观测三个检测指标的血清水平,在不同时间点其三者之间是否具有一定的规律性可循,血清、脑脊液以及蛋白表达水平上三者是否也具有IGF.1与MBP、EPOR呈现负相关,MBP与EPOR呈现正相关的关系,尚需进一步研究。
围生期窒息为新生儿高伤残率和高病死率的重要原因之一,常引起严重脑组织损伤,从而导致新生儿HIE和(或)新生儿脑室内出血(IVH)的发生[2],但是并不是所有的早产儿IVH均是由窒息引起的。IVH是多因素的,无窒息组也可能发生IVH[2,29,30],由此看来仅仅依靠临床表现来评判有无脑损伤的Apgar评分也有其局限性。在国内,头颅B超、CT、MRI是目前诊断新生儿脑损伤的主要影像学技术。近年来,由于B超及CT的定位性差,诊断率低等原因,逐渐被MRI代替。日本京都医科大学H.Yoshioka教授研究发现HIE的大鼠在窒息发生24 h后,仅10%皮层神经元有缺血性损伤改变,2 h后70%以上的皮层神经元显示缺血性改变[31]。因此,MRI也就较血清检测因子在脑损伤的诊断时间上晚了一步。EpoR、IGF.1、MBP的联合检测对于脑损伤的辅助诊断可能具有一定的意义,协助早期发现脑损伤的存在,并及时采取针对性治疗措施,降低患儿病死率及远期致残率,对反映病情的变化趋势及判断脑损伤预后可能也具有一定的参考价值。
[1]Jiang ZD,Xiu X,Brosi DM,et al.Sub.optimal function of the auditory brainstem in term infants with transient low Apgar scores[J].Clinical Neurophysiology,2007,118(5):1088.1096.
[2]李坚,叶绍伟,程冰梅,等.Apgar评分与早产儿窒息相关因素的研究[J].中国优生与遗传杂志,2008,16(3):97. 98.
[3]王效德,郭素香.NSE,S100B蛋白在CNS损伤中的研究进展[J].中国现代医药杂志,2011,13(9):121.124.
[4]Thompson JW,Narayanan SV,Perez MA.Redox signaling pathways involved in neuronal ischemic preconditioning[J]. Current Neuropharmacology,2012,10(4):354.
[5]刘清银,涂斌,赵国华,等.血清神经元特异性烯醇化酶及S100B蛋白在新生儿窒息脑损伤诊断中的意义[J].实用医药杂志,2011,28(3):228.229.
[6]Nagdyman N,Grimmer I,Scholz T,et al.Predictive value of brain.specific proteins in serum for neurodevelopmental outcome after birth asphyxia[J].Pediatric research,2003,54(2):270.275.
[7]张志敏,田兆方,李玉红,等.宫内窘迫大鼠脑组织促红细胞生成素及其受体的表达[J].中国当代儿科杂志,2011,13(11):912.916.
[8]Xiong Y,Mahmood A,Qu C,et al.Erythropoietin improves histological and functional outcomes after traumatic brain injury in mice in the absence of the neural erythropoietin receptor[J].Journal of Neurotrauma,2010,27(1):205.215.
[9]Beleslin BB,Cokic VP,Yu X,et al.Erythropoietin and hypoxia stimulate erythropoietin receptor and nitric oxide production by endothelial cells[J].Blood,2004,104(7):2073. 2080.
[10]Spandou E,Papoutsopoulou S,Soubasi V,et al.Hypoxia. ischemia affects erythropoietin and erythropoietin receptor expression pattern in the neonatal rat brain[J].Brain research,2004,1021(2):167.172.
[11]Chen ZY,Wang L,Asavaritkrai P,et al.Up.regulation of erythropoietin receptor by nitric oxide mediates hypoxia preconditioning[J].Journal of Neuroscience Research,2010,88(14):3180.3188.
[12]熊思华,刘红梅,孙海晨.Epo/EpoR系统与创伤性颅脑损伤的研究进展[J].创伤外科杂志,2012,14(1):86.89.[13]廖正步,支兴刚,石全红,等.促红细胞生成素及其受体在脑外伤后的表达及意义[J].第三军医大学学报,2007,29(23):2243.2246.
[14]Teramo KA,Widness JA.Increased fetal plasma and amniotic fluid erythropoietin concentrations:markers of intrauterine hypoxia[J].Neonatology,2008,95(2):105. 116.
[15]肖以磊,李忠民,耿凤阳,等.NSE、EPO.R在重型颅脑损伤患者血清、脑脊液中浓度的变化及意义[J].中华神经外科疾病研究杂志,2012,11(2):168.169.
[16]Chen ZY,Asavaritikrai P,Prchal JT,et al.Endogenous erythropoietin signaling is required for normal neural progenitor cell proliferation[J].Journal of Biological Chemistry,2007,282(35):25875.25883.
[17]Bhat GK,Plant TM,Mann DR.Relationship between serum concentrations of leptin,soluble leptin receptor,testosterone and IGF.I,and growth during the first year of postnatal life in the male rhesus monkey,Macaca mulatta[J].European Journal of Endocrinology,2005,153 (1):153.158.
[18]Wang X,Deng J,Boyle DW,et al.Potential role of IGF.I in hypoxia tolerance using a rat hypoxic.ischemic model:activation of hypoxia.inducible factor 1&agr[J].Pediatric Research,2004,55(3):385.394.
[19]奚宝珊,翁立坚.HIE新生儿血浆INS、IGF.Ⅰ水平变化的意义[J].放射免疫学杂志,2008,21(2):125.127.
[20]Satar M,Zcan K,Yapicioglu H,et al.Serum insulin.like growth factor 1 and growth hormone levels of hypoxic. ischemic newborns[J].Neonatology,2004,85(1):15.20.
[21]Gazzolo D,Di Iorio R,Marinoni E,et al.S100B protein is increased in asphyxiated term infants developing intraventricular hemorrhage[J].Critical Care Medicine,2002,30(6):1356.1360.
[22]Nawaz S,Kippert A,Saab AS,et al.Phosphatidylinositol 4,5.bisphosphate.dependent interaction of myelin basic protein with the plasma membrane in oligodendroglial cells and its rapid perturbation by elevated calcium[J]. The Journal of Neuroscience,2009,29(15):4794.4807.
[23]Juul SE,Anderson DK,Li Y,et al.Erythropoietin and erythropoietin receptor in the developing human central nervous system[J].Pediatric Research,1998,43(1):40.49.[24]姚裕家.早产儿脑损伤的病因及病理生理机制研究进展[J].临床儿科杂志,2006,24(3):166.167.
[25]王迎红,朱长连,程秀永,等.重组人促红细胞生成素对早产儿神经行为发育的影响[J].中国实用儿科杂志,2006,21(1):59.
[26]Liu W,Shen Y,Plane JM,et al.Neuroprotective potential of erythropoietin and its derivative carbamylated erythropoietin in periventricular leukomalacia[J].Experimental Neurology,2011,230(2):227.239.
[27]Brines M,Cerami A.Discovering erythropoietin's extra. hematopoietic functions:biology and clinical promise[J]. Kidney International,2006,70(2):246.250.
[28]杨树杰,易海英,甘斌,等.早产儿胰岛素样生长因子.1和胰岛素样生长因子结合蛋白.3早期检测的临床意义[J].数理医药学杂志,2011,24(3):313.315.
[29]金汉珍,黄德珉,官希吉.实用新生儿学[M].3版.北京:人民卫生出版社,2003:400.401,772.778.
[30]黄润忠,黄建伟,彭流泉.早产儿脑损伤的相关因素分析[J].中国小儿急救医学,2008,15(5):423.425.
[31]朱国旺.新生儿脑损伤研究逐渐得到重视[N].中国医药报,2002.10.19(A28).
The expression of serum myelin basic protein,erythropoietin receptor,insulin-like growth factor-1 and its clinical significance after neonatal asphyxia
ZHANG XiaoLAN HaixiaInner Mongolia Medical University,Inner Mongolia Autonomous Region,Hohhot010051,China
Objective To investigate the relation among the serum myelin basic protein(MBP)and erythropoietin receptor(EPOR)and insulin.like growth factor 1(IGF.1)with asphyxial neonates.Methods Venous blood was collected in 74 neonates(hypoxia group)and 37 neonates(control group)within 24 h.The centrifugal supernatant was taken.ELISA method was used to assayed the serum levels of EPOR,MBP,IGF.1.Results Full.term asphyxia group serum MBP[(5.81±1.83)μg/L]and EPOR[(404.98±152.75)ng/L]significantly increased,which compared with full.term newborn group serum MBP[(2.57±0.77)μg/L]and EPOR[(269.58±51.36)ng/L](t=6.974,P<0.01;t=3.541,P<0.01); serum IGF.1[(36.29±11.43)μg/L]was less than that[(62.25±11.97)μg/L]in full.term newborn group(t=7.529,P<0.01).Preterm birth asphyxia group serum MBP[(7.81±2.38)μg/L]and EPOR[(338.85±104.64)ng/L]were significantly higher than serum MBP[(3.41±1.32)μg/L]and EPOR[(216.14±45.70)ng/L]in preterm group(t=7.676,P<0.01;t =4.995,P<0.01);serum IGF.1[(26.99±8.65)μg/L]was significantly lower than serum IGF.1[(52.56±15.36)μg/L]in preterm children(t=8.262,P<0.01).There were significant negative correlations between IGF.1 and MBP,EPOR(r=.0.694,P<0.01;r=.0.489,P<0.01),there was a significant positive correlation between MBP and EPOR(r= 0.687,P<0.01).Conclusion These results suggest that there is a rapid response of EPOR,MBP,IGF.1 to the hypoxic.ischemic stimulus.It can be meaningful for assess the degree of hypoxia and diagnosis of cerebral injury.
Myelin basic protein;Erythropoietin receptor;Insulin.like growth factor 1;Brain injury;Neonates;Asphyxia
R722.12
A
1673-7210(2014)02(a)-0029-05
2013.11.01本文编辑:张瑜杰)
内蒙古自治区科技计划项目(编号20120406)。[作者简介]张肖(1987.2.),女,内蒙古医科大学2011级儿科学专业在读硕士研究生;研究方向:新生儿疾病。
兰海霞(1969.2.),女,硕士生导师,主要从事儿科呼吸道疾病及新生儿疾病的临床与研究。

