不同剂量右美托咪定用于神经外科手术的麻醉效果
李 姗 董铁立
郑州大学第二附属医院麻醉科 郑州 450014
异丙酚复合瑞芬太尼是神经外科手术常用的全凭静脉麻醉方法,但因大多数神经外科手术刺激强烈,操作精细时间较长,对围术期颅内稳态、血流动力学稳定及镇静要求较高,随着手术时间延长、药物积累量增加,导致患者苏醒时间延长,诱发麻醉苏醒期躁动等不良反应,从而增加了颅内再次出血的风险。右美托咪定(dexmedetomidine,Dex)是一种高效、高选择性α2肾上腺素能受体激动剂,具有镇静、镇痛和抗焦虑作用,可明显减少阿片类药物、异丙酚及吸入性麻醉药的用量,广泛应用于临床镇静和辅助临床麻醉中[1]。本研究拟以CSI为麻醉深度指标,评价不同剂量右美托咪定复合异丙酚和瑞芬太尼用于神经外科手术的麻醉效果,探讨其适宜用药方案。
1 资料与方法
1.1 一般资料 经过本院医学伦理委员会批准,并与患者或家属签署知情同意书,选择我院择期施行脑膜瘤切除术的患者60例,年龄18~55岁,体质量50~75kg,ASA分级Ⅰ级或Ⅱ级。无严重心、肺、肝、肾和代谢性疾病史;无药物过敏;无心动过缓和缓慢性心律失常;无长期使用镇静镇痛药和术前有精神疾病史;预计手术时间4~6h,采用随机数字表法,将患者均分成3组:对照组(C组)、右美托咪啶0.2μg ·kg-1·h-1(D1组)和右美托咪啶0.5μg·kg-1·h-1组(D2组),每组20例。见表1。
1.2 麻醉方法 所有患者术前均无术前用药常规禁饮禁食。入室后连接多功能监护仪连续监测HR、ECG、SpO2,开放静脉通路,静滴钠钾钙镁葡萄糖溶液6~8mL·kg-1·h-1。局麻下行左桡动脉穿刺置管监测MAP,右颈内静脉穿刺置管备用。连接多功能麻醉深度监护仪(合肥诺和有限责任公司)监测CSI。D1组和D2组分别于麻醉诱导前经15min静脉输注右美托咪定(批号:13053134,江苏恒瑞医药股份有限公司)负荷剂量0.6μg/kg,随后分别以0.2、0.5μg·kg-1· h-1速率静脉输注至手术结束前40min,C组给予等容量的生理盐水。麻醉诱导:静注阿托品0.5mg、咪达唑仑0.05mg/kg、顺苯磺酸阿曲库铵0.15mg/kg、舒芬太尼0.4mg/kg、异丙酚1.5mg/kg,CSI≤60并维持5s行气管插管,连接麻醉机机械通气,潮气量8~10mL/kg,通气频率10~15次/min,吸入纯氧,氧流量1L/min,吸呼比1:2,维持呼气末二氧化碳分压(PETCO2)35~45mmHg。麻醉维持:双通道微量注射泵静脉泵注异丙酚4~12mg·kg-1·h-1、瑞芬太尼7~12μg·kg-1·h-1、定时间断追加顺苯磺酸阿曲库铵2.5~5mg根据手术情况,术毕前5~10min停用异丙酚,术毕时停用瑞芬太尼。术中CSI维持在40~60保证麻醉深度根据CSI值及血流动力学调整异丙酚和瑞芬太尼的用量,根据失液量或出血量补充相应的晶体、胶体或者血制品。若出现高血压(SBP≥140mmHg)或低血压(SBP<90mmHg)则静注尼卡地平10~30μg·kg-1或甲氧明5~10mg,必要时重复;若出现心动过速(HR>100次/min)或心动过缓(HR<50次/min),则静注艾司洛尔10mg或阿托品0.3mg,必要时重复。术后患者定向力恢复、自主呼吸恢复(潮气量6mL/kg、呼吸频率>10次/min)后拔除气管导管,送麻醉恢复室(PACU)面罩吸氧并进行常规监测。
表1 3组患者一般资料的比较 (±s,n=20)
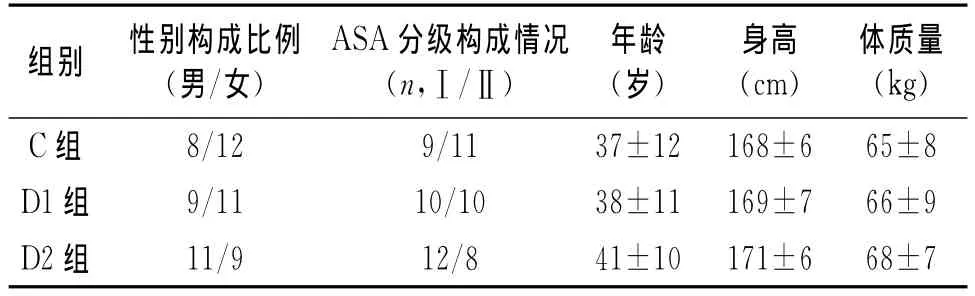
表1 3组患者一般资料的比较 (±s,n=20)
注:组间比较P>0.05,差异无统计学意义
组别 性别构成比例(男/女)ASA分级构成情况(n,Ⅰ/Ⅱ)年龄(岁)身高(cm)体质量(kg)C组 8/12 9/8 41±10 171±6 68±7 11 37±12 168±6 65±8 D1组 9/11 10/10 38±11 169±7 66±9 D2组 11/9 12/
1.3 观察指标 记录患者静脉输注右美托咪定前(T0)、气管插管时(T1)、切头皮时(T2)、钻颅骨时(T3)、缝皮时(T4)、气管拔管时(T5)、气管拔管后10min(T6)的MAP、HR和CSI数值。记录自主呼吸、定向力恢复和拔除气管导管的时间。拔除气管导管后10min时行镇静一躁动评分(RASS评分),评分标准:不可唤醒-5分,深度镇静-4分,中度镇静-3分,轻度镇静-2分,嗜睡-1分,警觉和安静为0分,焦躁不安为1分,躁动为2分,异常烦躁为3分,有攻击性为4分[2]。记录术中及麻醉苏醒期不良反应的发生情况。
1.4 统计分析 采用SPSS 17.0统计软件分析数据,计量资料以均数±标准差(x¯±s)表示,采用重复测量设计的方差分析,两两比较采用LSD检验;计数资料采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 3组患者不同时间点MAP、HR和CSI比较 与T0比较,C组T1时MAP和HR明显升高(P<0.05);与T0比较,D1组T1时MAP降低,D2组T1-6时MAP均降低,D1组T1-3HR降低,D2组T1-6HR降低(P<0.05);与T4比较,C和D1组T5时MAP和HR升高(P<0.05);与C组比较,D1组T1,5,6时MAP降低,D2组T1-6时MAP降低(P<0.05);D1组和D2组T1-6时HR均降低(P<0.05);与D1组比较,D2组T2-6时MAP和HR均降低(P<0.05);与C组比较,D1组T1时CSI降低,D2组T1-4时CSI降低(P<0.05)。3组间T0时MAP、HR、CSI,T5,6时CSI差异无统计学意义(P>0.05)。见表2。
表2 3组患者不同时间点MAP、HR和CSI的比较 (±s,n=20)

表2 3组患者不同时间点MAP、HR和CSI的比较 (±s,n=20)
注:与T0比较aP<0.05;与T4比较,b P<0.05;与C组比较,c P<0.05;与D1组比较,d P<0.05
指标 组别 T0 T1 T2 T3 T4 T5 T6 135±9(mmHg) D1组 124±5 110±8ac 121±9 115±7 120±8 131±6bc 123±5c D2组 121±3 108±6ac 103±7acd 99±6acd 105±4acd 111±3acd 109±5acd C组 80±6 95±4a 87±6 85±5 90±5 100±6b 97±4 HR D1组 84±5 74±3ac 81±2ac 77±5ac 80±3c 89±5bc 85±6c(bpm)CSI值 D2组 85±4 75±4ac 70±5acd 67±4acd 69±3acd 75±4acd 74±5acd C组 99±1 56±4 48±5 47±4 57±4 91±1 95±2 D1组 98±2 45±5c 46±5 45±4 56±3 91±1 95±3 D2组 98±1 44±4c 42±4c 43±3c 45±3c MAP C组 122±4 137±11a 126±10 120±8 129±9 142±7b 87±1 93±2
2.2 3组手术和麻醉时间、术中异丙酚和瑞芬太尼用量比较
3组的手术和麻醉时间比较差异无统计学意义(P>0.05);与C组比较,D2组的异丙酚及瑞芬太尼用量降低(P<0.05);D1组差异无统计学意义(P>0.05)。见表3。
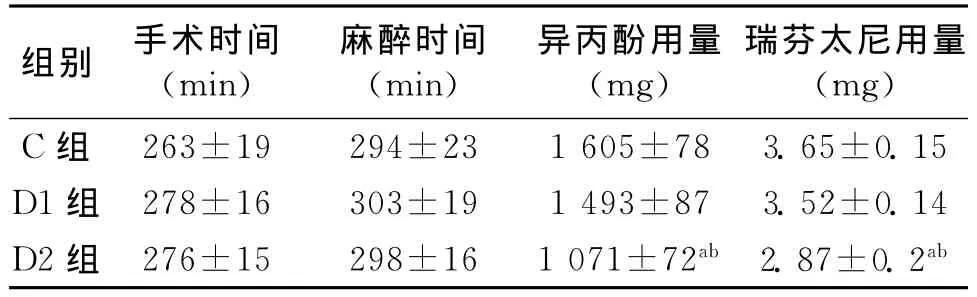
表3 3组患者手术和麻醉时间、术中异丙酚和瑞芬太尼用量的比较
2.3 3组麻醉恢复各指标比较 与C组比较,D1组和D2组拔出气管导管后10min时,RASS评分降低(P<0.05);与D1组比较,D2组拔出气管导管后10min时,RASS评分降低(P<0.05);3组间自主呼吸恢复时间、定向力恢复时间、拔除气管导管时间比较差异无统计学意义(P>0.05)。见表4。
表4 3组患者麻醉恢复各指标的比较 (±s,n=20)

表4 3组患者麻醉恢复各指标的比较 (±s,n=20)
注:与C组比较,aP<0.05;与D1组比较,b P<0.05
9±3 10±1 11±4 1.6±1.1 D1组 10±2 11±1 12±1 0.9±1.2a D2组 11±1 12±2 12±3 0.2±0.8 C组ab
2.4 3组术中及麻醉苏醒期出现不良情况比较 与C组比较,D1组和D2组恶心呕吐、呛咳、躁动的发生率降低(P<0.05);与D1组比较,D2组恶心呕吐、呛咳、躁动的发生率降低(P<0.05);D2组术中心动过缓发生率高于C组和D1组(P<0.05)。见表5。
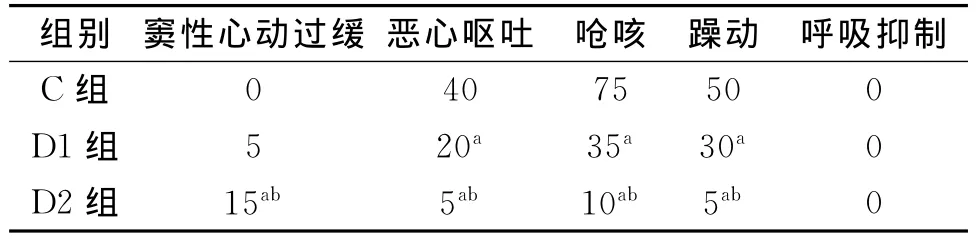
表5 3组术中及麻醉苏醒期出现不良事件情况比较 (%,n=20)
3 讨论
麻醉深度指数(cerebral state index,CSI),有利于指导全身麻醉维持适当的麻醉深度,避免麻醉过深或过浅,指导合理用药,可大幅度降低术中知晓的发生率[3]。
右美托咪定作为一种新型的麻醉辅助用药在临床上已得到了广泛应用,是一种高选择性的α2肾上腺素受体激动剂,起效快,作用时间短,在肝脏进行生物转化,95%的代谢物经肾脏排泄,其分布半衰期短,大约6min,消除时间为2 h。右美托咪定对α2受体的亲和力是可乐定的8倍,其主要是通过作用于α2肾上腺素受体发挥作用,α2受体在生物体内分布广泛,在脑内主要集中在脑桥和脊髓,并且广泛参与到中枢神经系统各条通路信息的传输与活化[4]。α2肾上腺素受体有3种亚型分别是α2A、α2B、α2C,其中α2A受体是大脑内主要的亚型,激活后可参与抗伤害性刺激、镇静、抗交感和行为反应等多种生理功能,右美托咪定通过蓝斑核的α2A受体介导镇静作用,其机制是通过G蛋白耦联引起钾电导的增加,从而使细胞膜产生超极化,并可减少去甲肾上腺素的释放;此外,右美托咪定还可通过相同机制作用于脊髓背角突触后α2肾上腺素受体而抑制疼痛信号的传递。体内及体外实验均证实右美托咪定可通过作用于α2A受体介导神经保护作用[5]。因此,作为术中用药右美托咪定具有降低交感神经张力,抑制去甲肾上腺素释放等优点,可减少手术期间多种刺激引起的高血压反应,减少脑血流量,防止术中发生脑组织肿胀,且不影响脑氧供平衡为手术提供良好的条件。
气管插管和拔除气管导管的过程可对机体产生强烈伤害性刺激,引起血流动力学波动和气道高反应的发生,患者往往表现出血压升高、心率加快和气道痉挛等。研究表明,右美托咪定除具有镇静镇痛作用外,还具有许多独特的药效学特性,包括减少儿茶酚胺的分泌、不引起呼吸抑制、降低气道反应性等[6-7]。本研究参照KaWaai H[8]选择输注右美托咪定的速率分别为0.2μg·kg-1·h-1和0.5μg·kg-1·h-1,结果表明,围麻醉期与C组和D1组比较,D2组MAP和HR均降低且在正常范围之内,血流动力学波动不大,提示静注0.5μg·kg-1·h-1能有效的维持血流动力学平稳,抑制气管插管和拔除气管插管时应激反应。
本研究中,与C组比较,D2组异丙酚和瑞芬太尼用量减少,而D1组无差异,提示静脉输注右美托咪啶0.5μg·kg-1·h-1,可减少术中异丙酚和瑞芬太尼用量。这与右美托咪定的镇痛、交感神经阻滞效应有关,与Tanskanen等[9]研究结果一致。本研究中,与C组和D1组比较,D2组恶心呕吐、呛咳、躁动的发生率降低,提示静脉输注右美托咪啶0.5μg· kg-1·h-1,能有效的降低麻醉苏醒期不良反应的发生[6]。但D2组术中心动过缓发生率高于D1组和C组,因此不建议采用较高剂量右美托咪定用于合并心律失常、心脏疾病及老年体弱的患者。
本研究中,与C组和D1组比较,D2组拔除气管导管后10minRASS评分降低,3组自主呼吸、定向力恢复时间,拔除气管导管时间无差异,提示静脉输注右美托咪啶0.5μg· kg-1·h-1能更好地抑制麻醉苏醒期躁动且不影响气管导管拔除时间,适用于麻醉恢复质量要求较高的全麻患者,Haselman[10]的研究观点支持本研究。综上所述,本研究证明,对于无禁忌证的神经外科患者,围术期复合异丙酚和瑞芬太尼时静脉输注右美托咪啶0.5μg·kg-1·h-1用于手术麻醉的效果较好。
[1] Aantaa R,Jaakola MI,Kallio A,et al.Reduction of the minimum alveolar concentration of isolfurane by dexmedetomidine[J].Anesthesiology,1997,86(5):1 055-1 060.
[2] Sessler CN,Gosnell MS,Grap MJ,et al.The Richmond Agitation Sedation Scale:validity And reliability in adult intensive care unit patients[J].Am J Respir Crit Care Med,2002,166(10):1 338-1 344.
[3] 冯微,赵国庆,叶虹,等 .麻醉深度指数用于全麻手术期间麻醉深度监测的临床评价[J].临床麻醉学杂志,2009,25(6):493-496.
[4] Bekker A,Jorden VSB.Alpha-2agonists in neuroanesthesia[J].Seminars in Anesthesia,Perioperative Medicine and Pain,2004,23(3):181-191.
[5] Ma D,Hossain M,Rajakumaraswamy N,et al.Dexmedetomidine produces its neuropmtective effect via the 2A-adrenoceptor subtype[J].European Journal of Pharmacology,2004,502(1-2):87-97.
[6] Ebert TJ,Hall JE,Barney JA,et al.The effects of increasing plasma concentrations of dexmedetomidine in humans[J].Anesthesiology,2000,93(2):382-394.
[7] Groeben H,Mitzner W,Bmwn RH.Effects of the alpha2-adrenoceptor agonist dexmedetomidine on bronchoconstriction in dogs[J].Anesthesiology,2004,100(2):359-363.
[8] Kawaai H,Satoh J,Watanabe M,et al.A comparison of intravenous sedation with two doses of dexmedetomidine:0.2/μg/ kg/hr versus 0.4μg/kg/hr[J].Anesth Prog,2010,57(3):96-103.
[9] Tanskanen PE,Kytta JV,Randell TT,et al.Dexmedetomidine as an anaesthetic adjuvant in patients undergoing intracranial tumour surgery:a double-blind,randomized and placebo-con-trolled study[J].Br J Anaesth,2006,97(5):658-665.
[10] Haselman MA.Dexmedetomidine:a useful adjunct to consider in some high-risk situations[J].AANA J,2008,76(5):335-339.

