芹菜韧皮部蛋白质AgPP2-2基因的克隆与表达
贾晓玲,王 枫,马 静, 刘 君,徐馨琰,熊爱生
(南京农业大学园艺学院,作物遗传与种质创新国家重点实验室,农业部华东地区园艺作物生物学与种质创制重点实验室,江苏南京210095)
植物生长和发育过程中,韧皮部主要负责植物体内水分、无机盐和光合产物的运输,并兼有维持植物形态、抵御外界物理伤害的作用[1-3]。韧皮部蛋白质PP2(Phloem protein 2)是植物韧皮部汁液中富含的一种蛋白质,是一种特殊的结合几丁质的凝集素,具有韧皮部组织特异性[4]。同时,韧皮部蛋白质在植物大分子运输系统中起很重要的标记作用[5]。国内外学者对韧皮部蛋白质的研究比较早。1995年,Toyama等从甜瓜、黄瓜等幼苗中克隆出编码PP2亚基的 cDNA[6]。1992 年,Bostwick等对笋瓜PP2分别进行原位杂交与免疫细胞化学反应定位,发现PP2的mRNA特异性地定位于韧皮部伴胞中,PP2蛋白质分布于伴胞和筛管分子中[7]。分析南瓜属的几个不同品种,发现PP2由一个小的基因家族构成,高度保守[8]。利用韧皮部特异表达启动子调节目的基因在韧皮部高效的表达,可更经济、有效地发挥某些目的基因的作用[9-11]。
芹菜(Apium graveolens L.)属伞形科草本植物,原产于地中海沿岸地区,汉代传入中国,距今已有2000多年的栽培历史,是中国非常重要的蔬菜作物之一[12]。芹菜富含蛋白质、矿物质、维生素等多种营养成分,茎叶等营养组织中还含有挥发油、芹菜苷、佛手苷内酯等药用成分,具有降血压、调血脂、抗氧化、抗肿瘤、抗菌等药理功效,越来越受人们的亲睐[13-14]。六合黄心芹是南京市六合区的地方优良品种,株高较矮,株型半直立,产量高,品质佳,抗逆性强,适应性广,可四季栽培[15]。津南实芹是天津市津南区选育的优良地方品种,植株高大,株型紧凑直立,基本无分枝,抗性强,适应性广,中国南北四季均可栽培。美国西芹从美国引进,经多代提纯选育而成,株高高大,株型紧凑,抗病性好,产量高,适合保护地及春秋露地栽培。芹菜中的AgPP2-2基因主要编码芹菜中的韧皮部蛋白质,该蛋白质在维持芹菜的形态特征、物质转运等方面有重要作用。目前相对于其他模式植物和大宗蔬菜,伞形科的芹菜AgPP2-2基因的研究很少。
本试验分别从六合黄心芹、津南实芹和美国西芹中克隆韧皮部蛋白质AgPP2-2基因,对其进行较为详细的序列分析,利用实时定量PCR进行不同组织及不同逆境处理下的表达研究,为进一步深入研究芹菜中韧皮部蛋白质的功能和机制奠定基础。
1 材料与方法
1.1 菌种、质粒与试验材料
大肠杆菌菌种DH5α由本实验室保存;质粒载体pMD18-T vector、DNA分子量标准品、Ex Taq PCR聚合酶和各类限制性内切酶等均为大连TaKaRa公司产品。
试验材料六合黄心芹、津南实芹和美国西芹均由本实验室保存。2012年秋季将3种芹菜分别种植于南京农业大学园艺学院江浦实验园艺场,冬季将其移至南京农业大学园艺学院实验大棚,使其安全过冬春化,并生长发育为具有根、茎、叶、花的完整植株。2013年3月,在南京农业大学作物遗传与种质创新国家重点实验室人工气候室分别播种3种芹菜,待植株长成2月龄大小时,分别对其进行20%PEG(Polyethylene glycol,聚乙二醇)处理、200 mmol/L NaCl处理、4℃低温处理、38℃高温处理,处理时间均为2 h。
1.2 基因组DNA和总RNA的提取及cDNA的合成
采集成熟芹菜植株的根、茎、叶、花以及不同处理的2月龄芹菜植株幼嫩叶片,用于基因组DNA和总RNA的提取及cDNA的合成。基因组DNA的提取按照DNA试剂盒(DNA simple Total DNA Kit,北京Tiangen公司)说明书进行;总RNA的提取按照RNA试剂盒(RNA simple Total RNA Kit,北京Tiangen公司)说明书进行;用Prime Script RT reagent Kit(大连 T aKaRa公司)将提取的总 R NA反转录成cDNA。
1.3 芹菜韧皮部蛋白质AgPP2-2基因的克隆
以GenBank中来源于旱芹(A.graveolens var.dulce)的韧皮部蛋白质(AY114140)的cDNA序列作为芹菜韧皮部蛋白质AgPP2-2基因克隆引物的参考序列,设计1对引物:NRX19(5'-ATGGCTCAAGTGCAGCGAGATG-3')和NRX20(5'-TTAGCAGATAACTGGCACAATG-3')。分别以六合黄心芹、津南实芹和美国西芹的 DNA和cDNA为模板进行扩增,PCR为50μl反应体系:Premix Ex Taq 25 μl,模板 DNA 2 μl,引 物 NRX19(20 μmol/L)1 μl,引物 NRX20(20 μmol/L)1 μl,灭菌蒸馏水21μl;PCR反应条件为:94℃预变性4 min;94℃变性30 s,54℃退火30 s,72℃延伸60 s,共进行35个循环;72℃延伸10 min。PCR产物经1.2%琼脂糖凝胶电泳回收后,连接到pMD18-T载体上并转化至大肠杆菌DH5α,提取质粒,菌液经PCR鉴定后委托南京金斯瑞生物科技有限公司测序。
1.4 序列分析
各类植物的韧皮部蛋白质或相似蛋白质序列均来自NCBI数据库,使用BLAST进行序列比对。采用DNAMAN软件对序列进行多重比较,用MEGA 5.0构建分子系统进化树[16]。氨基酸组成成分及理化性质分析用网站(http://web.expasy.org)相关软件完成[17]。蛋白质亲水性/疏水性及二级结构分析采用DNAMAN软件。
1.5 实时定量PCR反应
荧光定量PCR采用ABI 7300 Real-time PCR System 和7300 System software,使用Real-Time PCR Kit(SYBR Green)试剂盒(Shanghai Novland Co.,Ltd),按照操作说明进行。芹菜actin基因为参考基因,与目标基因一起扩增,表达检测引物为ACTIN-F(5'-CTTCCTGCCATATATGATTG-3')和 ACTIN-R(5'-GCCAGCACCTCGATCTTCATG-3')。根据六合黄心芹、津南实芹和美国西芹中分离的芹菜韧皮部蛋白质 AgPP2-2基因序列,设计表达检测引物NRX19BDF(5'-TCGTCCCAACGGAAGCACTGAA-3')和NRX19BDR(5'-ACCAACCTTAAGTCCCACCCAT-3')。以芹菜中actin基因的转录表达水平为内参,目的基因相对转录表达水平的计算公式为2-CtΔ,CtΔ=Ct(目标基因) - Ct(actin)[18-19]。
2 结果与分析
2.1 芹菜韧皮部蛋白质AgPP2-2基因的克隆
以六合黄心芹、津南实芹和美国西芹的DNA为模板,用引物NXR19和NXR20,经PCR扩增后分别得到约800 bp的扩增产物。以上述3个芹菜品种cDNA为模板,用引物NXR19和NXR20,经PCR扩增后分别得到约600 bp的扩增产物(图1)。序列测定与分析结果表明,来源于3个芹菜品种的韧皮部蛋白质AgPP2-2基因均含有1个540 bp的开放阅读框,编码179个氨基酸。来源于3个芹菜品种的AgPP2-2基因在核苷酸水平上有4个碱基的差异,分别为117位G/A/G(六合黄心芹/津南实芹/美国西芹)、206位C/C/T、468位 G/G/A和588位G/T/G;编码的氨基酸有3个位点的差异,分别为39位Gly/Arg/Gly、56位Gly/Gly/Arg和62位Trp/Cys/Trp(图2)。来源于六合黄心芹、津南实芹和美国西芹的韧皮部蛋白质AgPP2-2基因均含有196 bp和167 bp的内含子(图3)。
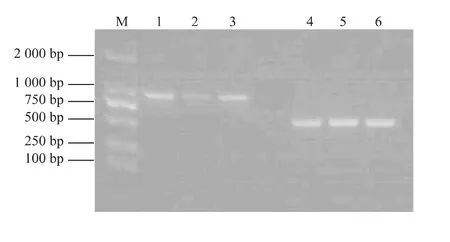
图1 芹菜AgPP2-2基因PCR扩增Fig.1 PCR amplification of AgPP2-2 from celery
2.2 芹菜韧皮部蛋白质AgPP2-2的氨基酸序列分析

图2 三种芹菜韧皮部蛋白质基因AgPP2-2核苷酸序列及其编码的氨基酸序列比对Fig.2 Alignment of gene sequences and amino acid sequences of phloem protein gene AgPP2-2 from three celery cultivars

图3 六合黄心芹AgPP2-2基因的核苷酸序列及其编码的氨基酸序列Fig.3 Nucleotide acid and deduced amino acid sequence of phloem protein gene AgPP2-2 from celery Liuhehuangxinqin
对六合黄心芹、津南实芹和美国西芹韧皮部蛋白质AgPP2-2的氨基酸序列进行BLAST同源性检索与比对,结果显示AgPP2-2蛋白质与毛果杨(Populus trichocarpa)、粟(Setaria italica)、桃(Prunus persica)、拟南芥(Arabidopsis thaliana)、忽地笑(Lycoris aurea)、葡萄(Vitis vinifera)、二穗短柄草(Brachypo-dium distachyon)、南瓜(Cucurbita argyrosperma)、笋瓜(Cucurbita maxima)、番茄(Solanum lycopersicum)、野草莓(Fragaria vesca)、乌拉尔图小麦(Triticum urartu)、玉米(Zea mays)、大豆(Glycine max)和水稻(Oryza sativa)的韧皮部蛋白质相似度较高。其中与毛果杨的韧皮部蛋白质相似性达到44%。六合黄心芹、津南实芹和美国西芹的韧皮部蛋白质AgPP2-2都具有PP2超家族保守结构域(图4)。将六合黄心芹、津南实芹和美国西芹的韧皮部蛋白质AgPP2-2与上述植物中的韧皮部蛋白质或相似蛋白质氨基酸序列进行多重比对,结果显示上述植物中的韧皮部蛋白质在保守区域有6个亮氨酸残基和5个色氨酸残基,另外,还有2个缬氨酸、2个甘氨酸、2个脯氨酸、1个酪氨酸和1个赖氨酸残基完全保守(图4)。

图4 芹菜韧皮部蛋白质AgPP2-2的保守域预测及其与其他物种类似蛋白质氨基酸序列的多重比对Fig.4 Prediction of the conserved domain and alignment of amino acid sequences of phloem protein AgPP2-2 from celery and other different plants
2.3 芹菜韧皮部蛋白质AgPP2-2的进化分析
为了进一步分析从六合黄心芹、津南实芹和美国西芹中分离的韧皮部蛋白质AgPP2-2与其他物种中韧皮部蛋白质或相似蛋白质的进化关系,根据检索结果,选取上述15种植物的韧皮部蛋白质或相似蛋白质与六合黄心芹、津南实芹和美国西芹的韧皮部蛋白质进行同源进化比对,构建同源进化树。结果(图5)显示,在进化关系上,六合黄心芹、津南实芹和美国西芹的韧皮部蛋白质Ag-PP2-2与石蒜科的忽地笑和葫芦科南瓜属的南瓜和笋瓜的韧皮部蛋白质在同一个大的进化分支上,并且与忽地笑的进化关系最近。禾本科的二穗短柄草、乌拉尔图小麦、粳稻、玉米和粟同属于一个进化分支,但在进化关系上与3种芹菜较远。中国本地芹菜品种六合黄心芹、津南实芹的Ag-PP2-2进化上归为一组,与美国来源的美国西芹在进化上有一定的距离。
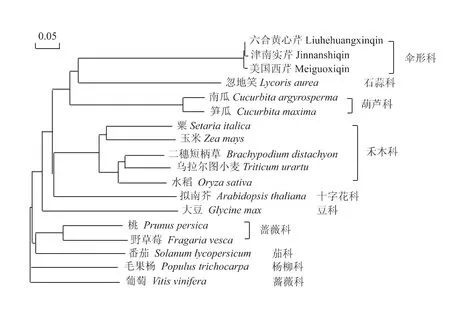
图5 芹菜韧皮部蛋白质AgPP2-2和部分物种的韧皮部蛋白质以及相似蛋白质氨基酸序列的系统进化树Fig.5 Phylogenetic tree of the AgPP2-2 and the similar proteins from celery and higher plants based on amino acid sequences
2.4 芹菜韧皮部蛋白质AgPP2-2的理化性质分析
对芹菜韧皮部蛋白质AgPP2-2和上述植物中的韧皮部蛋白质进行氨基酸组成及理化性质分析,结果(表1)显示,六合黄心芹、津南实芹和美国西芹的韧皮部蛋白质AgPP2-2氨基酸组成及理化性质差异较小,而它们与其他物种的韧皮部蛋白质及类似蛋白质的氨基酸组成及理化性质有较大差异。这些植物中的韧皮部蛋白质氨基酸残基数较多,且变化幅度较大。其中,大豆中韧皮部蛋白质氨基酸残基数最多,为412个;忽地笑韧皮部蛋白质氨基酸残基数最少,为171个。理论分子量差异也比较大(2.0×104~4.7×104),大豆韧皮部蛋白质理论分子量最高(47 105.7),六合黄心芹韧皮部蛋白质 AgPP2-2理论分子量最低(19 737.5)。酸性氨基酸比例要略高于碱性氨基酸比例,不溶蛋白质比例为62.9% ~89.7%;理论等电点变化也较大,既有碱性蛋白质又有酸性蛋白质;总平均疏水指数为-0.192~ -0.640,其中桃的疏水性最强,笋瓜的疏水性最弱。
对本试验克隆的六合黄心芹、津南实芹和美国西芹的韧皮部蛋白质AgPP2-2的氨基酸序列进行亲水性/疏水性分析。结果(图6)表明:在3种芹菜中,该蛋白质的第120赖氨酸和121位谷氨酸亲水性最强,其次亲水性强的位点分别出现在第29位亮氨酸和第129位天冬酰胺;第92位缬氨酸疏水性最强,其次疏水性强的位点分别出现在第11位亮氨酸和第176位缬氨酸。总体而言,3种芹菜韧皮部蛋白质AgPP2-2基因的大部分氨基酸都是疏水性氨基酸,都属于疏水性蛋白质。
2.5 芹菜韧皮部蛋白质AgPP2-2的二级结构预测与分析
用DNAMAN软件对3种芹菜的韧皮部蛋白质AgPP2-2的二级结构进行预测与分析,结果表明,六合黄心芹韧皮部蛋白质由54.2%的卷曲结构、36.3%的折叠结构和9.5%的螺旋结构组成(图7),津南实芹韧皮部蛋白质由55.6%的卷曲结构、32.0%的折叠结构和12.4%的螺旋结构组成,美国西芹韧皮部蛋白质由54.8%的卷曲结构、35.8%的折叠结构和9.4%的螺旋结构组成。总体而言,3种芹菜韧皮部蛋白质的二级结构非常相似,其中卷曲和折叠结构都是主要组成部分。
2.6 芹菜韧皮部蛋白质基因AgPP2-2不同组织和不同逆境处理的表达分析
通过荧光定量PCR检测六合黄心芹、津南实芹和美国西芹的韧皮部蛋白质基因AgPP2-2在3种芹菜不同组织中的表达情况(图8)。AgPP2-2基因在3种芹菜的根、茎、叶和花中均有表达,呈现较明显的组织特异性。其中,AgPP2-2基因在津南实芹和美国西芹的茎中相对表达量最高,在根和叶中相对表达量较低,在花中相对表达量最低;而在六合黄心芹中,根、茎和花中表达差异较小,在叶中的表达最低。AgPP2-2基因的表达与韧皮部组织分布呈现一定的相关性,茎中韧皮部的分布相对较多,因此茎中韧皮部蛋白质AgPP2-2基因的相对表达量较高。在茎中,津南实芹和美国西芹的相对表达量较高,其中津南实芹的相对表达量最高,这可能与津南实芹和美国西芹的植株高大,而六合黄心芹的植株相对较矮有关;在根和叶中,美国西芹的相对表达量最高,六合黄心芹和津南实芹的相对表达量较低;在花中,六合黄心芹的相对表达量相对较高,津南实芹和美国西芹的相对表达量很低。
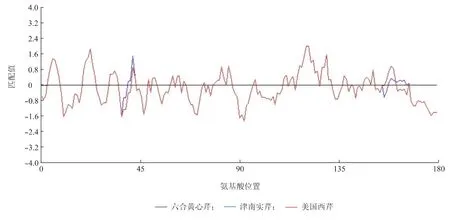
图6 芹菜韧皮部蛋白质AgPP2-2氨基酸序列亲水性和疏水性比较Fig.6 Predicted hydrophilicity and hydrophobicity of amino acid sequence of phloem protein AgPP2-2 from celery
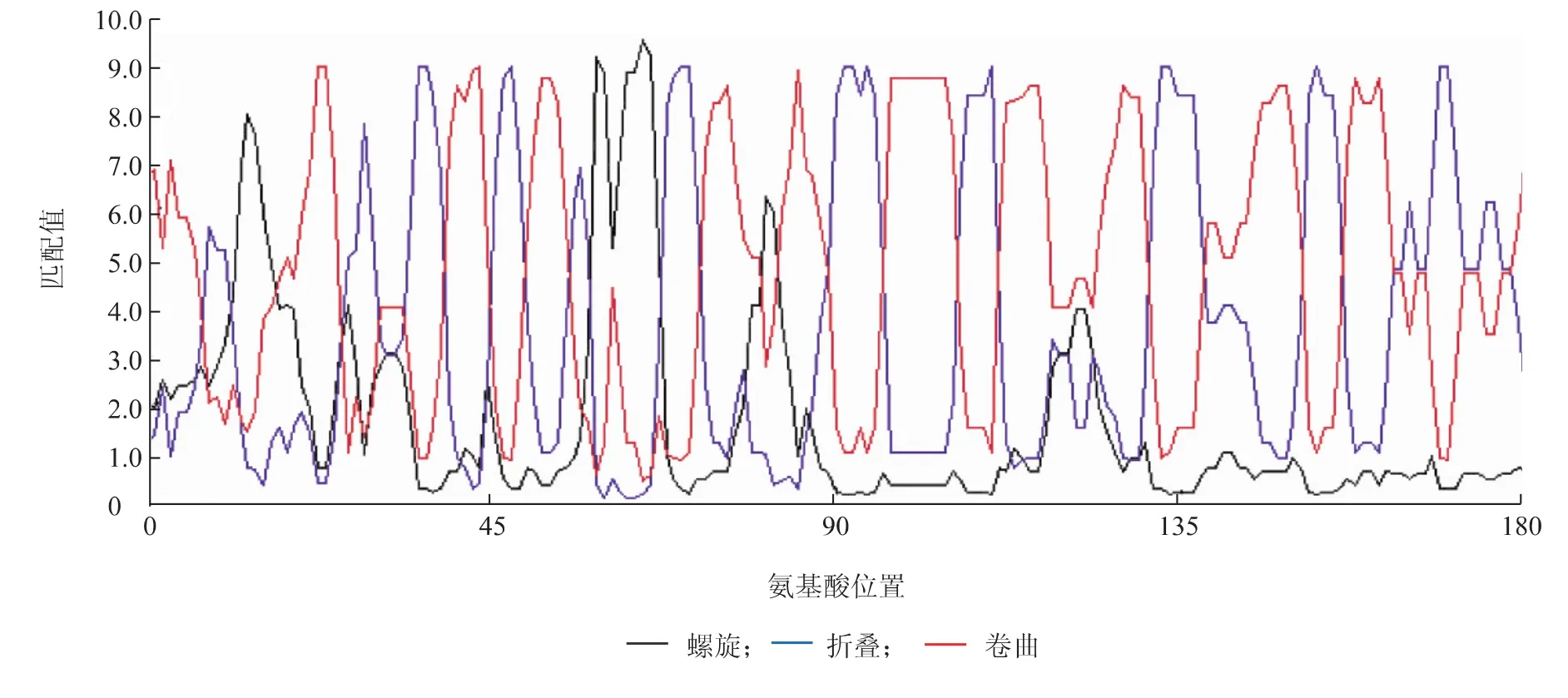
图7 六合黄心芹韧皮部蛋白质AgPP2-2的蛋白质二级结构Fig.7 Secondary structure of phloem protein AgPP2-2 from celery Liuhehuangxinqin
分别对六合黄心芹、津南实芹和美国西芹进行20%PEG处理、200 mmol/L NaCl处理、4℃低温处理、38℃高温处理2 h,通过荧光定量PCR检测不同芹菜韧皮部蛋白质基因AgPP2-2在干旱、高盐、低温和高温处理下的表达情况(图8)。3种芹菜的AgPP2-2基因在干旱、高盐、低温和高温4种不同逆境处理下的相对表达量较对照均表现为不同程度的下降。其中干旱和高温处理后的相对表达量下降幅度最显著,高盐和低温处理后的相对表达量也有不同程度的下降。从3种芹菜中4种不同逆境处理后AgPP2-2基因表达分析结果来看,高温胁迫对Ag-PP2-2基因的表达抑制大于低温胁迫,干旱胁迫对AgPP2-2基因的表达抑制大于盐胁迫。不同芹菜材料逆境胁迫后AgPP2-2基因表达也表现为明显的差异,南京地区的本芹六合黄心芹在高温处理后AgPP2-2基因下降幅度接近一半,而在形态较为接近但地域来源不同的津南实芹和美国西芹中基本检测不到AgPP2-2基因的表达。干旱处理后,津南实芹的表达量却大大高于美国西芹。
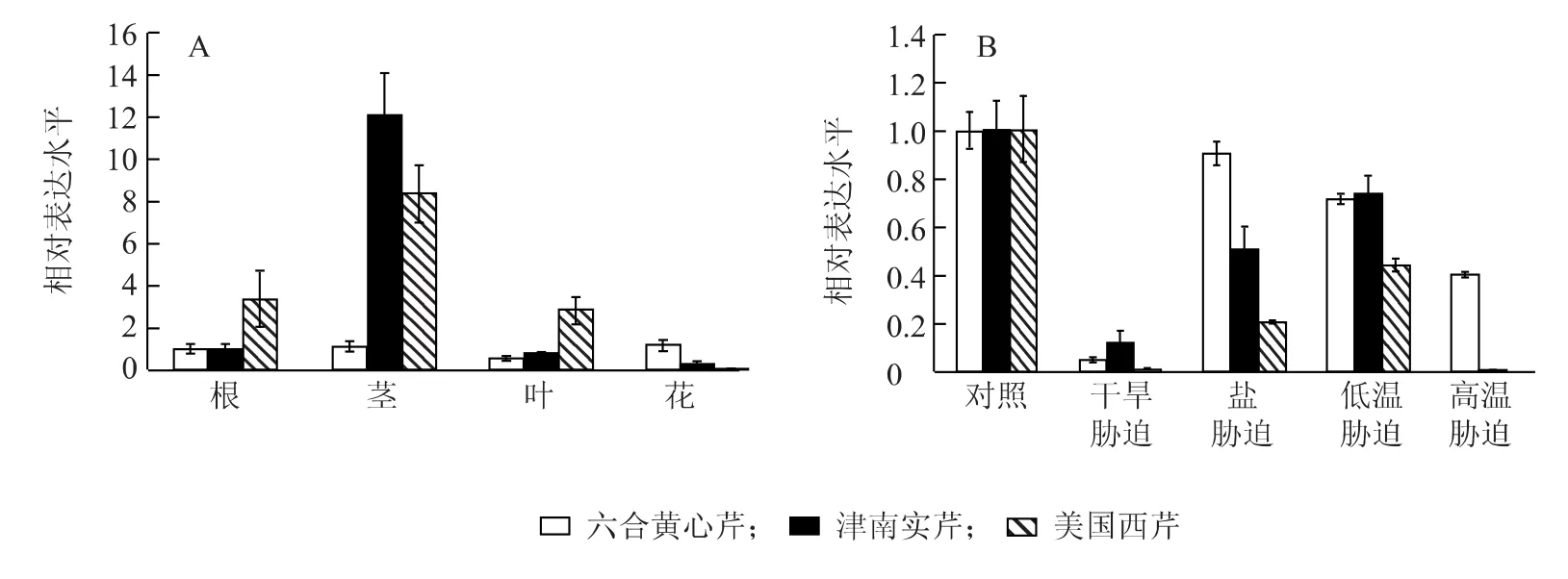
图8 芹菜中AgPP2-2基因在不同组织(A)及逆境胁迫(B)中的表达水平Fig.8 Expression level of phloem protein gene AgPP2-2 in different tissues(A)and adversities(B)of celery
3 讨论
本研究的试验材料中六合黄心芹和津南实芹是中国的地方品种,美国西芹来源于美国,三者具有比较大的地域差异,在外形上也具有一定的差异性。对3种芹菜韧皮部蛋白质基因AgPP2-2核苷酸序列及氨基酸序列进行多重分析比对,发现3个芹菜品种在核苷酸水平上有4个碱基的差异,编码的氨基酸有3个位点的差异,说明在3种芹菜中韧皮部蛋白质AgPP2-2相对较为保守。地域变化、外界环境的改变和人工选育虽然导致了3种芹菜韧皮部蛋白质AgPP2-2在核苷酸和氨基酸水平上的差异,而较小的差异变化可能与韧皮部蛋白质AgPP2-2在芹菜生长发育过程中所具有的特定生理功能有关。
系统进化树分析结果显示,六合黄心芹、津南实芹和美国西芹的韧皮部蛋白质AgPP2-2与石蒜科的忽地笑进化关系最近,与忽地笑和葫芦科的南瓜和笋瓜韧皮部蛋白质在同一个大的进化分支上。禾本科的二穗短柄草、乌拉尔图小麦、水稻、玉米和粟的韧皮部蛋白质处于同一分支,同样蔷薇科的野草莓与桃来自于同一分支,但是伞形科、石蒜科、葫芦科、禾本科、十字花科、豆科、茄科、蔷薇科和杨柳科的各种植物的韧皮部蛋白质及相似蛋白质都分属于不同的分支,说明不同物种的韧皮部蛋白质或相似蛋白质的进化都呈现一定的种属特性,这为伞形科植物的进化研究提供了可靠的理论依据。芹菜韧皮部蛋白质AgPP2-2保守性很高,它们在氨基酸残基数、理论分子量、理论等电点、碱性氨基酸比例、酸性氨基酸比例、不溶蛋白质比例、亲水性/疏水性以及蛋白质二级结构中的结构组成等各方面都保持高度一致,具有 PP2 超家族保守结构域[12,20,21]。芹菜韧皮部蛋白质可能在芹菜生长发育和对环境适应过程中起重要作用,导致该基因进化保守程度较高。
高等植物中,韧皮部蛋白质在物质运输、维持植物形态、抵御外界伤害等方面起着重要作用。芹菜韧皮部蛋白质基因AgPP2-2在3种芹菜不同组织中的表达分析结果显示,AgPP2-2基因在津南实芹和美国西芹茎中相对表达量最高,根和叶中相对表达量较低,在花中相对表达量最低,与芹菜 AgPP2-1基因表达结果相吻合[22],说明AgPP2-2基因的表达与韧皮部组织分布呈现一定的相关性。但是,在南京本芹品种六合黄心芹中呈现出在根、茎、叶和花中表达差异相对较小,叶中的表达量最低,不同的芹菜之间也呈现表达的差异。植物中韧皮部蛋白质主要与植物的物质运输有关,植物在遭受不同逆境处理后,植物本身处于一种防御的状态,相应的新陈代谢速率可能会有所降低,其物质运输会受到影响。本研究发现,不同逆境处理后,3种芹菜的韧皮部蛋白质AgPP2-2基因相对表达量都有不同程度的下降,可能与此相关。另外,芹菜中AgPP2-2基因高温处理后的表达量变化大于低温处理下的表达量变化,干旱处理后的表达量变化大于盐处理后的表达量变化,不同芹菜品种之间也呈现较大的差异。植物的一生经常会遇到干旱、高盐、低温和高温等不良环境条件的影响,导致植物水分亏缺,产生渗透胁迫,严重影响到植物的生长发育,植物具备一定的逆境适应性[23-24]。植物的逆境胁迫调控是复杂的过程,涉及到调控基因和功能基因等等,韧皮部蛋白质参与植物各类物质的运输,对植物抗逆响应起到重要的作用[25-27]。本研究对3种芹菜韧皮部蛋白质 Ag-PP2-2基因的克隆与分析对于进一步分析芹菜相对不耐高温、抗冻性较强等生物学特性具有较为重要的意义。
[1] 娄成后.高等植物的命脉-维管系统之谜[J].植物生理学通讯,1992,28(1):1-10.
[2] GOLECKI B,SCHULZ A,THOMPSON G A.Translocation of structural P proteins in the phloem[J].The Plant Cell,1999(11):127-140.
[3] READ S M,NORTHCOTE D H.Subunit structure and interactions of the phloem proteins of Cucurbita maxima(pumpkin)[J].European Journal of Biochemistry,1983(134):561-569.
[4] AOKI K,SUZUI N,FUJIMAKI S,et al.Destination-selective long-distance movement of phloem proteins[J].The Plant Cell,2005(17):1801-1814.
[5] GOLECKIB,SCHULZ A,CARSTENS-BEHRENSU,et al.Evidence for graft transmission of structural phloem proteins or their precursors in heterografts of Cucurbitaceae[J].Planta,1998(206):630-640.
[6] TOYAMA T,TERAMOTO H,TAKEBA G,et al.Cytokinin induces a rapid decrease in the levels of mRNAs for catalase,3-hydroxy-3-methylglutaryl CoA reductase,lectin and other unidentified proteins in etiolated cotyledons of cucumber[J].Plant and Cell Physiology,1995(36):1349-1359.
[7] BOSTWICK D E,DANNENHOFFER J M,SKAGGS M I,et al.Pumpkin phloem lectin genes are specifically expressed in companion cells[J].The Plant Cell,1992(4):1539-1548.
[8] DINANT S,CLARK A M,ZHU Y,et al.Diversity of the superfamily of phloem lectins(phloem protein 2)in angiosperms[J].Plant Physiology,2003(131):114-128.
[9] 胡桂兵,张上隆,徐昌杰,等.笋瓜韧皮部特异性启动子的克隆分析及新型植物表达载体构建[J].江西农业大学学报,2005,27(4):481-485.
[10]于文静,王玉富,邱财生,等.韧皮部特异性启动子研究概况[J].中国麻业科学,2010(32):116-122.
[11]况守龙,胡廷章.启动子的克隆与研究方法[J].重庆工学院学报,2007,21(1):136-139.
[12] 张德纯.芹菜[J].中国蔬菜,2010(1):15.
[13] 李振琼.药用蔬菜-芹菜[J].家庭医药,2005(10):54.
[14] FAZAL S S,SINGLA R K.Review on the pharmacognostical&pharmacological characterization of Apium graveolens Linn[J].Indo Global Journal of Pharmaceutical Sciences,2012,2(1):36-42.
[15]王海峰,张德琴,刘长勇,等.六合黄心芹周年生产技术[J].长江蔬菜,1999(1):16-18.
[16] TAMURA K,PETERSON D,PETERSON N,et al.MEGA5:molecular evolutionary genetics analysis using maximum likelihood,evolutionary distance,and maximum parsimony methods[J].Molecular Biology and Evolution,2011,28(10):2731-2739.
[17] GASTEIGER E,GATTIKER A,HOOGL A C,et al.ExPASy:the proteomics server for in-depth protein knowledge and analysis[J].Nucleic Acids Research,2003(31):3784-3788.
[18] WILKINSM R,GASTEIGER E,BAIROCH A,et al.Protein identification and analysis tools in the ExPASy server[J].Methods in Molecular Biology,1999(112):531-552.
[19] PFAFFL M W.A new mathematical model for relative quantification in real-time RT-PCR[J].Nucleic Acids Research,2001(29):2002-2007.
[20] TURGEON R,WOLF S.Phloem transport:cellular pathways and molecular trafficking[J].Annual Review of Plant Biology,2009,60:207-221.
[21] VILAINE F,KERCHEV P,CLÉMENT G,et al.Increased expression of a phloem membrane protein encoded by NHL26 alters phloem export and sugar partitioning in Arabidopsis[J].Plant Cell,2013,25(5):1689-1708.
[22]马 静,王 枫,侯喜林,等.芹菜韧皮部蛋白质基因的分离与表达分析[J].植物遗传资源学报,2013,14(3):523-529.
[23] YAMAGUCHI-SHINOZAKI K,SHINOZAKI K.Transcriptional regulatory networks in cellular responses and tolerance to dehydration and cold stresses[J].Annual Review of Plant Biology,2006,57:781-803.
[24] ATKINSON N J,URWIN P E.The interaction of plant biotic and abiotic stresses:from genes to the field[J].Journal of Experimental Botany,2012,63(10):3523-3543.
[25] ASANO T,HAYASHI N,KIKUCHI S,et al.CDPK-mediated abiotic stress signaling[J].Plant Signaling & Behavior,2012,7(7):817-821.
[26] KIM T H.Plant stress surveillance monitored by ABA and disease signaling interactions[J].Molecules and Cells,2012,33(1):1-7.
[27] LI P,CHEN L,ZHOU Y,et al.Brassinosteroids-induced systemic stress tolerance was associated with increased transcripts of several defence-related genes in the phloem in Cucumis sativus[J].PloSOne,2013,8(6):66582.

