人参须根中皂苷类成分的指纹图谱研究
姚红娥,张梅,徐秒,陈璐,谢学军
·炮制制剂·
人参须根中皂苷类成分的指纹图谱研究
姚红娥1,张梅1,徐秒1,陈璐1,谢学军2
目的:采用高效液相色谱法研究不同产地人参须根中皂苷类成分的指纹图谱。方法:PhenomenexC18(250mm ×4.6mm,5μm)色谱柱,流动相:A为乙腈,B为水,梯度洗脱,柱温:35℃,检测波长:203nm。结果:人参须根中皂苷类成分指纹图谱检出13个共有峰,但各批药材相同成分的含量差异较大,其精密度、稳定性、重复性均良好。结论:该方法可为人参须根的质量控制提供参考,同时为课题后期研究奠定基础。
]人参须根;人参皂苷;高效液相色谱法;指纹图谱
人参为常用中药,其药理作用广泛,影响人体多种系统器官,与阿胶、鹿茸并称为中药三宝。人参皂苷为人参的主要活性成分之一,具有抗感染、抗疲劳、抗肿瘤、舒张血管等多重活性。人参在临床上主要用其主根和根茎入药,但亦有研究表明,人参须根(人参的干燥细支根或须根)中皂苷的组成成分与人参主根基本一致[1],且其皂苷含量比主根高[2,3]。本课题组前期研究亦表明含人参须根的补肾活血中药复方对糖尿病视网膜病变有较好的治疗作用[4,5]。为进一步研究该复方防治糖尿病视网膜病变的药效物质基础,探讨组方药物人参须根在其中的药效活性,笔者对人参须根的指纹图谱进行了研究,以期为后续研究提供依据。
近年来,有许多学者对人参中人参皂苷指纹图谱进行了研究,贾晓斌等[6]采用高效液相色谱法建立了人参皂苷类成分的指纹图谱,标示出了人参药材16个共有峰。Wu等[7]采用DR-NIR和ATR-FTIR对人参表皮、木质部、韧皮部进行红外图谱鉴别,所得数据表明红外光谱法可用于人参不同部位的鉴别。但是关于人参须根中皂苷类成分指纹图谱的研究还未见报道。本课题拟以不同来源的人参须根为研究对象,建立其皂苷类成分的化学指纹图谱,了解其成分组成,旨在为人参须根的临床用药和开发利用提供参考。
1 仪器与试药
1.1 仪器
Agilent 1200高效液相色谱仪;Agilent 1200 DAD检测器;Phenomenex C18(250mm ×4.6mm,5μm)色谱柱。
1.2 试剂
乙腈为色谱纯,水为超纯水,其余均为分析纯。
1.3 药材
人参皂苷Rb1对照品(批号:must-12102301,纯度≥98%),购自成都曼斯特生物科技有限公司;人参须根,购自东北三省,经成都中医药大学中药资源与鉴定系裴瑾教授鉴定为五加科植物人参Panaxginseng C.A. Mayer的干燥细支根或须根。药材来源见表1。

表1 人参须根样品来源
2 方法与结果
2.1 色谱条件
Phenomenex C18(250mm ×4.6mm,5μm)色谱柱,流动相:A为乙腈,B为水,梯度洗脱,柱温:35℃,流速1.0mL.min-1,检测波长:203nm,梯度洗脱程序见表2。

表2 梯度洗脱程序
2.2 供试品溶液的制备
[8,9]并结合前期研究结果制备供试品:称取人参须根粗粉5.0 g,50%乙醇超声提取2次,每次100 mL,提取时间为40 min,合并2次提取液并减压抽滤,滤液常压蒸干。加入15 mL水充分溶解,加入15 mL乙醚脱脂两次,取水层加水饱和正丁醇萃取,收集正丁醇液,常压蒸去溶剂即得人参皂苷提取物。取人参皂苷提取物,加乙腈:水(5:95)配制成每1 mL含0.02 g的溶液,过0.45 μm 的微孔滤膜,即得。
2. 3 对照品溶液的制备
精密称取人参皂苷Rb1对照品适量,加乙腈:水(5:95)配制成每1 mL含Rb1为0.2 mg的对照品溶液。
2.4 方法学考察
2.4.1 精密度试验 取同一供试品溶液,在同一色谱条件下,重复进样5次,测得各共有峰相对峰面积RSD小于2%,表明仪器精密度良好。
2.4.2 稳定性试验 取同一供试品溶液,在同一色谱条件下,分别于0h、2h、8h、12h、24h 进样,各共有峰相对峰面积RSD小于1.5%,表明供试品溶液在24h内稳定。
2.4.3 重复性试验 取同一批次人参须根样品,按“2.2”项下的制备方法,分别制备5份供试品溶液,在同一色谱条件下分别进样,各共有峰的相对峰面积RSD小于2%,表明方法重复性良好。
2.5 指纹图谱的建立
取10批人参须根样品,按“2.2”项下的方法制备供试品溶液,分别进样10μL,进行HPLC指纹图谱测定,得到相应的色谱指纹图谱,见图1。在不同批次的样品色谱图中共发现13个共有峰,因人参皂苷Rb1峰面积较大且稳定,选定为参照峰。以人参皂苷Rb1色谱峰为参照峰,计算各共有峰的相对保留时间及相对峰面积,见表3、表4。

图1 10批药材人参皂苷提取物指纹图谱
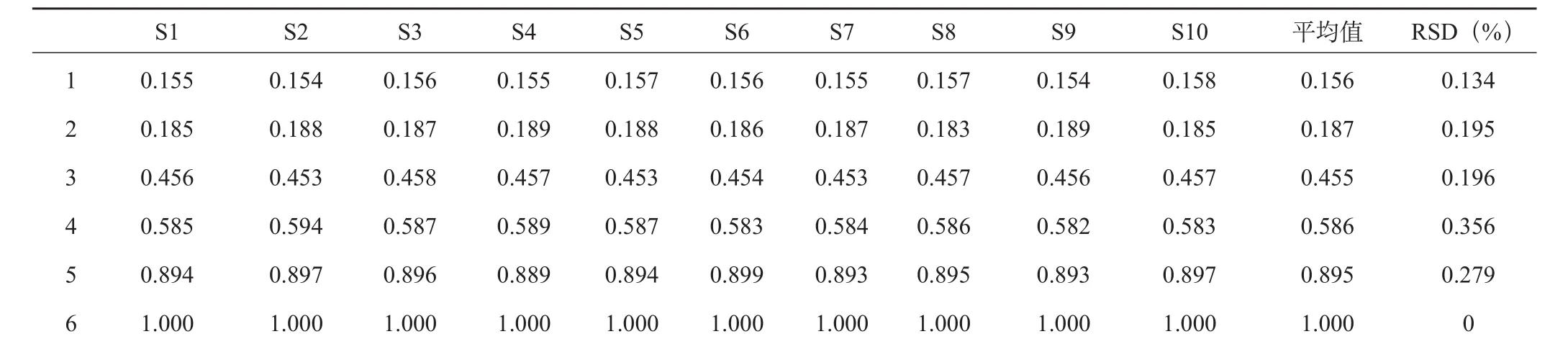
表3 指纹图谱共有峰相对保留时间
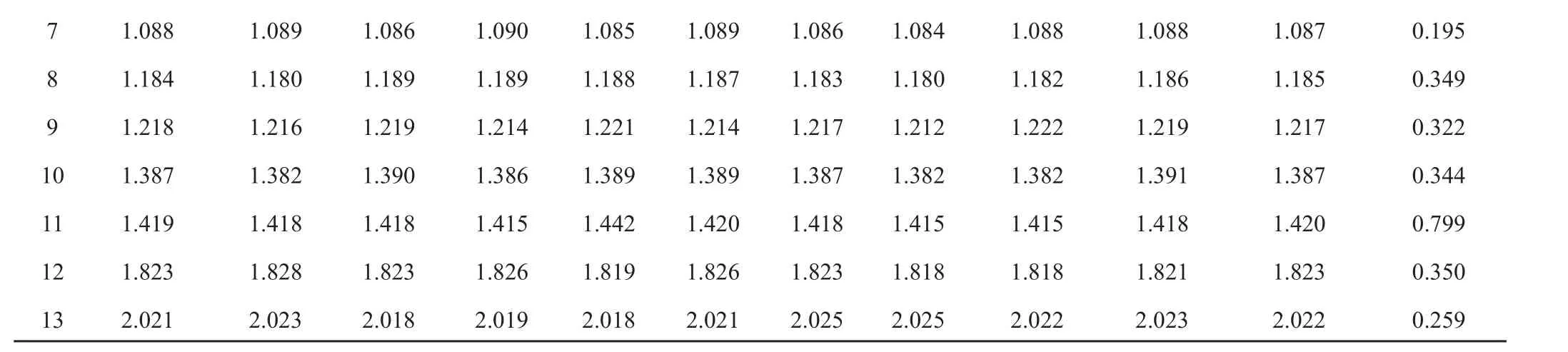
7 1.088 1.089 1.086 1.090 1.085 1.089 1.086 1.084 1.088 1.088 1.087 0.195 8 1.184 1.180 1.189 1.189 1.188 1.187 1.183 1.180 1.182 1.186 1.185 0.349 9 1.218 1.216 1.219 1.214 1.221 1.214 1.217 1.212 1.222 1.219 1.217 0.322 10 1.387 1.382 1.390 1.386 1.389 1.389 1.387 1.382 1.382 1.391 1.387 0.344 11 1.419 1.418 1.418 1.415 1.442 1.420 1.418 1.415 1.415 1.418 1.420 0.799 12 1.823 1.828 1.823 1.826 1.819 1.826 1.823 1.818 1.818 1.821 1.823 0.350 13 2.021 2.023 2.018 2.019 2.018 2.021 2.025 2.025 2.022 2.023 2.022 0.259

表4 指纹图谱共有峰相对峰面积
2.6 指纹图谱相似度计算
(2)应用网络防火墙技术。该种技术是有效控制网络访问安全性的一种计算机网络安全防护技术,其可以确保计算机内部网络环境运行的安全性与稳定性。防火墙技术主要是基于网络交互性,通过借助既定程序来检查网络传输数据,看其是否满足网络数据的传输要求或标准,借此来阻止或允许网络数据的通行。
将10批人参须根的高效液相色谱图导入“中药色谱指纹图谱相似度评价软件系统2004A版”进行数据分析,建立人参皂苷提取物的共有模式,生成人参须根中人参皂苷的对照图谱,见图2。采用上述软件进行相似度分评价,所得10批样品的相似度分析结果见表5。

图2 10批样品皂苷提取物对照图谱

表5 10批样品与对照图谱的相似度
3 讨论
3.1 色谱柱的选择
本实验在相同的色谱条件下,考察了Phenomenex C18(250mm ×4.6mm,5μm)色谱柱,Agilent Hypersil ODS(250mm×4.6mm,5μm)色谱柱和岛津C18(250mm ×4.6mm,5μm)色谱柱的分离效果,三根色谱柱的谱图除保留时间有差别外,色谱峰的分离及峰型也有一定的差别。其中Phenomenex色谱柱的分离度较好,峰型尖锐,因此选用该色谱柱进行测定。
3.2 梯度洗脱条件的选择
本实验中色谱分离过程采用梯度洗脱,考察了多组流动相洗脱系统,(1)乙腈(A):水(B)(0 min~15 min 21 %A,15 min~25 min 21%~24%A,25 min~60 min 24%~40%A);(2) 乙腈(A):0.1 %磷酸溶液(B)(0 min~15 min 21%A,15 min~25 min 21%~19%A,25 min~30 min 19%~22%A,30 min~50 min 22%~31%A,50 min~60 min 31%A,60 min~80 min 31%~40%A);(3)乙腈(A):0.1 %磷酸溶液(B) (0 min~10 min 5%~10%A,10 min~19 min 10%~25%A,19 min~35 min 25%A,35 min~40 min 25%~32%A ,40 min~65 min 32%A,65 min~75 min 32%~50%A,75 min~110 min 50%~95%A);(4) 乙腈(A):水(B)(0~10 min5%~10 %A,10~19 min 10%~25%A,19 min~32 min 25%A ,32 min~37 min 25%~32%A,37 min~63 min 32%A,63 min~73 min 32%~45%A,73 min~75 min45%~50%A,75 min~110 min 50 %~95 %A,110 min~120 min95%A)。结果显示,以流动相系统(4)分离度好,故选择该洗脱条件。
3.3 柱温的选择
本研究在相同的色谱条件下,考察了柱温对色谱分离效果的影响。实验中考察了25℃、30℃、35℃等不同柱温的分离情况,结果表明在35℃时分离效果较好,色谱峰之间距离适中。
3.4 参照物的选择
3.5 指纹图谱分析
通过对10批不同产地的样品进行分析发现,10批药材相对保留时间RSD值均小于1%,但相对峰面积RSD值较大,表明各药材相同成分含量相差较大。10批药材相似度分析发现S8、S9样品的相似度偏低,说明产地的不同会影响人参须根中皂苷的种类和含量。
综上,本实验建立的人参须根中人参皂苷的HPLC指纹图谱的各成分分离较好,基本达到了基线分离,且方法简单易行,可作为人参须根皂苷类成分鉴别的依据,为后期研究提供依据。
[参考文献]
[1] 常建涛,富瑶瑶,吴迪,等. 敦化人参各部位皂苷组分的比较[J].大连工业大学学报,2011, 30(1):43.
[2] 孙芳,吴迪,付绍平,等.移山参、园参各部位中皂苷组成和比例的研究[J].大连轻工业学院学报,2007,26(2):97.
[3] 刘春莹,宋建国,李鹏飞,等.3种人参中的皂苷的组成[J].大连工业大学学报,2011, 30(2):80.
[4] 马殿伟,谢学军,李晓微,等.TGF-β2干预的缺氧状态下补肾活血剂对Müller细胞及谷氨酰胺合成酶活性的影响[J].眼科研究,2010,28(5):408.
[5] 马荣,谢学军,万李,等.补肾活血中药血清对高糖状态下纯化培养的视网膜神经节细胞活力的影响[J].中国中西医结合杂志,2009,29(10):892.
[6] 贾晓斌,黄一平,施亚芳,等.人参皂苷类成分的指纹图谱研究[J].中药材,2001,24(10):722.
[7] Wu Y H,Li Q Q, Zheng Y, et al. Study on difference between, epidermis, phloem and xylem of Radix Ginseng with nearinfrared and infrared spectroscopy coupled with principal component analysis [J].Vib spectrosc,2011,55:201.
[8] 孙聪,曾鹏涛,李天一,等.正交实验法优选人参总皂苷提取工艺的研究[J].长春中医药大学学报,2012,28(3):533.
[9] 郑义,陆辉.人参总皂苷提取工艺的优化研究[J].金陵科技学院学报,2008,24(2):89.
(责任编辑:胡慧玲)
Studies on the HPLC fngerprints of ginsenoside in ginseng fbrous root
/YAO Hong-e1, ZHANG Mei1, Xu Miao1, CHENLu1, XIE Xue-jun2//(1. Pharmacy College, Chengdu University of Traditional Chinese Medicine; The Ministry of Education Key Laboratory of Standardization of Chinese Herbal Medicine; State Key Laboratory Breeding Base of Systematic Research, Development and Utilization of Chinese Medicine Resources Co-founded by Sichuan Province and MOST, Chengdu 611137, China; 2. School of Clinical Medicine, Chengdu University of Traditional Chinese Medicine, Chengdu 610075, China)
Objective: To study the HPLC fngerprints of ginsenoside in ginseng fbrous root from different area. Method: The separation was performed on Phenomenex C18(250mm ×4.6mm,5μm).The mobile phase consisted of acetonitrile and water with gradient elution. The column temperature was 35℃, and the wavelength of detector was 203 nm. Result: 13 peaks were observed on the HPLC fngerprint of ginsenoside, but the contents were quite different. The precision, stability and repeatability were good. Conclusion: The method can provide a reference for quality control of ginseng fbrous root and lay the foundation for futhuer research.
Ginseng fbrous root; ginsenoside; HPLC; fngerprints
R 284
A
1674-926X(2014)02-011-04
国家自然科学基金项目(81072845)
1.成都中医药大学药学院 中药材标准化教育部重点实验室 中药资源系统研究与开发利用省部共建国家重点实验室培育基地,四川 成都 611137;
2.成都中医药大学临床医学院,四川 成都 610075
姚红娥,硕士研究生 Email: yaohonge@sina.cn
张梅,博士,教授,博士生导师,从事中药及其复方物质基础及质量标准化研究工作
Tel:028-61800231 Email: zhangmei63@126.com;谢学军,博士,教授,博士生导师,从事中西医结合防治眼底病的基础与临床研究工作
Tel:028-87783541 Email: xxj8848@163.com
2013-12-13

