聚肌胞苷酸诱导的早期原发性胆汁性肝硬化小鼠模型的建立*
郭晓霞,李良学,武玉鹏,贾丽莉,刘改萍,白崇智
·实验性肝炎·
聚肌胞苷酸诱导的早期原发性胆汁性肝硬化小鼠模型的建立*
郭晓霞,李良学,武玉鹏,贾丽莉,刘改萍,白崇智
目的探讨应用聚肌胞苷酸建立早期原发性胆汁性肝硬化动物模型。方法30只雌性C57BL/6小鼠被随机分为模型组和对照组。模型组小鼠腹腔注射聚肌胞苷酸(5 mg.kg-1),对照组小鼠注射等体积生理盐水,均2次/w,于8 w、16 w和24 w分别检测血清抗线粒体抗体M2亚型、外周血CD4+CD25+Foxp3+计数,以及肝组织CK19表达情况。结果在24 w末,模型组AMA-M2阳性率为100%(5/5),显著高于对照组(0/5);在8 w、16 w和24 w,模型组小鼠外周血CD4+CD25+Foxp3+细胞计数分别为(3.48±0.95)%、(3.30±1.55)%和(2.67±0.97)%,均显著低于相应时间点对照组水平[(7.25±1.63)%、(6.33±1.06)%和(5.58±1.52)%,P<0.05];两组肝组织CK19表达无显著性差异;病理学检查显示模型组小鼠肝组织汇管区和胆管周围炎性细胞浸润呈进行性加重,细小胆管增生,出现胆汁性碎屑样坏死和桥接纤维化,但未出现肝硬化。结论聚肌胞苷酸注射可成功建立早期原发性胆汁性肝硬化动物模型,CD4+CD25+Foxp3+T细胞可能在发病中发挥重要作用。
原发性胆汁性肝硬化;聚肌胞苷酸;动物模型;小鼠
原发性胆汁性肝硬化(primary biIiary cirrhosis,PBC)是一种自身免疫性、慢性进行性胆汁淤积性肝脏疾病。该病以肝脏门静脉炎性细胞浸润和免疫系统介导的肝小叶胆管损伤为特征,常见于中年女性[1],近年来发现该病也可累及年轻的育龄妇女和男性[2]。PBC的肝脏病理学改变主要以肝内细小胆管慢性非化脓性破坏、汇管区炎症、慢性胆汁淤积和肝纤维化为特征。其发病机制尚不完全清楚,推测可能与自身免疫、感染和细胞病变有关[3]。为此,本研究参考相关文献[4,5],以聚肌胞苷酸(Polyinosinic-polycytidylicacid,poly I:C)腹腔注射建立早期PBC小鼠模型,旨在为进一步研究原发性胆汁性肝硬化的发病机制提供理论与实验基础。
1 材料与方法
1.1 动物模型的建立8周龄雌性C57BL/6小鼠30只,体质量约(20±2)g,由北京华阜康生物科技股份有限公司提供,均饲养于山西省中医药研究院实验动物室,自由饮水和进食。适应性饲养1 w后,随机分为模型组(n=15)和对照组(n=15)。在标准饲料喂养的基础上,给予模型组Poly I:C(Sigma公司,50 mg分装)5 mg.kg-1腹腔注射,2次/w,直至24 w;给予对照组小鼠等体积生理盐水腹腔注射,2次/w,直至24 w。实验中每隔8周每组取5只小鼠处死,行相应检测。
1.2 血清抗线粒体抗体M2亚型(AMA-M2)检测自小鼠眼眶采血,留取血浆,采用双抗原夹心酶联免疫法检测AMA-M2(欧蒙医学诊断股份公司)。用纯化的抗原包被微孔板,制成固相抗原,往包被单抗的微孔中依次加入AMA-M2,再与HRP标记的抗原结合,形成抗原-抗体-抗原复合物,在彻底洗涤后,加底物TMB显色。TMB在HRP酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。颜色的深浅与样品中AMA-M2呈正相关。在酶标仪450 nm波长下测定吸光度(OD值),通过标准曲线计算样品AMA-M2水平。
1.3 肝组织病理学检查取肝脏于冰生理盐水中清洗,在10%缓冲福尔马林固定液中固定,石蜡包埋,切片,行HE、PASM及Massom染色,镜下观察肝脏病理学变化。
1.4 肝组织细胞角蛋白19(cytokeratin 19,CK19)表达的检测选取与常规HE切片系同一个蜡块组织的连续切片,根据HE切片中的组织学表现,选定各级别病变所对应的区域,采用链霉菌抗生物素蛋白-过氧化物酶(streptavidin-perosidase,SP)法检测肝组织CK19(Santa Cruz公司)的表达情况。CK19为胆管上皮细胞的特异表达蛋白,在免疫组化染色后,棕色为CK19阳性表达,应用多功能真彩色细胞图像分析管理系统(美国Media Cybernetics公司Image-Pro Plus)计算各组标本阳性细胞数与阳性细胞染色强度。结果判断参照免疫组织化学染色计分(immunohistochemical scores,IHS)评判[6,7]:即,IHS=A×B。A为阳性细胞数分级:0%~1%=0,1%~10%=1,11%~50%=2,51%~80%=3,81%~100%=4; B为阳性细胞显色强度分级:0(阴性),1(弱阳性),2(阳性),3(强阳性)。
1.5 外周血CD4+CD25+Foxp3+T细胞的检测取小鼠外周血清,将抗CD4、CD25和Foxp3组合抗体(德国Beckmann化学公司)分别加入到抗凝血100 μl中,振荡混匀,避光放置15 min,在溶血仪裂解红细胞后上机(美国Beckman coulter 3XL)检测。以FITC、PE和PC5标记的小鼠IgG作为同型对照。设门确定T淋巴细胞分布位置,计算各组小鼠外周血T淋巴细胞中CD4+CD25+Foxp3+Treg细胞所占比例。
1.6 统计学方法所有数据应用SPSS 21.0统计软件进行统计学处理,计量资料以()表示,组间均数的比较采用t检验,P<0.05为差异具有统计学意义。
2 结果
2.1 血清AMA-M2检测情况在不同时间模型组和对照组动物血清AMA-M2阳性率如表1所示,随着造模时间的延长,模型组血清AMA-M2阳性率持续升高,第24 w所有动物血清呈阳性,而对照组小鼠血清在各阶段中均为阴性。
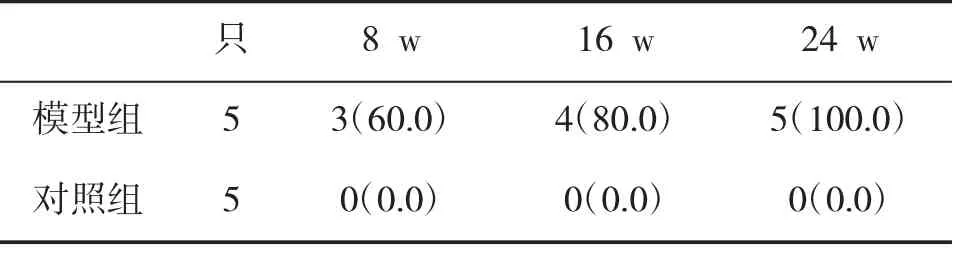
表1 两组小鼠血清AMA-M2阳性率(%)比较
2.2 肝组织病理学表现对照组小鼠肝脏呈粉红色或绛红色,表面光滑清晰。肉眼可见模型组小鼠肝脏肿大,色泽黄变;在造模8 w后,模型组小鼠肝组织汇管区扩大,周围纤维化,淋巴细胞浸润(图1A);在第16 w,汇管区周边出现细小的胆管增生及炎性细胞浸润,肝内小胆管周围也开始出现纤维化(图1B);至第24 w时,肝组织汇管区界板出现胆汁性碎屑样坏死和桥接纤维化(图1C);对照组小鼠肝组织在不同阶段均结构清晰,汇管区及胆管周围未见明显的炎性细胞浸润(图1D~F)。
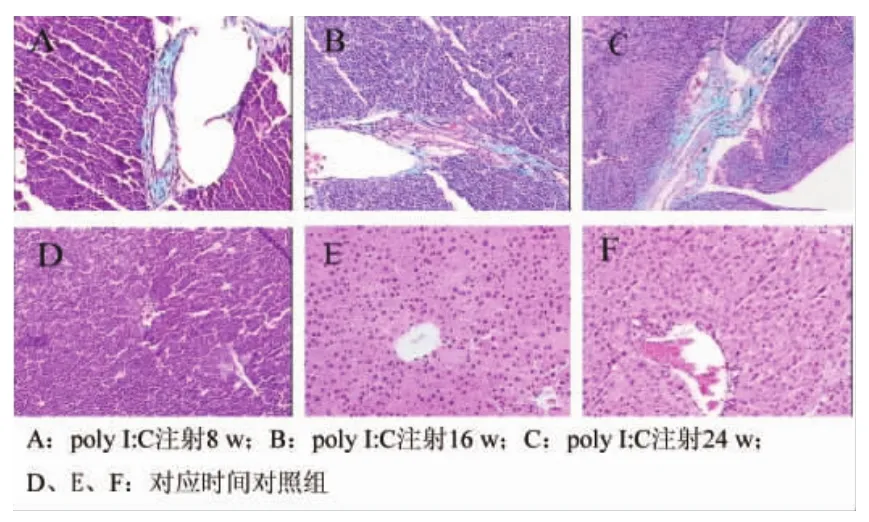
图1 两组小鼠肝组织病理学表现(HE,PASM,MASSOM,100×)
2.3 肝组织CK19表达情况在模型组肝组织中,随着造模时间的延长,肝组织CK19表达呈逐渐增强趋势,间质中胆管增加,并出现假胆管,均呈阳性着色,见图2(A~C);在正常肝组织中,间质中胆管有CK19表达,呈阳性着色,但几乎看不到明显增生活跃的胆管上皮细胞,见图2(D~F),但两组肝组织CK19免疫组化评分比较,差异无明显统计学意义(P>0.05,表2)。
表2 两组小鼠肝内胆管细胞CK19表达IHS评分()比较
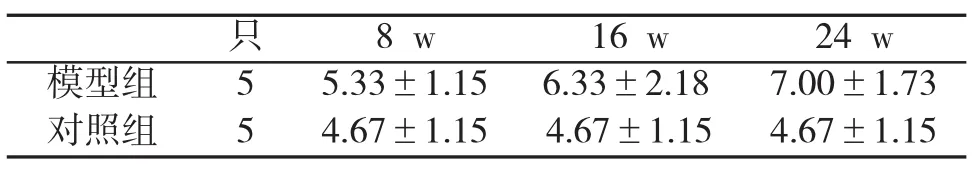
表2 两组小鼠肝内胆管细胞CK19表达IHS评分()比较
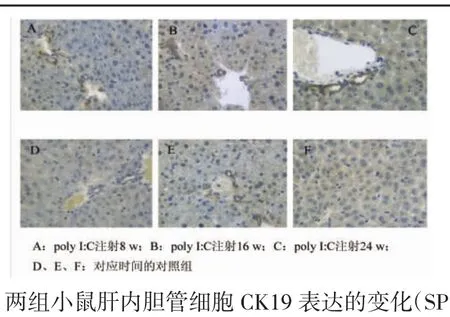
图2 两组小鼠肝内胆管细胞CK19表达的变化(SP,400×)
2.4 外周血CD4+CD25+Foxp3+Tregs细胞计数的变化随着造模时间的延长,模型组和对照组小鼠外周血CD4+CD25+Foxp3+Tregs比例均呈下降趋势,但模型组下降更为明显,与对照组比,差异有统计学意义(P<0.05,表3和图3)。
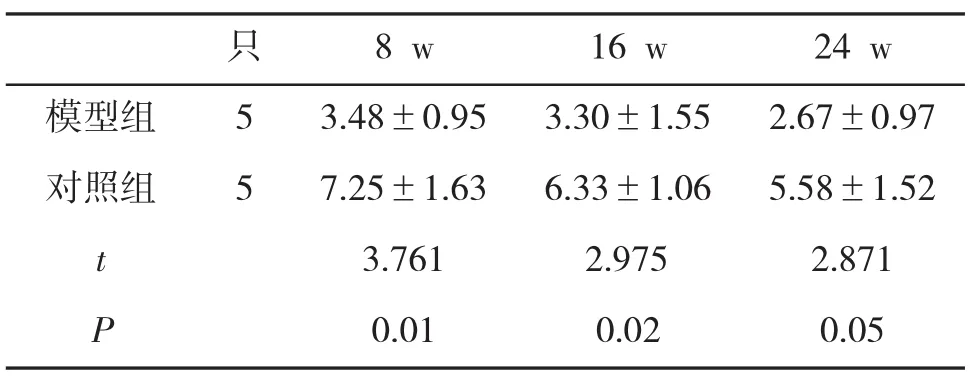
表3 两组小鼠外周血CD4+CD25+Foxp3+Tregs细胞计数(%)的变化
3 讨论
Poly I:C是一种I型干扰素,在自身免疫病的发生和进展过程中发挥作用[8~12]。Poly I:C可以诱导PBC样动物模型,但是其确切的作用机制尚不清楚。本研究采取PolyI:C给C57BL/6小鼠腹腔注射建立PBC模型,在实验中发现随着造模时间的延长,模型组小鼠血清AMA-M2阳性率呈逐渐升高趋势,第24 w可达到100%,而对照组小鼠血清在各阶段中均为阴性,提示本研究制备PBC模型成功,因而具有较大的应用价值。
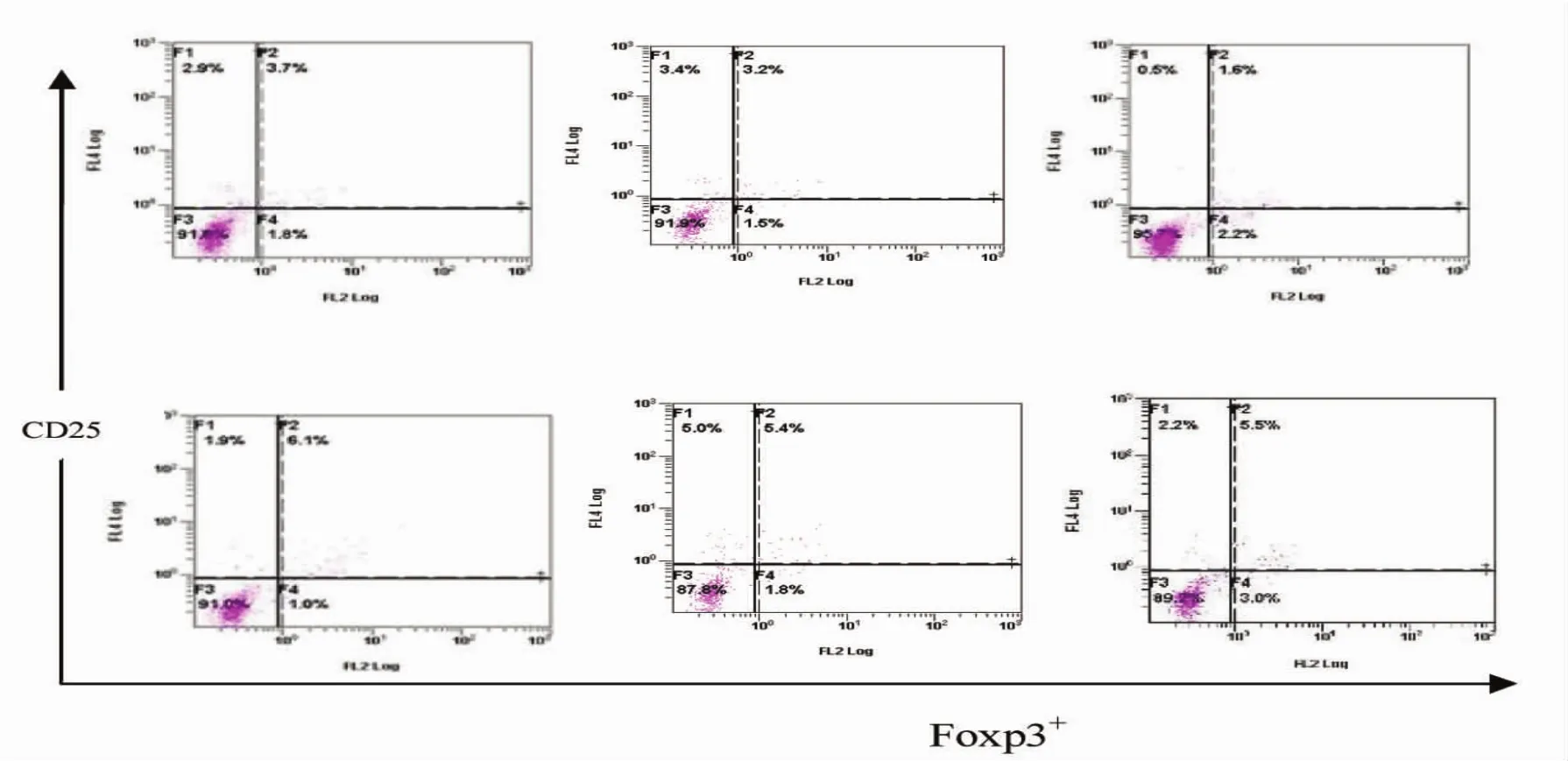
图3 两组小鼠外周血CD4+CD25+Foxp3+Tregs细胞计数变化
肝组织活检是确诊PBC的重要依据,其肝组织学上可分为四期[13]:I期为门管区炎伴有胆小管肉芽肿性破坏;II期为门脉周围炎伴胆管增生;III期可见纤维间隔和桥接坏死形成;IV期为肝硬化期。在造模过程中,我们发现对照组肝脏组织未发生明显的病理学改变,模型组在Poly I:C注射后汇管区出现炎性细胞浸润,随着造模时间的延长,模型组肝组织内炎性细胞浸润呈进行性加重,汇管区逐渐扩大,周边部出现细小胆管增生,淋巴细胞浸润,肝内小胆管周围也开始出现炎性反应及纤维化;至第24 w时,模型组肝组织汇管区界板出现胆汁性碎屑样坏死和桥接纤维化,但未出现肝硬化,说明模型组小鼠肝组织在向III期进展,可能为早期PBC。
CK19是胆管上皮细胞特异性标志蛋白,在正常肝组织中,胆管上皮细胞阳性表达,而肝细胞呈阴性表达[14]。本实验发现在模型动物肝组织中,随着造模时间的延长,肝组织间质中胆管、假胆管及增生的胆管呈CK19阳性着色,呈逐渐增强趋势,提示胆管增生活跃。但直至24 w并未发现胆管缺失、闭锁等晚期PBC的病理学改变,提示该模型仅符合人类PBC早期病理学变化。
有学者发现T细胞、B细胞以及NKT细胞等对肝脏淋巴细胞浸润、胆管上皮细胞损伤以及AMA的产生发挥着重要的作用[15]。Th细胞在介导自身抗体的产生以及维系胆管内皮细胞的免疫功能方面发挥举足轻重的作用[10]。在PBC病人的外周血和受累的胆管周围都被证实有CD4+的自身反应性T细胞的存在[16]。研究表明CD4+CD25+Treg细胞的形成及活化对维持外周免疫耐受、控制过度免疫应答及免疫相关疾病的发生至关重要[17],可使细胞免疫应答能力下降,从而导致疾病不断进展甚至恶化,尤其与PBC发生、发展及胆小管和肝细胞的破坏有关[16]。Foxp3+是控制Treg分化的核心转录因子,在CD4+CD25+Treg细胞的产生和功能发挥方面都起到决定性的作用[18]。
本研究以PolyI:C腹腔注射建立小鼠PBC动物模型,在24 w后对PBC小鼠外周血CD4+CD25+Foxp3+所占比例进行流式分析。结果表明,模型组和对照组CD4+CD25+Foxp3+计数均呈下降趋势,但模型组下降更为明显,两组之间比较,差异有统计学意义(P<0.05),对照组小鼠细胞的变化与C57BL/6小鼠本身具有一定的自身免疫倾向有关,而Poly I:C能够加快其自身免疫反应的进展。本文观察到PBC小鼠外周血CD4+CD25+Foxp3+细胞所占比例呈明显下降趋势,与对照组差异有统计学意义(P<0.05),与国外对PBC患者的研究结果一致[19]。本实验提示CD4+CD25+Foxp3+调节性T细胞表达低下或绝对数减少可能是原发性胆汁性肝硬化发病以及病情加重的因素之一,这也为通过体外培养增殖调节性T淋巴细胞,回输给患者发挥免疫抑制作用,以纠正患者体内调节性T细胞的相对平衡[20],提供了一定的依据。
本研究表明,应用PolyI:C给C57BL/6小鼠腹腔注射可以成功制备早期原发性胆汁性肝硬化动物模型,发现CD4+CD25+Foxp3+T细胞可能在原发性胆汁性肝硬化的发病中发挥重要作用。本研究为进一步研究原发性胆汁性肝硬化的发病机制奠定了一定的基础。
[1]Talwalkar JA,Souto E,Jorgensen RA,et al.Natural history of pruritus in primary biliary cirrhosis.Clin Gastroenterol Hepatol,2003,1(4):297-302.
[2]Hirschfield GM.Diagnosis of primary biliary cirrhosis.Best Pract Res Clin Gastroenterol,2011,25(6):701-712.
[3]段维佳,贾继东.原发性胆汁性肝硬化的诊断和治疗.胃肠病学,2009,14(4):209-213.
[4]马欢,王邦茂.原发性胆汁性肝硬化动物模型研究进展.国际消化病杂志,2012,32(2):93-95.
[5]Concepcion AR,Medina JF.Approaches to the pathogenesis of primary biliary cirrhosis through animal models.Clinics Res Hepatol Gastroenterol,2012,36(1):21-28.
[6]许良中,杨文涛.免疫组织化学反应结果的判断标准.中国癌症杂志,1996,6(4):229-231.
[7]Soslow RA,Dannenberg AJ,Rush D,et al.Cox-2 is expressed inhumanpulmonary,colonic,andmammarytumors.Cancer,2000,89(12):2637-2645.
[8]LleoA,InvernizziP,MackayIR,etal.Etiopathogenesisof primary biliary cirrhosis.World J Gastroenterol,2008,14(21): 3328-3337.
[9]McNally RJ,James PW,Ducker S,et al.Seasonal variation in the patient diagnosis of primary biliary cirrhosis:further evidence foranenvironmentalcomponenttoetiology.Hepatology,2011,54(6):2099-2103.
[10]Invernizzi P,Selmi C,Gershwin ME.Update on primary biliary cirrhosis.Dig Liver Dis,2010,42(6):401-408.
[11]刘然,陆伦根.抗线粒体抗体对原发性胆汁性肝硬化诊断价值研究进展.实用肝脏病杂志,2014,17(2):218-221.
[12]Braun D,Geraldes P,Demengeot J.Type I interferon controls the onset and severity of 232232autoimmune manifestations in lpr mice.J Autoimmun,2003,20(1):15-25.
[13]自身免疫性肝病诊断和治疗指南.中华医学会风湿病学分会.中华风湿病学杂志,2011,15(8):556-558.
[14]Hsia CC,Evarts RP,Nakatsukasa H,et al.Occurrence of oval-typecellsinhepatitisBvirus-associatedhuman hepatocarcinogenesis.Hepatology,1992,16(6):1327-1333.
[15]Kaplan MM,Gershwin ME.Primary biliary cirrhosis.N Engl J Med,2005,353(12):1261-1273.
[16]BernuzziF,FenoglioD,BattagliaF,etal.Phenotypicaland functional alterations of CD8 regulatory T cells in primary biliary cirrhosis.J Autoimmun,2010,35(3):176-180.
[17]刘娟,曹雪涛.2012年度免疫学研究重要进展.中国免疫学杂志,2013,29(1):3-13.
[18]Ramsdell F.Foxp3 and natural regulatory T cells:key to a cell lineage.Immunity,2003,19(2):165-168.
[19]许茵,杨小娟,蒯守刚.原发性胆汁性肝硬化患者外周血CD4+CD25+Foxp3+调节性T细胞检测及其临床意义.中国实验诊断学,2014,18(4):592-594.
[20]Muratori L,Longhi MS.The interplay between regulatory and effector T cells in autoimmune hepatitis:Implications for innovative treatment strategies.J Autoimmun,2013,46(17):74-80.
(收稿:2014-06-20)
(校对:陈从新)
Establishment of a mouse model of early primary biliary cirrhosis by polyinosinic-polycytidylic acid
Guo Xiaoxia,Li Liangxue,Wu Yupeng,et al.Department of Liver Diseases,Traditional Chinese Medicine Hospital,Taiyuan 030012,Shanxi Province,China
ObjectiveTo establish an animal model of early primary biliary cirrhosis(PBC)by injection of polyinosinic-polycytidylic acid(Poly I:C).MethodsThirty female C57BL/6 mice were randomly divided into model and control group.Mice in model group were injected with poly I:C at a dose of 5 mg.kg-1while animals in control with equal volume of saline for 24 weeks.The antimitochondrial antibody-M2(AMA-M2),CD4+CD25+Foxp3+cells were detected at 8,16 and 24 weeks.Histological changes of liver samples were evaluated with HE,PASM,and masson trichrom staining and CK19 was detected by anti-CD19 antibody staining at each stage. ResultsThe positive rate of AMA-M2 in model group at week 24 was 100%(5/5),significantly higher than in the control group(0/5);The percentages of CD4+CD25+Foxp3+Tregs in the peripheral blood in model group at week 8,16 and 24 were(3.48±0.95)%,(3.30±1.55)%and(2.67±0.97)%,all of which significantly lower than those in the control group at each corresponding time[(7.25±1.63)%,(6.33±1.06)%and(5.58±1.52)%,P<0.05];The expression of CK19 in liver tissues showed no significant difference between the two groups;Liver pathology showed progressively increased infiltration of inflammatory cells around the portal area and bile duct,small bile duct proliferation,bilious fragmental necrosis and bridging fibers in model group.ConclusionsThe animal model of early PBC is successfully established by injection of Poly I:C and the CD4+CD25+Foxp3+T cells may play a critical role in the pathogenesis ofthe entity.
Primary biliary cirrhosis;Polyinosinic-polycytidylic acid;Mouse;Animal model
山西省卫生厅科技攻关项目(编号:201301019)
030015太原市山西省中医院肝病科(郭晓霞);山西省中医药研究院中心实验室(武玉鹏,贾丽莉,白崇智);山西省中医院病理科(刘改萍);山西省中医药研究院硕士研究生(李良学)
郭晓霞,女,38岁,医学博士,副主任医师,硕士研究生导师。主要从事中医药防治慢性肝病研究。E-mail: gxxsunny@hotmail.com
10.3969/j.issn.1672-5069.2014.06.015

