糖调节受损大鼠认知障碍及脑组织NF-κBp65、TNF-α 的表达
董银华,王洪新,陈泽峰,魏 佳,赵 岚,李 强,范宏光
糖调节受损(impaired glucose regulation,IGR)是糖尿病前期糖调节失衡的一种表现,一般包括空腹血糖受损(impaired fasting glucose,IFG)和糖耐量受损(impaired glucose tolerance,IGT)。糖尿病是一个较早就被证实与认知功能障碍相关的因素[1],然而糖耐量受损作为糖尿病前期的一个重要临床阶段,是否与认知功能障碍相关,至今尚无定论[2]。本研究通过建立糖调节受损大鼠模型,从炎症机制角度探讨糖调节受损与认知障碍的关系。
1 材料和方法
1.1 动物模型制备 SPF 级雄性Wistar 大鼠50 只,体重180~200 g,由中国人民解放军军事医学科学院实验动物中心提供,许可证号:SCXK-(军)2007-004,随机分为对照组(NGT 组)和实验组(IGR组),每组25 只。两组均适应性喂养1 w(不计入实验周期),NGT 组给予普通饲料;IGR 组给予高脂高糖饲料,自由进水,室温18 ℃~22 ℃,饲养20 w。从第8 周开始,每2 w 取鼠尾静脉血进行一次葡萄糖耐量实验,空腹血糖6.2~7.5 mmol/L 或者餐后2 h 血糖7.9~10.4 mmol/L 的大鼠造模成功[3]。
1.2 行为学检测 NGT 组和IGT 组分别于第5 周、第10 周、第15 周、第20 周,采用Morris 水迷宫试验测定包括:适应性训练、定位航行实验、空间探索试验测定大鼠学习记忆能力,评定认知功能。
1.3 脑组织NF-κBp65、TNF-α 免疫组织化学检测 造模成功后,每组每个时间点随机取5 只大鼠深度麻醉后,4%多聚甲醛灌注后,断头取脑,以视交叉前缘作后作冠状位切片,行4 μm 厚的连续切片,然后依次脱水、透明、浸蜡和包埋。石蜡切片经脱蜡、水化,分别滴加第一抗体NF-κB、TNF-α,并4 ℃过夜。滴加生物素标记体,37 ℃孵育30 min。滴加过氧化物-链霉素卵白素37 ℃孵育30 min。DAB 显色,苏木素复染。目镜测微尺在200 倍视野下计数细胞,分别取大鼠脑组织连续切片10 片,每片选10 个阳性视野,计数网格中阳性细胞数,重复3 次,取其平均值。
1.4 脑组织NF-κB mRNA、TNF-α mRNA 原位杂交检测 原位杂交寡核苷酸探针试剂盒购自武汉博士德公司,用生物素标记。切片透明脱水后用0.01 mmol/L PBS 冲洗,0.2 mmol/L 盐酸室温酸化10 min,再次0.01 mmol/L PBS 冲洗后以25 μg/ml 蛋白酶K73 ℃消化10 min,并以2.5 g/L 乙酸酐平衡后,浸入90%(体积分数)乙醇脱水。切片在空气中干燥后,用2 μg/ml 的生物素标记寡核苷酸探针孵育组织(30 μl/切片),42 ℃孵育过夜(对照:杂交反应液中不加探针,用有意义链作探针)。杂交后系列SSC 洗涤封闭,置0.3%(体积分数H2O230 min),而后4 ℃抗生物素血清过夜,置试剂盒ABC 液室温孵育2 h,DBA 室温染色5 min,阳性反应呈棕褐色。
2 结果
2.1 糖耐量损害大鼠成模情况 高脂高糖饲料饲养10 w 大鼠成模率60%;饲养15 w 大鼠成模率100%,模型组死亡2 只,及时补充。
2.2 认知功能评定情况 第5 周IGR 组较NGT 组逃避潜伏期短,空间探索时间长,随着饲养周期的延长,糖调节损害大鼠逐渐成模;第15 周IGR 组大鼠全部成模,IGR 大鼠较NGT 组大鼠逃避潜伏期延长,空间探索穿台次数减少,实验结果有统计学差异(P<0.05);20 w 时IGR 组与NGT 组大鼠比较学习记忆能力显著下降(P<0.01)(见表1)。NGT 组内不同时间点比较无差别,IGR 组自10 w 以后逐渐下降,差别显著(P<0.01)。随着饲养周期的延长,达到糖调节受损状态,大鼠的学习记忆能力明显降低。
2.3 大鼠脑 组织NF-κBp65、TNF-α 及NFκBp65mRNA、TNF-αmRNA 表达 NF-κBp65、TNF-α阳性表达为胞浆呈现棕黄色,强阳性时细胞核也出现棕黄色颗粒,胞核蓝染。采用平均灰度值比较大鼠脑组织NF-κBp65 和TNF-α 蛋白及mRNA 阳性表达水平。在第5 周IGR 组与NGT 组两因子表达无差异(P>0.05);与NGT 组比较第10 周IGR 组NFκBp65 及mRNA 表达有差异(P<0.05);第15 周、第20 周逐渐增高,组间差异有统计学意义;与NGT组比较第15 周IGR 组TNF-α 及TNF-α mRNA 表达有差异(P<0.05);第20 周有显著差异(P<0.01),具体结果(见表2~表5)。
2.4 NF-κBp65 及TNF-α 的表达水平与认知之间的关系 Pearson 直线相关回归分析发现,IGR组大鼠学习记忆成绩与NF-κBp65 阳性表达水平呈正相关(r=0.472,P<0.05),与TNF-α 阳性表达水平呈正相关(r=0.475,P<0.05),而NGT 组两者无明显相关性(r=0.260,P>0.05)。
表1 两组大鼠学习记忆能力(±s)
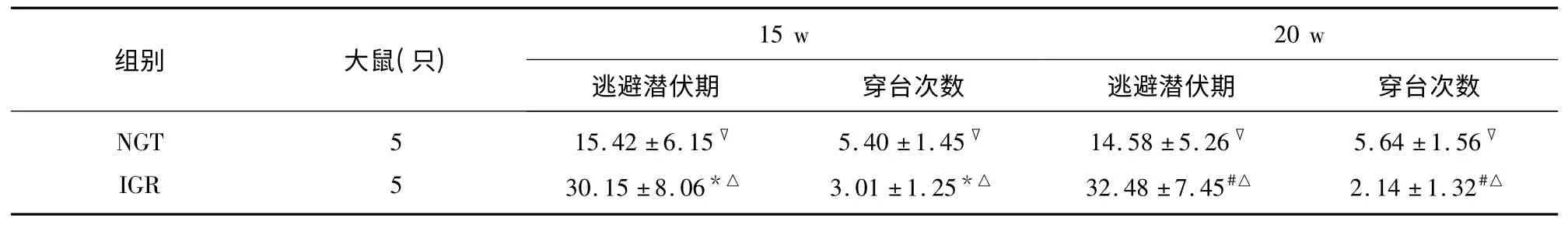
表1 两组大鼠学习记忆能力(±s)
与NGT 组比较* P<0.05,#P<0.01;与NGT 组内比较▽P>0.05;IGR 组10 w 以后比较△P<0.01
表2 两组大鼠不同时间点脑组织NF-κB 平均灰度值比较(±s)
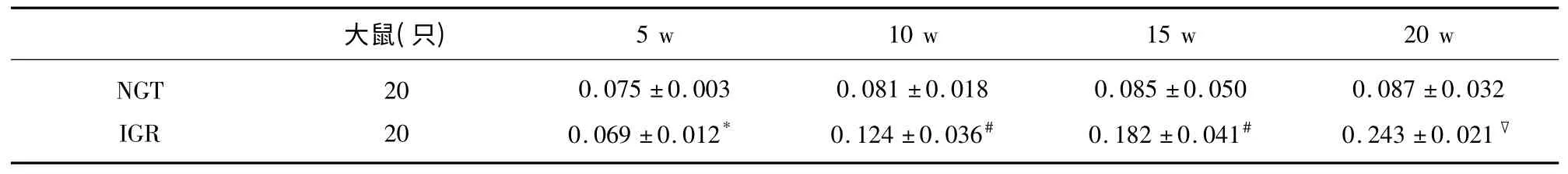
表2 两组大鼠不同时间点脑组织NF-κB 平均灰度值比较(±s)
与NGT 组比较* P>0.05,#P<0.05,▽P<0.01
表3 两组大鼠不同时间点脑组织TNF-α 平均灰度值比较(±s)

表3 两组大鼠不同时间点脑组织TNF-α 平均灰度值比较(±s)
与NGT 组比较* P>0.05,#P<0.05,▽P<0.01
表4 两组大鼠不同时点脑组织NF-κB p65 mRNA 平均灰度值比较(±s)

表4 两组大鼠不同时点脑组织NF-κB p65 mRNA 平均灰度值比较(±s)
与NGT 组比较* P>0.05,#P<0.05,▽P<0.01
表5 两组大鼠不同时间点脑组织TNF-α mRNA 平均灰度值比较(±s)
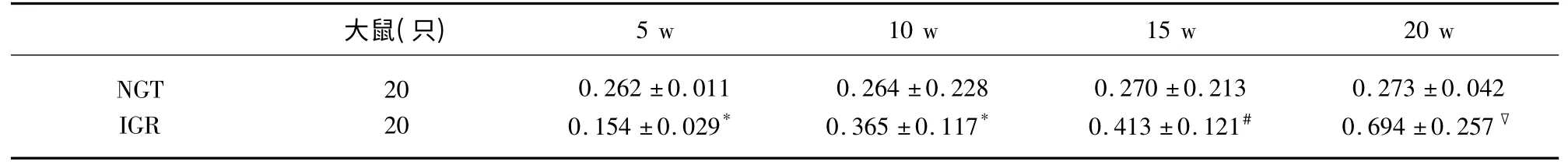
表5 两组大鼠不同时间点脑组织TNF-α mRNA 平均灰度值比较(±s)
与NGT 组比较* P>0.05,#P<0.05,▽P<0.01
3 讨论
糖调节受损(IGR)是糖尿病前期状态,是糖尿病的高危人群。糖尿病是痴呆的高危因素已被公认。英国前瞻性糖尿病研究发现,新诊断的2 型糖尿病半数已有血管病变,提示血管病变可发生于糖尿病之前,即在IGR 阶段已经有炎性反应的发生,且可能与血管性认知障碍有关[4]。有研究报道[5]在60 岁以上老年患者人群中正常范围高血糖水平海马与杏仁核萎缩明显,认知功能减低明显。这也提示在诊断糖尿病之前高血糖水平已经对脑组织造成损害,影响老年人的认知功能。近年研究发现较多的炎性因子在胰岛素抵抗和IGR 的发生中具有重要作用,如C 反应蛋白、肿瘤坏死因子-α 等都与糖耐量损害有关[6]。
核转录因子NF-κB,在静息状态下以二聚体状态在细胞浆内与IκB 结合,激活后与IκB 解离,NFκB 核因子定位序列暴露,NF-κB 进入细胞核内,以二聚体的形式起转录调节作用,从而诱导白细胞介素-1、细胞间粘附分子、肿瘤坏死因子(TNF-α)等的表达,白细胞在各种炎性介质的介导下,向血管内皮细胞移动、粘附并渗出,参与炎症的的级联反应,最终导致缺血性神经元的损伤,另外各项因子如肿瘤坏死因子、白介素的表达反过来进一步增加NF-κB从而进一步促进炎症因子的表达,进一步加重炎症反应,形成恶性循环[7~9]。
本研究发现造模成功,第15 周后认知功能评价,糖调节受损大鼠学习记忆、能力明显迟滞于对照组大鼠,而且随着时间的延长这种趋势愈加明显;同时研究发现糖调节受损大鼠脑组织第10 周开始NFκBp65 蛋白表达NF-κBp65 mRNA 的表达均高于正常对照组,TNF-α 蛋白表达和TNF-α mRNA 的表达第15 周开始表达明显增高,两组间差异均有统计学意义,而炎症因子表达不同步的原因可能与上游NFκBp65 炎性激活的过程有关。Pearson 直线相关回归分析糖调节受损大鼠认知功能与NF-κB、TNF-α 的阳性表达水平呈正相关。
因此本研究认为炎症机制在认知障碍的发病过程中起着重要的作用,大鼠脑组织NF-κB 和TNF-α炎性因子,参与了大鼠认知功能障碍形成的过程。
综上,糖耐量受损大鼠脑组织炎性因子NF-κB、TNF-α 的表达明显高于对照组,且与大鼠认知功能障碍明显相关,本研究从炎症角度探讨了糖调节受损对大鼠认知功能障碍的影响,认为炎症机制是糖调节受损认知功能障碍的重要机制,抗炎治疗可能是防治糖调节受损认知功能障碍的重要靶点。
[1]Dash SK.Cognitive impairment and diabetes[J].Recent Pat Endocr Metab Immune Drug Discov,2013,7(2):155-165.
[2]Daniel J,Boris P,Linda A,et al.Relationships between hyperglycemia and cognitive performance among adults with type 1 and type 2 diabetes[J].Diabetes Care,2005,28:71-77.
[3]王 竹,杨月欣,向雪松,等.实验大鼠血糖正常范围的估算[J].卫生研究,2010,39(2):133-142.
[4]Debeng D,Amelang M,Hasselbach P,et al.Diabetes and cognitive function in a population-based study of elderly women and men[J].J Diabetes Complications,2006,20(4):238-245.
[5]Lucia Kerti,Veronica Witte,Angela Winkler,et al.Higher glucose levels associated with lower memory and reducedhippocampal microstructure[J].Neurology,2013,81:1746-1752.
[6]Griffin WS.Inflammation and neurodegenerative disease[J].Am J Clin Nutr,2006,83(Suppl):470-474.
[7]Cora H,Nijboer,Cobi J,et al.A dual role of the NF-kappa B pathway in neonatal hypoxic-ischemic brain damage[J].Stroke,2008,39:2578-2586.
[8]Kaltschmidt B,Kaltschmidt C.NF-κB in the nervous system[J].Cold Spring Harb Perspect Biol,2010,2(1):a001271.
[9]Kaltschmidt B,Ndiaye D,Korte M,et al.NF-kappaB regulates spatial memory formation and synaptic plasticity through protein kinase A/CREB signaling[J].Mol Cell Biol,2006,26(8):2936-2946.

