缺氧/复氧对体外培养星形胶质细胞脑源性神经营养因子合成及释放的影响
肖 君,张 函,王 伟,谢敏杰,喻志源,何 丹
急性缺血性卒中是严重危害人类身心健康和生活质量的主要疾病之一,具有高发病率、高致残率、高病死率、低治愈率的特点[1]。因此,阐明缺血性卒中的复杂病理生理过程一直是神经科学领域研究的热点。星形胶质细胞是中枢神经系统数量最多的细胞,神经损伤后,星形胶质细胞活化,可能与神经损伤后神经营养因子表达量的增高有关[2]。脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)是神经营养因子家族(neurotrophic factors,NTFs)的一员[2,3],可通过调控神经元的存活和生长、影响突触可塑性[4]等途径,在脑卒中的康复过程中对神经元的存活、生长及功能维持起重要的作用[5]。本实验通过建立体外培养星形胶质细胞缺氧/复氧模型、检测缺氧/复氧条件下星形胶质细胞活力变化、并观察缺氧/复氧对星形胶质细胞BDNF合成及释放的影响,从而明确脑缺血与星形胶质细胞分泌功能之间的关系。
1 材料和方法
1.1 材料与试剂 实验动物:新生SD 乳鼠,由湖北省实验动物研究中心提供,许可证号:SCXK(鄂)2008-0005。主要试剂:DMEM/F12 培养基、胎牛血清、胰蛋白酶(美国Hyclone 公司),DAPI 及多聚赖氨酸(美国sigma 公司),多克隆GFAP 抗体(美国Neomarkers 公司),BDNF ELISA 试剂盒(美国Promega 公司),兔抗BDNF 多克隆抗体及羊抗兔HRP 二抗(英国Abcam 公司),GADPH 兔抗单克隆抗体(美国Santa Cruz Biotechnology 公司)。
1.2 方法
1.2.1 新生大鼠大脑皮质星形胶质细胞原代培养 无菌条件下取新生(3 d 内)SD 大鼠大脑,DMEM/F12 漂洗3 次,剔除软脑膜,取大脑皮质,眼科剪剪碎,巴氏管吹打为细胞悬液,经直径200 目筛网过滤,800 rpm 离心8 min,弃上清,全培养基(DMEM/F12+20%胎牛血清)重悬,接种于多聚赖氨酸(0.1 mg/ml)包被的培养瓶中,置于37 ℃、95%O2、5%CO2培养箱中培养;2~3 d 换一次液。细胞生长至融合时按1∶2~3 传代至新培养瓶培养。实验所用细胞为传2 代细胞。
1.2.2 实验分组及缺氧/复氧模型的建立 本实验分为两组:正常组(N)及缺氧/复氧组(H/R)。采用缺氧孵箱法,将含5%CO2的正常培养箱中培养达80%融合的星形胶质细胞置于94% N2、1%O2及5% CO2的缺氧培养箱培养环境中,缺氧不同时间点(3 h、6 h、12 h、24 h),再置于含5%CO2的正常培养箱继续培养相应复氧时间(0 h、12 h、24 h、48 h、72 h),建立星形胶质细胞缺氧/复氧模型。
1.2.3 缺氧/复氧对细胞活力的影响 通过MTT 法检测缺氧/复氧对细胞活力的影响,具体方法如下:将处于对数生长期的细胞经0.25%胰蛋白酶消化后调整细胞浓度至10×103/ml,接种至96 孔培养板,每孔160 μl;全培养基(DMEM/F12 培养液+20%胎牛血清)培养18 h~24 h,待细胞贴壁生长良好后开始MTT 检测;实验分3 组:N 组、H/R 组及空白调零组,每组10 孔,其中不接种细胞的作为空白调零组。分别在复氧后不同时间点,每孔加入40 μl MTT 液,37 ℃、95% O2、5% CO2培养箱中孵育2 h;吸走MTT 液,每孔加入150 μl DMSO 显色;轻微震荡后以空白调零组调零,酶标仪(460 nm 波长)测定各孔的吸光度值(OD 值)。
1.2.4 ELISA 检测BDNF 的分泌及合成 星形胶质细胞培养液离心10 min,取上清后,向孔板中加入RIPA 裂解液,冰上裂解15 min 后,离心取细胞裂解液,均置于-80 ℃冰箱保存。根据试剂盒的检测方法分别测量不同时间点上清及细胞裂解液中所含的BDNF。
1.2.5 Western blot 检测BNDF 的合成 将处于对数生长期的细胞经0.25%胰蛋白酶消化后按3×105/ml 的密度接种至10 cm 细胞培养皿;全培养基(DMEM/F12 培养液+20%胎牛血清)培养12~18 h,待细胞贴壁生长良好后开始实验;复氧后不同时间点提蛋白。BCA 法进行蛋白定量。将等量的蛋白标本加入SDS-PAGE 凝胶的加样孔,电泳90 min;然后电转至NC 膜;封闭液封闭2 h 后,加入兔抗BDNF 多克隆抗体(浓度),4 ℃孵育过夜;TBST 漂洗3 遍后,加入1∶5000 的羊抗兔HRP 二抗,孵育2 h;用Bio-Rad凝胶成像系统扫膜,Quantity One 4.62 进行定量分析,并以GADPH 为内参进行校正。
2 结果
2.1 缺氧/复氧对体外培养星形胶质细胞活力的影响 通过倒置显微镜,在缺氧不同时间点进行观察,随着缺氧时间的延长,星形胶质细胞胞体逐渐皱缩,培养皿内的漂浮细胞和细胞碎片逐渐增多。缺氧6 h 以内,星形胶质细胞形态与对照组无明显差异;而缺氧12 h 后,视野中见星形胶质细胞出现大量空泡,细胞破碎甚至死亡。为了排除细胞死亡对后续实验的影响,选择缺氧6 h 作为后续实验的干预时间。接着我们用MTT 法检测缺氧/复氧对星形胶质细胞细胞活力的影响。缺氧6 h 后复氧不同时间点的MTT OD 值与正常组相比无显著性差异(P>0.05),说明单纯缺氧复氧72 h 以内不会对体外培养星形胶质细胞的细胞活力产生明显影响(见表1)。
2.2 缺氧/复氧对体外培养星形胶质细胞BDNF释放的影响 我们检测了缺氧/复氧不同时间点体外培养星形胶质细胞BDNF 的分泌。结果表明,与正常对照组相比,缺氧/复氧组星形胶质细胞条件性培养液中的BDNF 含量虽然有所增加,但没有统计学差异(P>0.05),提示单纯缺氧/复氧情况下还不足以引起体外培养星形胶质细胞BDNF 分泌的显著变化。
2.3 缺氧/复氧对体外培养星形胶质细胞BDNF 合成的影响 缺氧6 h 复氧0 h、12 h、24 h 时,星形胶质细胞细胞裂解液中的BDNF 的含量较之正常培养组无明显增高(P>0.05),而在复氧48 h、72 h时,其BDNF 的含量分别是正常组的1.34 倍和1.46倍,均有显著增高(P<0.01)。因此我们运用Western blot 检测了缺氧/复氧48 h 及72 h 的BDNF 的蛋白含量,在复氧48 h、72 h 时,星形胶质细胞BDNF 蛋白的合成有显著增加(P<0.01),与ELISA 检测结果一致。
表1 缺氧/复氧不同时间点星形胶质细胞MTT OD 值的影响(±s,n=10)
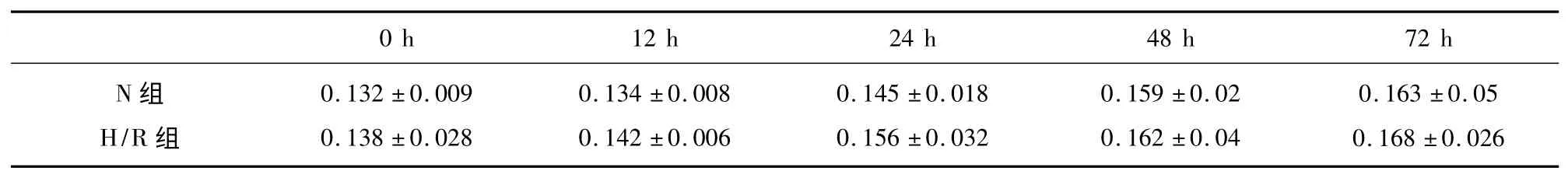
表1 缺氧/复氧不同时间点星形胶质细胞MTT OD 值的影响(±s,n=10)
3 讨论
在中枢神经系统中,星形胶质细胞是含量最为丰富的胶质细胞类型,对维持大脑功能的稳定发挥着重要作用[6]。经过数年的研究,已经证实了星形胶质细胞不仅对神经元起支持作用,而且还通过合成多种神经营养因子对中枢神经系统发育、神经递质的摄取、离子稳态及血脑屏障的维持等起到了支持和保护的作用[7]。BDNF 为神经营养因子家族的一员,调控神经元的存活和生长,影响突触可塑性,能够减少神经损伤的发生。因此在本实验中,通过研究星形胶质细胞在缺氧/复氧损伤时星形胶质细胞活化的变化以及对BDNF 合成和释放的影响,对脑缺血后神经功能保护的机制探讨具有重要的意义。
既往研究表明,多种病理情况下,如脑缺血缺氧、脊髓损伤、多发性硬化、帕金森氏病以及阿尔茨海默病等,BDNF 对神经元的存活起保护作用[2,8,9]。由此我们推测,脑缺氧时星形胶质细胞BDNF 表达量增加,BDNF 通过调控神经元的存活和生长,从而减少神经损伤的发生。
为了验证上述假说,我们研究了缺氧/复氧条件下体外培养星形胶质细胞活力变化及脑源性神经营养因子(BDNF)释放和表达的变化。我们首先运用MTT 法检测了缺氧/复氧条件下星形胶质细胞活力的变化,发现单纯缺氧6 h/复氧72 h 以内,星形胶质细胞的活力并无明显变化,提示本实验条件下的缺氧/复氧不会引起星形胶质细胞的死亡。在此基础上,我们分别通过ELISA 和Western blot 检测了缺氧/复氧不同时间点大鼠皮质星形胶质细胞BDNF的合成和释放量的变化,结果发现BDNF 的释放量无明显差异,但是其合成量在复氧48 h 之后较对照组增加。既往研究对此报道不一。Qu[10]等人研究报道,在短暂前额叶缺血时,BDNF 及其受体水平均上调,笔者认为这是一个自我保护的自适应机制,对损伤细胞的存活生长有重要意义。而另有研究又发现包括BDNF 在内的神经营养因子在缺血脑组织(糖氧剥夺1 h、再灌注24 h 后)中的表达量是下调的[11]。结果不尽相同,原因是由于实验条件、缺氧模型的差异、缺氧及再灌注的时间以及样本采集时间的不同所导致。
综上所述,我们的研究结果提示,单纯缺氧/复氧不足以引起体外培养星形胶质细胞BNDF 的释放改变以及细胞的活力变化,但是可影响BDNF 合成的增加,提示BDNF 在脑缺血缺氧情况下可能间接发挥了一定的脑保护作用,其机制有待进一步研究。
[1]Johnston SC,Mendis S,Mathers CD.Global variation in stroke burden and mortality:estimates from monitoring,surveillance,and modeling[J].Lancet Neurol,2009,8(4):345-354.
[2]Murer MG,Yan Q,Raisman-Vozari R.Brain-derived neurotrophic factor in the control human brain,and in Alzheimer's disease and Parkinson’s disease[J].Prog Neurobiol,2001,63(1):71-124.
[3]Thoenen H.The changing scene of neurotrophic factors[J].Trends Neurosci,1991,14(5):165-170.
[4]Ploughman M,Windle V,MacLellan CL,et al.Brain-derived neurotrophic factor contributes to recovery of skilled reaching after focal ischemia in rats[J].Stroke,2009,40(4):1490-1495.
[5]Han BH,Holtzman DM.BDNF protects the neonatal brain from hypoxic-ischemic injury in vivo via the ERK pathway[J].J Neurosci,2000,20(15):5775-5781.
[6]Fischer R,Wajant H,Kontermann R,et al.Astrocyte-specific activation of TNFR2 promotes oligodendrocyte maturation by secretion of leukemia inhibitory factor[J].Glia,2014,62(2):272-283.
[7]Ridet JL,Malhotra SK,Privat A,et al.Reactive astrocytes:cellular and molecular cues to biological function[J].Trends Neurosci,1997,20(12):570-577.
[8]Dougherty KD,Dreyfus CF,Black IB.Brain-derived neurotrophic factor in astrocytes,oligodendrocytes,and microglia/macrophages after spinal cord injury[J].Neurobiol Dis,2000,7(6):574-585.
[9]Stadelmann C,Kerschensteiner M,Misgeld T,et al.BDNF and gp145trkB in multiple sclerosis brain lesions:neuroprotective interactions between immune and neuronal cells[J].Brain,2002,25(1):75-85.
[10]Qu WS,Wang YH,Wang JP,et al.Galectin-1 enhances astrocytic BDNF production and improves functional outcome in rats following ischemia[J].Neurochem Res,2010,35(11):1716-1724.
[11]Chai L,Guo H,Li H,Wang S,et al.Scutellarin and caffeic acid ester fraction,active components of dengzhanxixin injection,upregulate neurotrophins synthesis and release in hypoxia/reoxygenation rat astrocytes[J].J Ethnopharmacol,2013,150(1):100-107.

