饲料添加多维对欧洲鳗鲡(Anguilla anguilla)生长性能、消化酶活性和免疫的影响*
卢 静 黎中宝, 陈 强 李文静 黄永春
(1.集美大学水产学院 厦门 361021;2.福建省海洋渔业资源与生态环境重点试验室 厦门 361021;3.厦门大学鳗鲡现代产业技术教育部工程研究中心 厦门 361021)
虽然集约化的养殖模式使水产养殖业得到迅速发展,然而高密度的养殖和水污染带来的负效应如水产动物自身免疫能力下降、各种病害频发以及激素类渔药的滥用,严重影响了养殖产量和经济效益。目前,通过各种途径开发研制低毒、高效、环保的饲料添加剂已成为调控鱼类营养和免疫机能的主要趋势,随着人们对鱼类营养免疫调控方式的更深入研究,利用新型抗病促长添加剂将会成为促进水产动物生长,提高鱼类免疫力极为有效的途径(黎中宝,2004)。
维生素作为一类低分子化合物,它不但是辅酶和辅基的组成部分参与新陈代谢过程而且能够充当抗氧化剂清除机体自由基发挥免疫功效(艾庆辉等,2007)。Shiau等(2001)报道,饲料中添加维生素E可显著提高罗非鱼的生长与斑点叉尾(何敏等,2009)、泥鳅(孙翰昌,2013)的研究结果一致。维生素C和维生素E联用不但能够减缓应激对金头鲷的损害(Ortunoet al,2003),而且能够显著提高斑点叉尾各种血液免疫指标值。以上研究表明饲料添加维生素对养殖动物具有显著的促生长作用,能够增强养殖动物抗应激、抗氧化能力及提高养殖动物免疫力,随着水产养殖业的深入发展,维生素作为一种绿色环保型饲料添加剂将受到更加广泛的应用。采用多种维生素混合制剂作为饲料添加剂,可以发挥维生素成分之间的协同作用,提升抗病、促长效果。
欧洲鳗鲡(Anguilla anguilla),属鳗鲡目(Anguilliformes)、鳗鲡科(Anguillae)、鳗鲡属(Anguilla)。其肉质鲜美、营养丰富、经济价值高,是国内外畅销的一种名贵鱼类。我国是世界上最大的鳗鲡生产国,前期主要以日本鳗鲡(Anguilla japonica)为养殖主体,直到20世纪90年代才开始逐渐增加欧洲鳗鲡的养殖比重,由于国内对欧洲鳗鲡的研究起步较晚,关于欧洲鳗鲡营养与养殖的研究主要集中于三大营养(王军霞等,1998)、生态学(李文静等,2009;郑伟刚等,2011)及利用一些中草药为主的促生长添加剂(吴德峰等,2001),关于欧洲鳗鲡饲料中应用多维添加剂的研究却鲜见报道。本研究初步尝试评估多维添加剂对欧洲鳗鲡生长性能、消化酶活性以及免疫力的影响,评价多维添加效果和适宜添加剂量,为多维添加剂在欧洲鳗鲡饲料中的应用提供理论依据。
1 材料与方法
1.1 试验用鱼及驯养
试验所用欧洲鳗鲡购于福建省龙岩市一养鳗场,选用同一批鱼苗于正式试验前将其暂养在集美大学海水试验场循环过滤桶(1200L)中两周。暂养期间每天2次饱食投喂基础饲料(8:00,18:00),使鳗苗逐渐适应试验饲料以及养殖环境。
1.2 试验设计及试验饲料
基础料采用福建天马饲料公司生产的鳗鲡黑仔料,其主要成分包括进口鱼粉、预糊化淀粉、酵母粉、鱼油、矿物质和维生素等(主要营养成分见表1)。选用的添加剂为上海艾魁英有限生物公司生产的华易鳗用多维(表2)。多维添加剂按照等差数列设计成比例并与基础饲料按逐级扩大法混匀,配制成对照组(0%)、Diet 1(0.25%)、Diet 2(0.50%)、Diet 3(0.75%)、Diet 4(1.00%)、Diet 5(1.25%)六种不同多维添加水平的饲料,于自封袋内-4°C冰箱保存备用。

表1 欧洲鳗鲡基础饲料主要营养成分(干重%)Tab.1 Proximate ingredients of basal diet for A.anguilla(dry weight %)
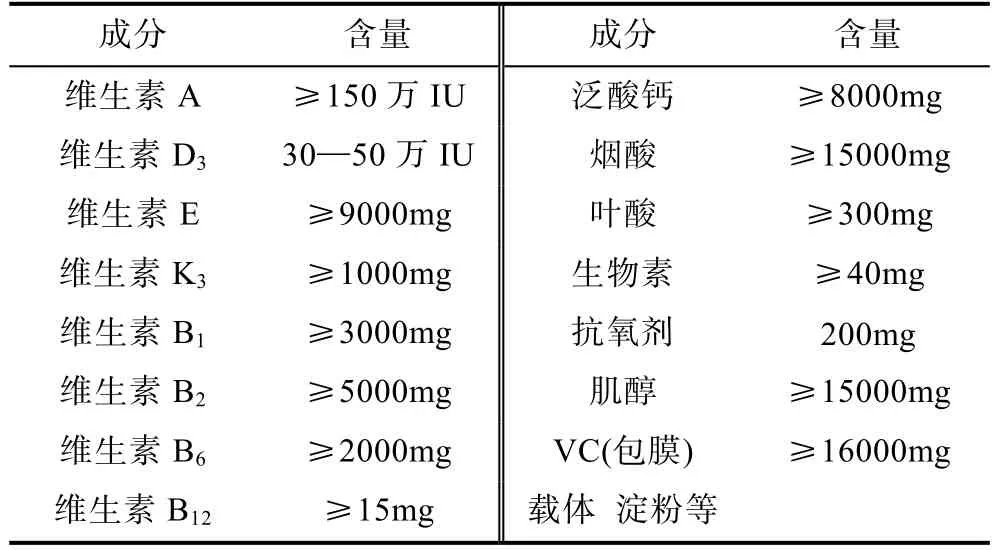
表2 多维添加剂配方及成分分析(含量/kg)Tab.2 Ingredients and proximate analysis of multivitamin additives(content/kg)
1.3 饲养管理
试验在设有循环过滤水系统的玻璃水族缸(120L)中进行,共设 6个处理组,每处理组 3个重复。经两周驯养后挑选出体格健壮、规格一致的幼鳗 540尾[初始体重为(5.93±0.02)g],随机分到 18个水族缸中。正式试验期间每天饱食投喂2次(8:00,18:00),每次投喂前分别按组制作团状饲料,待鱼摄食20min后吸去残饵和粪便并更换20%的曝气自来水。每天观察鳗鲡摄食与生长情况,记录死亡数和水温。每周测水质,试验期间水温为 18—22°C,溶解氧浓度>7.6mg/L,氨氮浓度<0.25mg/L,pH值为7.8—8.2。
1.4 样品采集及处理
饲喂 42d后,使鳗鲡禁食 24h,对每缸鱼进行整体称重和计数。每缸随机捞取5尾鱼测体质量和体长,再放入含有丁香酚的水桶中麻醉处理,分别用 1mL无菌注射器进行尾部静脉取血于 1.5mL灭菌离心管中3000r/min离心10min收集血清置–80°C冰箱保存用于分析血清生化指标。将采血后的鳗鲡进行解剖,取肝胰腺并称重用于计算肝体指数,分离出肠道后快速剔除其内溶物并放入液氮保存用于测定消化酶活性。另随机取3尾鱼保存于–20°C冰箱,用于测定全鱼体成分。
1.5 测定指标
1.5.1 生长指标分析 对试验鱼生长性能指标测定时所用公式为:
特定生长率SGR(%/d) = 100×(ln终末体质量-ln初始体质量)/试验天数
增重率 WG(%) = 100×(鱼体末重-鱼体初重)/鱼体初重;
成活率SR(%) = 100×(收获尾数/放养尾数);
肝体指数HSI(%) = 100×(肝胰脏重/鱼体质量);
肥满度CF(%) = 100×体质量(g) /体长3(cm3)。
鱼体称湿重后于 70°C烘干,绞碎之后待测体成分。鱼体成分和饲料基本成分均采用105°C常压烘箱干燥恒重法测水分;采用半微量凯氏定氮法(总氮×6.25)测粗蛋白;索氏抽提法(乙醚为抽提液)测粗脂肪;马福炉灼烧法(550°C)测灰分。
1.5.2 消化酶及血清免疫酶活性测定 将肠道称重,按 1︰9(V/W)加入 4°C的 0.85%生理盐水,在冰水浴中匀浆 5min。采用低温高速离心机(4°C,4000r/min,20min)对匀浆液进行离心,吸取上清于–80°C冰箱保存待测消化酶。肠道淀粉酶(AMS)、脂肪酶(LPS)、胰蛋白酶活性及血清总超氧化物歧化酶(T-SOD)、溶菌酶(LZM)、碱性磷酸酶(AKP)活性和血清总蛋白(TP)含量均采用南京建成生物工程研究所生产的相应试剂盒测定,操作步骤按照说明书进行。
1.5.3 统计方法 试验所得数据均用SPSS16.0统计软件进行单因素方差分析(One-way ANOVA),利用Duncan法进行多重比较,取显著水平P<0.05。试验所得数据均以平均数±标准误进行表示。
2 结果
2.1 多维对欧洲鳗鲡生长性能的影响
饲料中添加多维显著影响鳗鲡增重率和特定生长率(P<0.05)(表3)。6周生长试验结果表明,随多维添加浓度的上升,鳗鲡增重率和特定生长率呈先升后降的趋势,添加水平为0.75%的多维处理组增重率达最大,比对照组显著提高了 39.52%(P<0.05),但各处理组间增重率和特定生长率差异不显著(P>0.05)。各添加组鳗鲡的肝体指数比对照组略有下降,但无显著差异。各试验组肥满度均无显著差异(P>0.05),仅Diet 5(1.25%)组成活率为97.7%。
2.2 多维对鳗鲡鱼体成分的影响
表4的结果表明:饲料中添加多维能显著降低欧洲鳗鲡体鱼体中的水分同时提高灰分和粗蛋白含量(P<0.05)。Diet 3(0.75%)组鳗鲡鱼体水分含量相比对照组显著降低,同时该组鱼体灰分和粗蛋白含量显著高于对照组。鱼体粗脂肪含量随着多维浓度增大也有上升趋势但无显著差异(P>0.05)。
2.3 多维对鳗鲡肠道消化酶的影响
鳗鲡摄食试验料 6周后肠道中消化酶活性见表5,鳗鲡肠道中胰蛋白酶、淀粉酶和脂肪酶活性均得到显著提高(P<0.05)。所有添加多维处理组的鳗鲡肠道胰蛋白酶和淀粉酶活性均显著高于不添加多维的对照组,但各添加组间的胰蛋白酶活性均处于同一水平无显著差异,随着多维添加水平的增加淀粉酶和脂肪酶活性均呈先升高后下降趋势,多维添加水平为 1.00%时淀粉酶活性达最高,当多维添加量处于 0.75%—1.00%浓度范围时鳗鲡肠道脂肪酶活性达最高水平且显著高于对照组(P<0.05)。
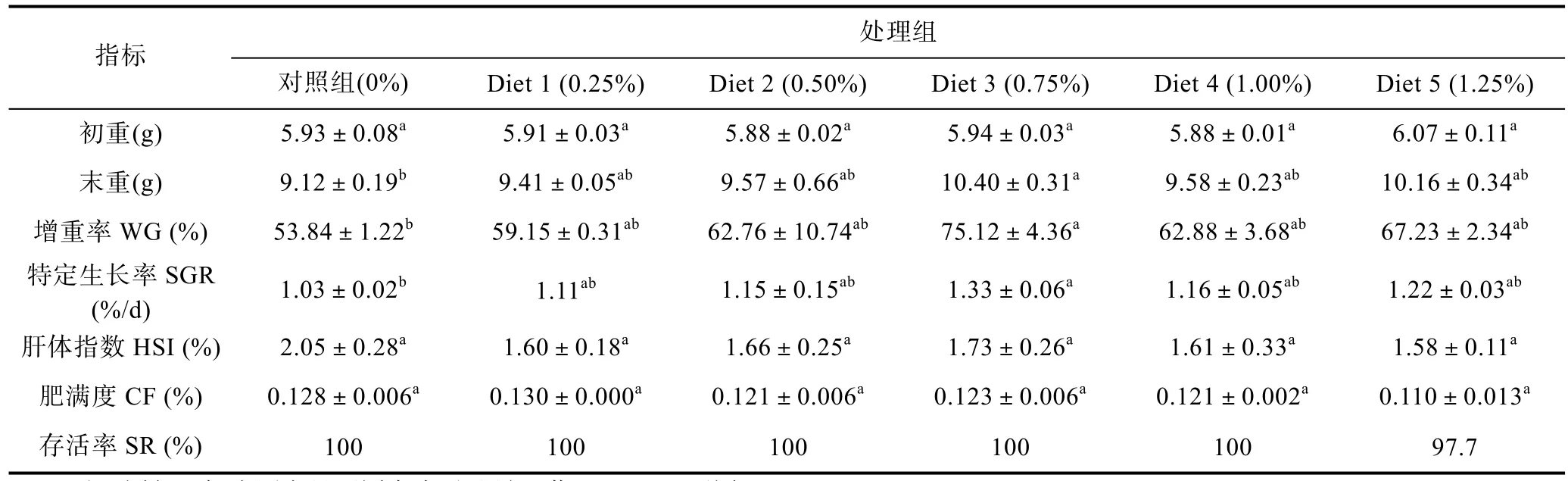
表3 多维添加剂对欧洲鳗鲡生长的影响Tab.3 Effects of multivitamin additives on the growth performance of A.anguilla

表4 多维添加剂对欧洲鳗鲡体成分的影响(湿重%)Tab.4 Effects of multivitamin additives on the whole-body composition of A.anguilla(wet weight %)
2.4 多维对鳗鲡血清中免疫酶的影响
试验选取超氧化物歧化酶(SOD)、溶菌酶(LZM)、碱性磷酸酶(AKP)活性和血清总蛋白浓度(TP)4个指标来反映饲料添加多维后欧洲鳗鲡免疫力的变化(表6)。饲料中添加多维使各处理组的免疫指标值均得到提高,各添加组鳗鲡血清 SOD活性随多维添加水平的升高而不断增加,Diet 5(1.25%)组鳗鲡SOD活性达到最大与对照、Diet1(0.25%)组形成显著差异(P<0.05)。Diet 1和Diet 3(0.75%)两组鳗鲡血清LZM活性在所有试验组中达到最高水平且与对照组、Diet4及Diet5形成显著差异(P<0.05)。Diet 3添加组鳗鲡血清AKP活性和血清TP含量均显著高于对照组(P<0.05),两指标变化趋于一致,但两种指标各添加组间活性均无显著差异(P>0.05)。
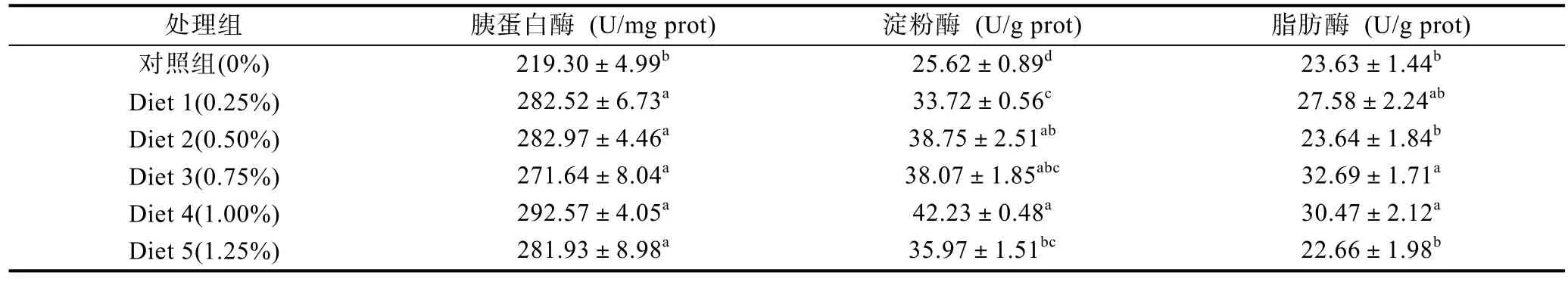
表5 多维添加剂对欧洲鳗鲡肠道消化酶活性的影响Tab.5 Effects of multivitamin additives on the activities of digestive enzymes of A.anguilla

表6 多维添加剂对欧洲鳗鲡免疫功能的影响Tab.6 Effects of multivitamin additives on the immune response of A.anguilla
3 讨论
3.1 多维对欧洲鳗鲡生长的影响
维生素对维持欧洲鳗鲡正常生长和健康具有重要意义,但有关鳗鲡维生素的营养需求研究较少,人们在生产实践中发现鳗鲡对维生素的需要量比其他温水性鱼类要高,鳗鲡对维生素缺乏相当敏感,很容易出现维生素缺乏症(王晓娟等,2010)。
目前,国内外众多研究证实饲料中添加维生素C能显著提高点带石斑鱼(Epinephelus coioides)(周歧存等,2005)、印度鲤(Labeo rohita)(Misraet al,2007)的增重率和特定生长率,适量维生素E可以促进幼建鲤(伍曦等,2011)、花鲈(周立斌等,2009)和条石鲷(Oplegnathus fasciatus)(Buenoet al,2010)的生长。本试验采用的多维添加剂将脂溶性维生素(A、D3、E及K)、水溶性维生素(B族维生素、VC、肌醇、烟酸及生物素)和载体等进行合理配伍,考虑到了多种维生素对鳗鲡的协同作用。林仕梅等(2003)报道饲料中添加四种 B族维生素具有提高异育银鲫的生长并明显改善其肉质的功效,而复合维生素制剂使试验组的鲤鱼生长速度比对照组快 6%—25%(路永吉等,1992)。在本试验条件下,基础饲料添加0.75%的多维显著提高了鳗鲡增重率和特定生长率,使鳗鲡增重率比对照组提高了 39.52%,远大于上述鲤鱼的 25%,这种差异可能与陆永吉等试验选用较大规格鲤鱼种(45g)和其试验天数较短(28d)有关。然而,超过0.75%的多维水平未能使鳗鲡增重得到持续增长反而略有下降,伍曦等(2011)也曾强调应注意维生素过量问题,超量维生素会引起代谢负担和毒害作用对动物生长产生不利(黎中宝,2004)。另外,本试验在基础饲料中添加多维不但降低了鳗鲡肝体指数而且改善了鳗鲡的营养组成,使鱼体水分含量下降,粗蛋白和灰分增加,这也是品质提高的表现,此结果与饲料中添加维生素 E投喂花鲈所得结果(周立斌等,2009)一致,这可能是由于多维能在鳗鲡脂肪、蛋白质代谢过程中起作用,需要进一步研究。综合考虑生长效应,本试验中多维的最适添加量为0.75%。
3.2 多维对欧洲鳗鲡肠道消化酶的影响
鱼类消化酶活性可以直接反应鱼类对营养物质的吸收利用,与鱼的生长关系密切,因此研究消化酶活性的影响具有重要意义。国内使用饲料添加剂研究鳗鲡消化酶并不多见,本试验在一定程度上弥补了类似研究的不足。42d的投喂试验表明,多维添加组欧洲鳗鲡肠道中胰蛋白酶活性均显著高于对照组,但各添加组间差异不显著,淀粉酶和脂肪酶活性随多维添加水平的提高呈先升高后下降的趋势,当多维添加水平为 0.75%—1.00%时三种酶活性均达最佳状态,这与维生素E对泥鳅、斑点叉尾、胆碱对黄鳝消化酶活性影响的研究结果类似(杨代勤等,2006;何敏等,2009;孙翰昌,2013)。这可能与某些维生素能够促进消化器官的生长发育从而提高鱼类消化能力有关(伍曦等,2011)。消化酶活性的提高增强了鳗鲡对营养物质消化吸收能力,加速鱼类对饲料蛋白质、脂肪等物质的沉积从而促进鱼的生长。总体来说,饲料添加多维后提高了鳗鲡的消化酶活性,有助于鳗鲡更好地吸收营养物质,结合经济效益和投喂效果建议多维在饲料中的添加水平为0.75%。
3.3 多维对欧洲鳗鲡血清免疫指标的影响
对于鱼类特殊的生存环境,非特异性免疫机制在抵抗病害方面比特异性免疫显得更为重要(Anderson,1992),血清中众多抗氧化酶在防止鱼类病菌感染,维持机体健康中扮演着重要角色。超氧化物歧化酶(SOD)作为动物机体内关键的抗氧化酶之一能够清除体内多余自由基(李敬玺等,2007),而溶菌酶(LZM)可以破坏消除侵入体内的异物,帮助鱼类远离病原微生物的感染(徐永平等,2011)。除上述两种极为常见的非特异性免疫酶外,Bigij等(1987)报道碱性磷酸酶(AKP)可通过水解作用破坏、改变有害异物的表面分子组成,加快吞噬细胞的吞噬作用及异物的降解,阻止病菌的繁殖从而能起到免疫防御作用。另外,血清总蛋白(TP)具有维持血液正常胶体渗透压,运输脂肪酸和保护机体的作用,能够间接反映机体非特异性免疫水平是重要的免疫指标(Polstraet al,1997;Hollandet al,2002)。因此,本研究选取SOD、LZM、AKP和TP四种具有代表性的非特异性免疫酶指标能够对鳗鲡非特异性免疫状况进行说明。
目前,国内外许多实验都印证了维生素的免疫效应,维生素C能提高印度鲤血清溶菌酶活性(Misraet al,2007),维生素A使凡纳滨对虾血清SOD活性呈上升趋势且溶菌酶活性得到显著提高(杨奇慧等,2007)。饲料中500mg/kg的维生素E水平则能提高条石鲷非特异性免疫力提高其抗弧菌能力(Buenoet al,2010)。本试验选取多种维生素混合制剂添加到基础饲料中,42d的投喂试验结果表明,各多维添加组鳗鲡血清 SOD活性随多维添加水平的升高不断增加,1.00%添加组鳗鲡 SOD活性达到最大。鳗鲡血清LZM、AKP和血清 TP则呈先升后降趋势,在多维0.75%添加浓度的试验组中达到最高水平。综合得出,0.75%的多维添加浓度使鳗鲡获得了较佳的血清免疫指标。关于维生素的免疫机制一般认为维生素C能清除机体产生的自由基,阻止不饱和脂肪酸过氧化维持细胞膜正常生理功能从而提高机体免疫力(Chieet al,2001)。B族维生素一方面可作为辅酶参与体内合成代谢,另一方面通过提高血清抗氧化酶和总铁结合力增强鱼类抗病能力(周小秋,2009)。同样,缺乏维生素E将导致鱼类细胞膜稳定性变差,抗氧化能力减弱等(Hardieet al,1990)。对于单种维生素免疫防御机制国内外研究较多,然而由于多种维生素之间存在错综复杂的相互关系,在动物体内的免疫防御机制还尚不清楚,需要进一步的研究。
综上所述,在本试验条件下,饲料中添加多维能够促进欧洲鳗鲡生长、提高鳗鲡肠道三种消化酶活性以及提高鳗鲡免疫力。结合多维抗病促长效果和经济效益得出,多维在鳗鲡基础配合饲料中的适宜添加水平为0.75%。
王军霞,王亚斌,王维娜等,1998.欧洲鳗鲡的营养研究进展.河北大学学报(自然科学版),18:59—63
王晓娟,艾春香,2010.鳗鲡的营养需求研究与配合饲料质量评价.饲料工业,31(10):47—51
艾庆辉,麦康森,2007.鱼类营养免疫研究进展.水生生物学报,31(3):425—430
伍 曦,罗 辉,冯 琳等,2011.高水平维生素E对幼建鲤生长性能和消化吸收功能的影响.动物营养学报,23(11):1938—1945
孙翰昌,2013.维生素E对泥鳅生长性能及消化酶活性的影响.中国饲料,(18):34—37
李文静,黎中宝,郑伟刚等,2009.三唑磷对 5种鳗鲡幼鳗的急性毒性实验.南方水产,5(6):13—18
李敬玺,刘继兰,王选年等,2007.超氧化物歧化酶研究和应用进展.动物医学进展,28(7):70—75
杨代勤,陈 芳,阮国良,2006.饲料中添加胆碱对黄鳝生长、组织脂肪含量及消化酶活性的影响.水产学报,30(5):677—682
杨奇慧,周歧存,迟淑艳等,2007.饲料中维生素 A水平对凡纳滨对虾生长、饲料利用、体组成成分及非特异性免疫反应的影响.动物营养学报,19(6):698—705
吴德峰,林树根,王寿昆等,2001.中草药饲料添加剂对欧鳗养殖效果的影响.福建农业大学学报,30(1):95—98
何 敏,汪开毓,张 宇等,2009.维生素 E对斑点叉尾生长性能和消化酶活性的影响.水产学报,33(2):288—294
林仕梅,曾 端,叶元土等,2003.异育银鲫对四种维生素需要量的研究.动物营养学报,15(3):43—47
周小秋,2009.B族维生素与鱼类消化吸收、免疫和抗氧化防御能力的关系研究进展.中国畜牧医学会2009年学术年会论文集(上册).中国河北石家庄,中国畜牧医学会:118—133
周立斌,张 伟,王安利等,2009.饲料维生素E对花鲈生长、组织中维生素 E积累量和免疫指标的影响.水产学报,33(1):95—102
周歧存,刘永坚,麦康森等,2005.维生素 C对点带石斑鱼(Epinephelus coioides)生长及组织中维生素C积累量的研究.海洋与湖沼,36(2):152—158
郑伟刚,黎中宝,李文静等,2011.Hg2+对5种鳗鲡白仔急性毒性影响的研究.南方水产科学,7(4):16—23
徐永平,汪婷婷,孙永欣等,2011.水产动物溶菌酶研究的最新进展.水产科学,30(5):307—310
路永吉,刘焕亮,1992.鲤饲料复合维生素添加剂的初步研究.大连水产学院学报,6(2):53—58
黎中宝,2004.饲料添加剂.厦门:厦门大学出版社,34
Anderson D P,1992.Immunostimulants,adjuvants,and vaccine carriers in fish:application to aquaculture.Annu Rev Fish Dis,2:281—307
Bigij J,Dulak J,Plytycz B,1987.Lymphoid organs ofGasterosteus aculeatus.Journal of Fish Biology,31:233—234
Bueno Galaz German,Kim Sung-Sam,Lee Kyeong-Jun,2010.Effects of different dietary Vitamin E levels on growth performance,non-specific immune responses,and disease resistance againstVibrio anguillarumin parrot fish(Oplegnathus fasciatus).Asian-Aust J Anim Sci,23(7):916—923
Chie L T,Hwang D F,2001.Effects of thermal stress and vitamin C in lipid perocidation and fatty acid composition in the liver of thornfishTerapon jarvua.Comp Biochem Physiol,128B:91—97
Hardie L J,Fletcher T C,Secombes C J,1990.The effect of vitamin E on the immune response of the Atlantic salmon(Salmo salarL.).Aquaculture,87:1—13
Holland M C,Lambris J D,2002.The complement system in teleosts.Fish and Shellfish Immunology,12(5):399—420
Misra C K,Das B K,Mukherjee S Cet al,2007.Effects of dietary vitamin C on immunity,growth and survival of Indian major carpLabeo rohita,fingerlings.Aquaculture Nutrition,13:35—44
Ortuno J,Esteban M A,Meseguer J,2003.The effect of dietary intake of vitamins C and E on the stress response of gilthead seabream(Sparus aurataL.).Fish& Shellfish Immunology,14(2):145—156
Polstra K,Bakker W W,Klok P Aet al,1997.Dephosphorylation of endotoxin by alkaline phosphatase in vivo.American Journal of Pathology,151(4):1163—1169
Shiau S,Shiau L F,2001.Re-evaluation of the vitamin E requirements of juvenile tilapia(Oreochromis niloticus×O.aureus).Animal Science,72(1):529—534

