注射用培美曲塞二钠与0.9%氯化钠注射液及不同pH的5%葡萄糖注射液的配伍稳定性考察
李博乐,郑 双,魏 淳,王 晨#(.天津医科大学肿瘤医院药学部/国家肿瘤临床医学研究中心/天津市肿瘤防治重点实验室,天津 300060;.天津医科大学药学院,天津 300070)
培美曲塞是一种多靶点叶酸拮抗药,目前已批准用于治疗非小细胞肺癌和恶性胸膜间皮瘤,临床应用广泛。该药属于细胞周期特异性抗代谢药,作用机制主要是抑制细胞胸腺嘧啶核苷酸及嘌呤核苷酸生物合成的关键性叶酸依赖性酶,从而杀伤S 期细胞,与很多药物联用具有协同细胞毒作用[1]。临床上该药多在静脉药物配置中心(PIVAS)配伍,从配伍到使用有一定时间间隔,如配伍不当,会产生一些不良反应,造成毒副作用增加,因此,研究该药的配伍稳定性十分有意义。目前,PIVAS多将培美曲塞与说明书建议采用的0.9%氯化钠注射液进行配伍。本文在研究该药与0.9%氯化钠注射液配伍稳定性基础上,为打破生理盐水易诱发心、肾功能不全患者产生心力衰竭或高钠血症的限制,扩大该药的应用范围,研究了不同温度、不同光照条件下,该药与不同pH[2]的5%葡萄糖注射液的配伍稳定性(未见文献报道),为临床合理用药提供实验依据。
1 材料
1.1 仪器
LC-20AB 高效液相色谱系统,包括SPD-20A 紫外检测器(日本Shimadzu公司);GWJ-4型智能微粒检测仪(天大天发科技有限公司);W-DA型药物稳定性检查仪(天津药典标准仪器厂);DELTA-320pH 计(瑞士Mettler-Toledo 公司);FAI604S 电子天平(德国Sartorius公司)。
1.2 药品与试剂
培美曲塞二钠对照品(江苏豪森药业股份有限公司,批号:40880RS100621);注射用培美曲塞二钠(江苏豪森药业股份有限公司,批号:101101);0.9%氯化钠注射液(中国大冢制药有限公司,规格:500 ml,批号:OJ77F5);5%葡萄糖注射液(中国大冢制药有限公司,规格:500 ml,批号:110615);甲醇为色谱纯,其他试剂为分析纯。
2 方法
2.1 试验溶液的配制
2.1.1 对照品溶液。准确称取培美曲塞二钠对照品10.00 mg,置于100 ml 量瓶中,加入流动相溶解并稀释至刻度,摇匀,得0.1 mg/ml 的对照品贮备液。精密量取贮备液5 ml 置于50 ml量瓶中,加流动相稀释定容,即得0.01 mg/ml的对照品溶液。
2.1.2 供试品溶液。准确称取注射用培美曲塞二钠10.34 mg(含10 mg 培美曲塞二钠)3 份,置于100 ml 量瓶中,分别加入pH 6.12的0.9%氯化钠注射液、pH 4.76的5%葡萄糖注射液及用标准氢氧化钠滴定液调节pH至6.50的5%葡萄糖注射液溶解并稀释至刻度,摇匀,得0.1 mg/ml的供试品贮备液。精密量取贮备液5 ml 置于50 ml 量瓶中,分别加上述溶液稀释定容,即得0.01 mg/ml的3份供试品溶液。
2.2 检测波长的选择
取0.01 mg/ml培美曲塞二钠对照品溶液,以流动相作为空白对照,在190~400 nm 波长范围内进行紫外扫描。结果显示,培美曲塞二钠在225 nm 波长处有最大吸收,确定225 nm为检测波长。
2.3 色谱条件[3]
色谱柱:Hypersil GOLD aQ(250 nm×4.6 nm,5 μm);流动相:0.01 mol/L 磷酸二氢钠溶液(用磷酸调至pH 4.0)-甲醇(7∶3);流速:1.0 ml/min;柱温:27 ℃;进样量:20 μl;检测波长:225 nm。
2.4 专属性试验
取“2.1.1”项下的0.01 mg/ml 对照品溶液,分别加入pH 6.12 的0.9%氯化钠注射液、pH 4.76 及pH 6.50 的5%葡萄糖注射液适量,按“2.3”项下色谱条件,分别进样20 μl测定,结果显示在此色谱条件下,培美曲塞与其他物质分离度良好,无杂质干扰。
2.5 标准曲线的制备
分别精密量取适当体积对照品贮备液至10 ml量瓶中,以流动相定容后混合均匀,得到对照品质量浓度分别为0.008、0.010、0.012、0.014、0.02 mg/ml 的系列溶液。每种质量浓度溶液进样3次,每次进样20 μl,计算平均值。以培美曲塞二钠对照品的质量浓度(c)对峰面积(A)进行线性回归,得回归方程为A=72 560 165c-39 882.11(r=0.999 9,n=3)。结果表明,培美曲塞二钠检测质量浓度在0.008~0.02 mg/ml范围内线性关系良好。
2.6 精密度试验
取0.010 mg/ml 的培美曲塞二钠对照品溶液连续进样6次[4],测定峰面积,RSD=0.75%,表明精密度良好。
2.7 加样回收率试验
准确称取培美曲塞二钠样品适量,按“2.1.2”项下方法分别溶于0.9%氯化钠注射液(pH 6.12)、5%葡萄糖注射液(pH 4.76及pH 6.50)制成质量浓度为0.01 mg/ml 的培美曲塞二钠样品溶液各9份,每份10 ml;分别加入0.008、0.010、0.012 mg/ml 的培美曲塞二钠对照品溶液各10 ml,作为80%、100%、120%3个质量浓度的加样回收率测试液,依法测定。结果显示,回收率在98%~102%范围内,RSD 均小于2%,表明本方法回收率符合规定,结果见表1。
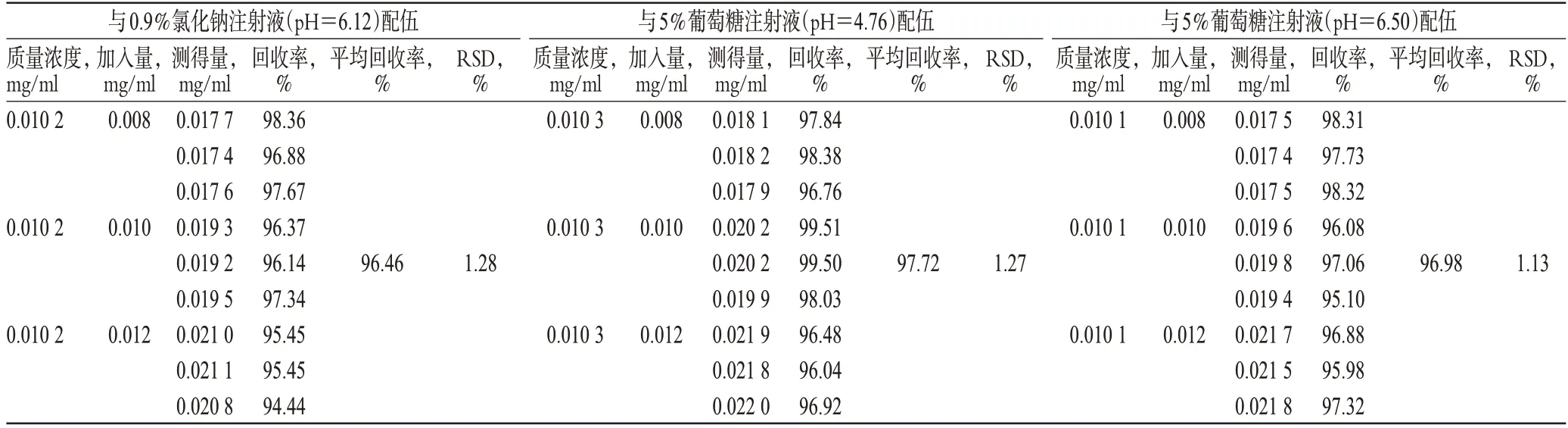
表1 加样回收率试验结果(n=3)Tab 1 Results of recovery tests(n=3)
2.8 配伍稳定性考察
采用临床常用浓度配制方法,准确称取注射用培美曲塞二钠样品适量,置于10 ml 量瓶中定容配制为2 mg/ml 的配伍液若干份,定容溶液分别采用0.9%氯化钠注射液(pH 6.12),5%葡萄糖注射液(pH 4.76)、5%葡萄糖注射液(pH 6.50)。配伍液分别在下列条件中放置:25 ℃光照条件、25 ℃避光条件、40 ℃光照条件、40 ℃避光条件。每种条件下均用上述3 种溶液进行定容,平行配制3 份(n=3)。在0、1、2、4、6、8、24、48 h分别检查外观,测定pH、不溶性微粒数及主药含量。
3 结果
3.1 外观
取洁净的20 ml具塞比色管若干支,分别加入上述配伍液各15 ml,在上述时间点分别检查外观变化。结果显示,48 h内,4 种放置条件下各配伍液均呈无色、澄清、透明,无沉淀生成和颜色变化。
3.2 pH
取各配伍液在上述时间点测定pH,结果显示,培美曲塞二钠与0.9%氯化钠注射液(pH 6.12)组成的配伍液pH 在0~6 h无明显变化,在>6~8 h内pH有所降低,>8~48 h内pH明显降低,4种放置条件下8 h相对0 h pH分别降低1.83%、2.81%、3.00%、2.84%;该药与5%葡萄糖注射液(pH 4.76)组成的配伍液pH 在0~8 h 无明显变化,在24~48 h 内pH 有所降低,4种放置条件下24 h 相对0 h pH 分别降低0.88%、1.77%、2.30%、3.52%;该药与5%葡萄糖注射液(pH 6.50)的配伍液pH在0~6 h无明显变化,在>6~8 h内pH有所降低,>8~48 h 内pH 明显降低,4 种放置条件下8 h 相对0 h pH 分别降低3.62%、3.15%、5.02%、6.70%,结果见表2。
3.3 不溶性微粒
取各配伍液在上述时间点按《中国药典》(2010年版)[4]微粒检测法中的光阻法检查微粒,结果显示,不溶性微粒在48 h内符合《中国药典》相关规定。
3.4 含量测定
取上述配伍液,分别稀释200 倍,按“2.3”项下色谱条件,分别进样,记录峰面积,以0 h 时含量为100%,观察不同时间点各配伍液中主药的百分含量。结果显示,培美曲塞二钠与0.9%氯化钠注射液组成的配伍液相对百分含量0~8 h无明显变化,各条件下8 h相对0 h含量变化均<2%;而24 h相对0 h已有含量变化超过2%的配伍液;24 h 4种放置条件下含量分别相对升高1.85%、2.23%、1.33%、2.30%。而该药与pH 4.76的5%葡萄糖注射液组成的配伍液同样在0~8 h无明显变化,各条件下8 h相对0 h含量变化均<2%;而24 h相对0 h的含量变化除25 ℃光照条件下,其余均超过2%;24 h 4种放置条件下分别含量相对升高1.96%、2.57%、2.16%、2.55%。该药与pH 6.50的5%葡萄糖注射液组成的配伍液在0~24 h 内无明显变化,>24~48 h相对百分含量变化超过2%;48 h 4种放置条件下,相对0 h含量分别升高2.51%、3.16%、2.15%、2.65%,见表3。

表2 不同条件下注射用培美曲塞二钠与不同注射液组成的配伍液pH值Tab 2 pH value of Pemetrexed disodium for injection in different solutions under different conditions

表3 不同配伍液中培美曲塞二钠的相对百分含量(n=3)Tab 3 The relative contents of pemetrexed disodium in different solution(n=3)
4 讨论
4.1 培美曲塞二钠在配伍液中的pH变化
该药本身的pH约为6.6~7.8,其与pH 6.12的0.9%氯化钠注射液、pH 4.76 和pH 6.50 的5%葡萄糖注射液组成的3 种配伍液pH 在0~6 h 无明显变化;而在>6~48 h pH 都发生了不同程度的降低,其原因可能为空气中CO2在溶液中溶解有关。同时,40 ℃条件下配伍液pH降低的程度较25 ℃条件下大,其原因可能为40 ℃条件使培美曲塞二钠结构中弱碱性的酰胺键断裂导致pH下降。
4.2 培美曲塞二钠在配伍液中的相对百分含量变化
该药与pH 6.12 的0.9%氯化钠注射液、pH 4.76 和6.50 的5%葡萄糖注射液组成的3 种配伍液中培美曲塞二钠的相对百分含量在0~8 h 无明显变化;而在>8~48 h 都发生了不同程度的升高,可能归因于培美曲塞二钠的结构中嘧啶环和吡咯环上的胺基给出电子,易被氧化,可能发生聚合反应而使含量略有上升,具体原因有待考察。而该药与pH 6.50 的5%葡萄糖注射液组成的配伍液在24 h相对百分含量的变化较另外两种配伍液小,可能与该pH下上述结构中的胺基给出电子难易程度增加有关。
4.3 培美曲塞二钠在配伍液中的外观检查与不溶性微粒检查
该药与上述3种注射液组成的配伍液在4种放置条件下,各配伍液均呈无色、澄清、透明,无沉淀生成和颜色变化,证明该药与pH 6.12 的0.9%氯化钠注射液,pH 4.76 和pH 6.50 的5%葡萄糖注射液组成的3 种配伍液无光敏性。同时,不同配伍液中微粒数符合《中国药典》(2010年版)相关规定。
综上所述,该药与pH 6.12的0.9%氯化钠注射液、pH 4.76和pH 6.50 的5%葡萄糖注射液组成的3 种配伍液在6 h 内稳定,外观、pH、不溶性微粒、相对含量等均符合《中国药典》(2010年版)规定,证实该药从配置完成到临床使用,不应超过该时间范围。建议厂家在有其他安全性试验基础上可增加该药与葡萄糖注射液的配伍应用。另外,pH 6.50为《中国药典》(2010年版)规定葡萄糖注射液pH的上限,在本试验中是人为调节的pH,为利于提高输液安全性,该pH 条件下试验数据为其他研究提供参考。
[1]李军,徐向英.培美曲塞在非小细胞肺癌治疗中的应用[J].国际肿瘤学杂志,2013,40(2):123.
[2]盛红彬.氨苄西林钠在不同pH值5%葡萄糖注射液中稳定性研究[J].中南药学,2011,13(8):587.
[3]贾佳,刘冬.高效液相色谱法测定注射用培美曲塞二钠的含量[J].医药导报,2010,29(8):1 080.
[4]国家药典委员会.中华人民共和国药典:二部[S].2010年版.北京:中国医药科技出版社,2010:附录ⅨC、ⅪⅩA.
- 中国药房的其它文章
- 我国2003-2012年药物经济学评价文献计量分析

