水解脱脂麦胚蛋白工艺及抗氧化性
陈美玲,胡 妍,韩 勇,邢 月,潘崇双,高 昂,陈 野*
(天津科技大学食品工程与生物技术学院,天津 300457)
水解脱脂麦胚蛋白工艺及抗氧化性
陈美玲,胡 妍,韩 勇,邢 月,潘崇双,高 昂,陈 野*
(天津科技大学食品工程与生物技术学院,天津 300457)
以水解度为指标,采用碱性蛋白酶对脱脂小麦胚芽蛋白进行水解,优化水解条件,当在pH 8、温度50 ℃、加酶量5.0%、底物质量分数4.0%的条件下,水解度达20.08%。优化条件下,得到水解物的溶解度、吸水性、吸油性分别为48.59%,13.77、9.86 g/100 g。热特性分析结果表明,水解物在200 ℃以内具有良好的热稳定性;通过红外光谱分析水解后的麦胚蛋白结构;由基质辅助激光解吸电离串级飞行时间质谱仪对分子质量的测定结果表明,水解物的分子质量大部分集中在2 000 D以下;体外抗氧化实验表明,水解物有良好的抗氧化性。
麦胚蛋白;碱性蛋白酶;水解;抗氧化
麦胚是小麦加工的副产物,其中蛋白质含量高达30%以上,而且麦胚蛋白是一种完全蛋白,含有人体必需的8 种氨基酸[1]。此外,麦胚还富含丰富的B族维生素、VE、不饱和脂肪酸、赖氨酸、膳食纤维和一些具有功能性的微量元素[2]。
麦胚蛋白在酶的作用下多肽链被打断,会释放出各种肽类化合物,使其功能性质得到改善,并具有一定的生物活性[3-4]。同时,张洪微[3]、殷微微[5]等研究表明,麦胚蛋白经过水解后的多肽具有抗氧化活性,多肽的抗氧化活性还同分子质量有关。
本研究采用碱性蛋白酶对脱脂麦胚蛋白进行水解,测其物理性质及水解物的结构,以及不同质量浓度麦胚蛋白水解物的抗氧化性,为开发具有抗氧化性的麦胚多肽产品提供基础。
1 材料与方法
1.1 材料与试剂
新鲜小麦胚芽 山东恒仁工贸有限公司;碱性蛋白酶、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH) 美国Sigma公司;其他试剂均为国产分析纯。
1.2 仪器与设备
RE-52AA旋转蒸发器 上海亚荣生化仪器厂;TDL-5-A离心机 上海安亭科学仪器厂;DSC-60A差示扫描量热仪 日本岛津有限公司;VECTOR 22傅里叶变换红外光谱仪、UltraFlex基质辅助激光解吸电离串级飞行时间质谱仪 布鲁克仪器公司。
1.3 方法
1.3.1 基本成分的测定
粗脂肪、蛋白质、灰分含量均采用国标[6-8]的方法测定。
1.3.2 脱脂麦胚蛋白的制备
将新鲜小麦胚芽置于烧杯中,试剂(正己烷-丙酮体积比3∶1)与样品按4∶1(mL/g)的比例搅拌均匀,置于35 ℃恒温水浴锅中浸提6 h脱脂[9],在此期间,多次搅动,低温烘干,测其脂肪含量。
用粉碎机将上述脱脂麦胚粉碎,全部过80 目筛,将细化的样品按料水比为1∶20(g/mL)搅拌均匀,用0.5 mol/L NaOH溶液调节pH 9.0,搅拌浸提30 min,将浸提液于3 500 r/min离心20 min,取上清液,然后用1.0 mol/L HCl溶液将上清液的pH值调至6.3,加入适量的淀粉酶[10],并置于60 ℃的水浴锅中,酶解至遇碘不呈蓝色为止,将溶液pH值调为4.0,然后离心去上清液,冷冻干燥得脱脂麦胚蛋白。
1.3.3 酶解条件的分析
利用碱性蛋白酶在不同的pH值、温度、加酶量(E/S)、底物质量分数等条件下测定脱脂麦胚蛋白的水解度。首先将脱脂麦胚蛋白与一定比例的水混合,然后搅拌均匀。设定不同的pH值(6、7、8、9、10),温度(40、45、50、55、60 ℃),加酶量(E/S)(3%、4%、5%、6%、7%)以及底物质量分数(2%、3%、4%、5%、6%),酶解3 h,沸水浴灭酶10 min,冷却后测其水解度(degree of hydrolysis,DH)[11],见式(1),剩余部分将其冷冻干燥备用。

式中:DH为蛋白水解度;H为水解断裂的肽键数目(由甲醛快速滴定法测定);Htot为总肽键数目(由凯氏定氮法测定)。
1.3.4 酶解脱脂麦胚蛋白正交试验设计
本研究在单因素试验的基础上,选择L9(34)的正交表,研究温度、pH值、加酶量(E/S)、底物质量分数对麦胚蛋白水解度的影响。

表1 酶解麦胚蛋白正交试验因素水平表Table 1 Factors and levels used in orthogonal array design for optimizing enzymatic hydrolysis of wheat germ protein
1.3.5 溶解度的测定
取0.5 g样品置于100 mL 烧杯中,加入30 mL蒸馏水,搅拌30 min,然后10 000×g离心15 min 后取上清液,采用微量凯氏定氮法测定上清液中蛋白质含量。溶解度表示为上清液中蛋白质含量与总蛋白质含量的比值[12]。
1.3.6 吸水性和吸油性的测定
取2.0 g的样品置于预先干燥好的离心管中(已知离心管的质量m),加入100 g蒸馏水,充分搅拌混匀后,静置30 min,然后以3 500 r/min的速度离心20 min,将离心管上层的水(大豆色拉油)全部舍弃,将离心管和沉淀的质量计为m2,吸水性、吸油性以每克样品吸附的水(油)的克数表示[13]。计算见公式(2):
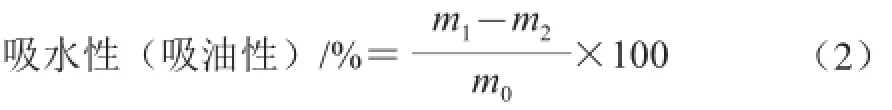
式中:m0为样品质量/g;m1为样品加离心管质量/g;m2为离心后离心管加沉淀质量/g。
1.3.7 热性能分析
称量2~4 mg麦胚蛋白和麦胚蛋白水解物,采用差示扫描量热仪对样品进行热稳定性分析。其中升温速率为5 ℃/min,测定温度范围为20~200 ℃。
1.3.8 傅里叶变换红外光谱分析
取0.8 mg麦胚蛋白水解物样品与200 mg纯KBr粉末置于玛瑙研钵内,将其研细混匀。置于模具中,在油压机上压片,加压到0.6~0.8 GPa后维持2 min。采用傅里叶红外变换光谱仪在4 000~400 cm-1波数范围内测定,扫描次数32 次,分辨率4 cm-1。
1.3.9 分子质量的测定
首先为何会出现沟通难题,最主要的还是双方所处的立场和利益是不同的。队长希望能够保证施工班组的完整性,不耽误施工进度,而班组人员考虑的是自己的公平利益,双方看问题的角度是有差距的。问题发生以后,我决定参与进来,沟通这个难题,是因为于公于私我都应该帮助解决问题,而且我是一个工程技术管理人员,比较有独立性和公正性,易于接受,利于解决问题。再者问题的解决也有利于我在队中工作的展开。问题解决中我始终是站在中立者的角度去询问双方看法,积极倾听,评估事实,分享观点。进而解决的问题,说明的双方的在的难题是差异而不是缺陷,确定的共识领域是都不能耽误正常的生产,最后能够共同探讨解决方案。
取质量浓度为0.2 mg/mL麦胚蛋白水解物,加入饱和基质间羟基肉桂酸,按1∶1的比例混合,取1 øL点靶,冷却自然干燥,待结晶析出,测定。本研究采用基质辅助激光解吸电离串级飞行时间质谱分析,质谱条件:激光器为Nd∶SmartbeamⅡ,加速电压为25 kV,采用反射正离子模式采集数据,PMF质量扫描范围m/z 700~3 500 D,激光频率2 000 Hz,激光激发500 次。
1.3.10 麦胚蛋白水解物抗氧化性的测定
1.3.1 0.1 还原力[14]
取1 mL质量浓度分别为0.1、0.5、1.0、5.0、10.0 mg/mL的脱脂麦胚蛋白酶解液,加入2.5 mL 0.01 mol/L(pH 6.6)的磷酸盐缓冲液,3.0 mL 1 g/mL的铁氰化钾溶液,置于50 ℃恒温水浴中反应20 min,再加入2.5 mL 10 g/mL的三氯乙酸,混合均匀后以3 500 r/min离心10 min,取3.0 mL上清液,并加入3.0 mL蒸馏水和0.5 mL 0.1 g/mL的FeCl3溶液,混合均匀,室温静置15 min后,在波长700 nm处测定吸光度A,以相同质量浓度的VC做对照实验。
1.3.1 0.2 DPPH自由基清除率[15]
取2.0 mL质量浓度分别为0.1、0.5、1.0、5.0、10.0 mg/mL的脱脂麦胚蛋白酶解液,加入1.0×10-4mol/L的DPPH自由基、无水乙醇溶液2.0 mL,混匀后在室温避光保存20 min,然后在4 000 r/min离心10 min,取上清液在517 nm波长处测定Ai,以相同质量浓度的VC做对照实验。DPPH自由基清除率计算见公式(3)。

式中:A0为未加样品DPPH自由基的吸光度;Ai为加样品DPPH自由基的吸光度;Aj为样品与无水乙醇的吸光度。
1.3.1 0.3 超氧阴离子自由基(O2-·)清除率[16]
向试管中分别加入1 mL 50 mmol/L的 Tris-HCl缓冲溶液,1.0 mL 1 mmol/L的EDTA溶液,然后再加入0.4 mL质量浓度分别为0.1、0.5、1.0、5.0、10.0 mg/mL的脱脂麦胚蛋白酶解液以及1.0 mL 0.4 mmol/L的邻苯三酚,混合均匀,静置反应10 min后,加入30 øL 100 mmol/L的二硫苏糖醇溶液终止反应,在波长325 nm处测定吸光度A,以相同质量浓度的VC做对照实验,样品对O2-·的清除能力,见公式(4)。

式中:A0为邻苯三酚与溶剂混合液的吸光度;A1为邻苯三酚与样品反应的吸光度;A2为样品与溶剂混合液的吸光度。
1.3.1 0.4 羟自由基(•OH)清除率[17]
依次向试管中加入1.0 mL 9.0 mmol/L的水杨酸-乙醇溶液,1.0 mL质量浓度分别为0.1、0.5、1.0、5.0、10.0 mg/mL的脱脂麦胚蛋白酶解液,1.0 mL 9 mmol/L的FeSO4溶液,5.0 mL蒸馏水,最后加10.0 mL 88 mmol/L的H2O2溶液启动反应,摇匀后于510 nm波长处测定吸光度Ai,取0.5 mL的蒸馏水代替Fe2+溶液所测得的吸光度为Aj,以相同质量浓度的VC做对照实验。•OH清除率计算见公式(5)。

2 结果与分析
2.1 基本成分的测定结果

表2 小麦胚芽及脱脂小麦胚芽的基本成分比较Table 2 Proximate composition comparison between wheat germ and defatted wheat germ %
小麦胚芽脱脂前后的基本成分进行比较分析,结果如表2所示,其中脂肪含量明显下降,说明脱脂效果比较好,去除大部分油脂,这将对麦胚蛋白的提取有较小的影响;此外蛋白质含量有较小的增加,原因可能是在脱脂处理过程中,使部分麦胚蛋白变性[18],导致蛋白含量增加的幅度不大。
2.2 酶解脱脂麦胚蛋白的单因素试验分析
2.2.1 温度对麦胚蛋白水解度的影响

图1 温度对水解度的影响Fig.1 Effect of temperature on the hydrolysis degree
由图1可知,水解度随温度的升高先增大后减少。温度为50 ℃时,水解度达到最大。不同酶的最适温度不同,在最适温度时,酶的活力最大,提高温度可以加快酶的反应速度,但是随着温度的不断升高,同时也加快了酶失活的速度,因此,水解温度选择为50 ℃左右。
2.2.2 pH值对麦胚蛋白水解度的影响
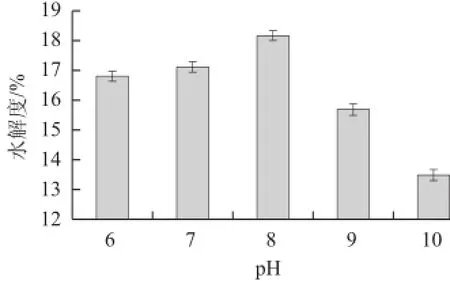
图2 pH值对水解度的影响Fig.2 Effect of pH on the hydrolysis degree
由图2可知,麦胚蛋白的水解度随着pH值的不断增大而呈现出先增大后减小的趋势,当pH值为8时酶解效果最佳,水解度最大。不同酶的最适pH值不同,在最适pH值附近时,酶活力最大,而在偏酸或偏碱的条件下,会导致部分蛋白酶变性失活,因为pH值能够破坏酶的空间结构,改变酶的构象,以致酶活性降低甚至丧失。因此,通过实验得出水解麦胚蛋白较佳的pH值为8。
2.2.3 加酶量(E/S)对麦胚蛋白水解度的影响
由图3可知,随着加酶量的增加,水解度逐渐增加,最后趋于平缓,当加酶量为6.0%时,水解度为19.02%。加酶量在3.0%~6.0%范围内时,随着加酶量的增加,水解度逐渐上升,当加酶量超出3.0%~6.0%范围之后,水解度趋于平缓,原因是酶质量浓度逐渐增大并趋于饱和,酶解速度也趋于饱和,继续增大加酶量对反应速率影响不大,因此加酶量选择在6.0%左右。

图3 加酶量对水解度的影响Fig.3 Effect of enzyme amount on the hydrolysis degree
2.2.4 底物质量分数对麦胚蛋白水解度的影响

图4 底物质量分数对水解度的影响Fig.4 Effect of substrate concentration on the hydrolysis degree
由图4可知,随着底物质量分数的增大,麦胚蛋白的水解度先上升后逐渐下降,4.0%时达到最大。原因是当底物质量分数较低时,酶分子与底物的碰撞机会增多,加快了反应的进行,随着底物质量分数的增加,反应体系的底物质量浓度逐渐加大,减少了酶和底物的碰撞机会,水解反应受到抑制。因此,底物质量分数选择为4.0 %左右。
2.3 酶解脱脂麦胚蛋白的条件优化结果分析

表3 酶解麦胚蛋白正交试验设计及结果Table 3 Orthogonal array design with experimental results for optimizing the hydrolysis of wheat germ protein
由表3极差R的大小可知,4 个因素对麦胚蛋白水解度影响大小依次为:B>A>D>C,即pH值对麦胚蛋白水解度影响最大,其次是温度、底物质量分数、加酶量(E/S)。结果可知,最适水解条件为:温度为50 ℃、pH 8、加酶量5.0%、底物质量分数4.0%。由上述正交试验得到的最适水解条件进行验证实验,得到的水解度为20.08%。
2.4 麦胚蛋白水解物物理性质的结果分析由表4可知,麦胚蛋白水解物的溶解度明显高于麦胚蛋白,这是由于水解过程中,肽键断裂,产生了更多带电基团(即NH3+和COO-),它们增强了蛋白质和水的相互作用,在多肽之间产生更强的静电斥力[19]。因此,水解物在水溶液中有较好的溶解性。水解物的吸水性和吸油性也高于麦胚蛋白,原因可能是由于多肽链的断裂会使部分氨基和羧基释放,导致亲水性增强,此外,蛋白经酶解后大量的基团外露,极性基团增加,形成氢键的能力增强,因此酶解后的麦胚蛋白结合水的能力增加[20],导致吸水性增强;另一方面,可能是由于蛋白分子结构改变,分子中疏水基团暴露,致使水解物的吸油性也有所提高。

表4 麦胚蛋白水解物物理性质分析Table 4 Physical properties of wheat germ protein hydrolysate
2.5 热性能分析
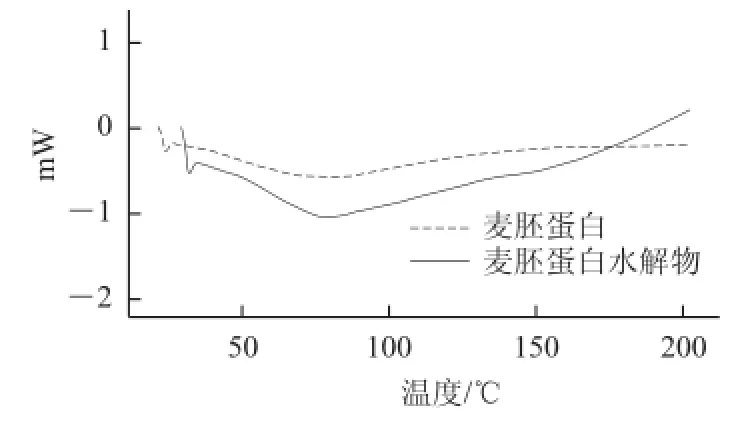
图5 热性能分析Fig.5 Analysis of thermal properties
从图5可以看出,脱脂麦胚蛋白与经酶解处理后的麦胚蛋白差示扫描量热曲线趋势基本一致。在70~100 ℃之间表现为脱脂麦胚蛋白水分的吸热,其后至200 ℃没有出现吸放热的变化,说明在200 ℃之前经酶解处理过的麦胚蛋白具有良好的热稳定性。
2.6 傅里叶变换红外光谱扫描
从图6可以看到,在1 079.894 cm-1存在着明显的红外吸收,这是—OH基团伸缩峰的特征吸收频率。波数在1 242.109 cm-1的吸收带,是由于C—N键(酰胺Ⅲ,也具有双键性质)的伸缩振动和N—H键(酰胺Ⅱ)的面内弯曲振动共同引起的。1 550 cm-1频率附近的谱带,对应着蛋白质特征性N—H键(酰胺Ⅱ)的角变形,即面内弯曲振动模式。由于水分子的影响,可能会造成酰胺Ⅱ带的位置在1 530~1 570 cm-1范围内发生移动[21]。酶解后麦胚蛋白的酰胺Ⅱ带出现在1 547.112 cm-1;波数在1 651.442 cm-1的特征吸收为酰胺Ⅰ谱带,是由C=O键的伸缩振动即轴向变形关联的特征性强吸收带。有相关资料显示,该振动模式的频率是由肽链构型决定的,而一般不受肽链侧基的影响[22]。此外,1 399.122 cm-1和1 451.931 cm-1波数下出现的明显特征吸收峰—OH面内弯曲以及2 026.105 cm-1NH3的伸缩振动。
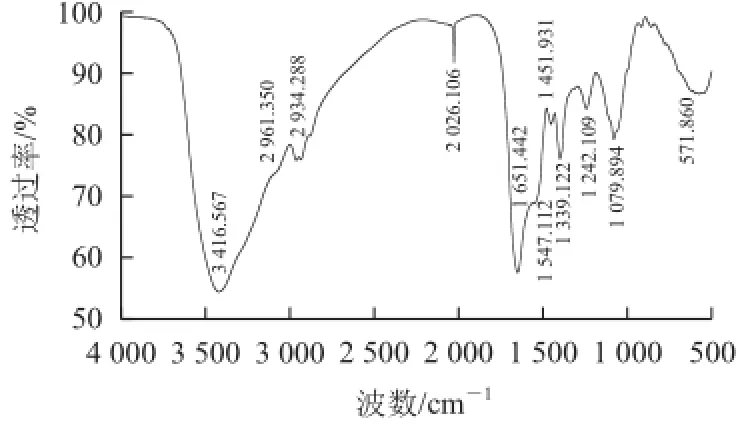
图6 酶解后的小麦胚芽蛋白傅里叶变换红外扫描图谱Fig.6 FT-IR spectrum of wheat germ protein hydrolysate
2.7 基质辅助激光解吸电离串级飞行时间质谱测定分子质量
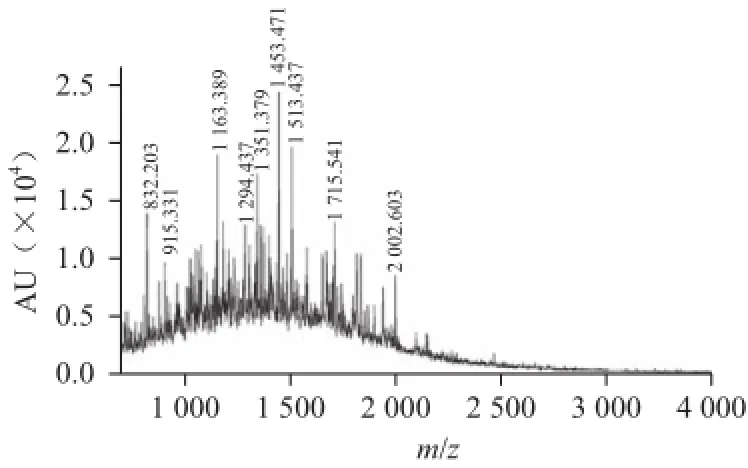
图7 基质辅助激光解吸电离串级飞行时间质谱仪对分子质量的测定Fig.7 MALDI-TOF-TOF mass spectrometry showing the molecular weight distribution
由图7可知,麦胚蛋白水解物的分子质量大部分集中在2 000 D以下。麦胚蛋白水解物的抗氧化性与其分子质量大小密切相关,原因可能是短肽中含有某些能与自由基反应的供氢基团,短肽只有在适当分子质量时,这些特殊的供氢基团才能得到最大的暴露,充分与自由基作用,此时才具有较强的抗氧化活性。
2.8 酶解麦胚蛋白水解物的抗氧化活性
2.8.1 还原力
抗氧化剂是通过自身的还原作用,释放出电子而清除自由基,还原力越强,抗氧化性越强。样品的抗氧化性能使铁氰化钾的Fe3+还原成Fe2+,Fe2+进一步在和FeCl3的反应下生成在700 nm波长处有最大吸光度的普鲁士蓝,因此测定700 nm波长处吸光度的高低可以间接反映抗氧化剂的还原能力大小,吸光度越大,还原能力越强[23]。如图8所示,在质量浓度为0.1~10 mg/mL 的范围内,麦胚蛋白水解物的还原力先趋于平缓后逐渐增大,但低于VC。

图8 麦胚蛋白水解物的还原力Fig.8 Reducing power of wheat germ protein hydrolysate
2.8.2 DPPH自由基清除率
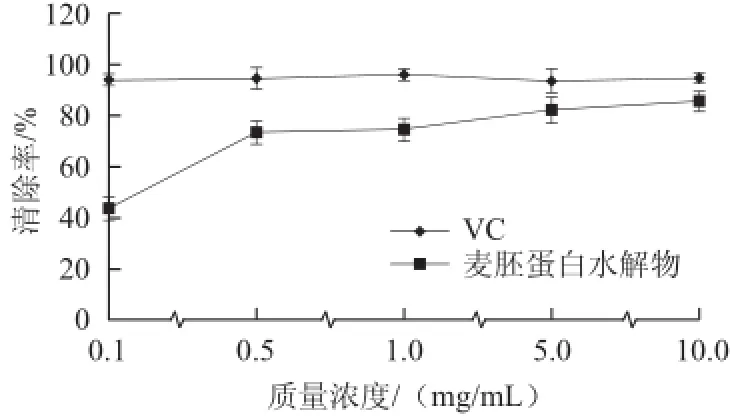
图9 麦胚蛋白水解物对DPPH自由基的清除率Fig.9 Scavenging activity of wheat germ protein hydrolysate against DPPH free radical
从图9可以看出,在质量浓度为0.1~10 mg/mL的范围内,酶解麦胚蛋白水解物的DPPH自由基清除率随质量浓度的增大而增大。在质量浓度为10 mg/mL时,VC和麦胚蛋白水解物的清除率分别为94.3%和84.5%,说明麦胚蛋白水解物对DPPH自由基有一定的清除能力。
2.8.3 O2-·清除率

图10 麦胚蛋白水解物对的清除率Fig.10 Scavenging activity of wheat germ protein hydrolysate against superoxide anion free radical
O2-·作为生物体所产生的一种自由基,大量研究证明,自由基的作用与生物衰老、某些疾病的发病机制密切相关[24]。麦胚蛋白水解物对O2-·的清除率,结果如10所示。在质量浓度为 0.1~10 mg/mL的范围内,VC和麦胚蛋白水解物对O2-·的清除率随质量浓度的增大而增大。在质量浓度为10 mg/mL时,VC和麦胚蛋白水解物的清除率分别为89.9%和67.0%,麦胚蛋白水解物的清除率低于VC。
2.8.4 ·OH清除率

图11 麦胚蛋白水解物对・OH的清除率Fig.11 Scavenging activity of wheat germ protein hydrolysate against hydroxyl free radical
·OH是体内最活泼的活性氧自由基,会导致许多病理变化。本研究采用麦胚蛋白水解物对Fenton体系产生的·OH清除率的体外实验进行测定[25]。由图11可知,在质量浓度为0.1~10 mg/mL的范围内,酶解麦胚蛋白水解物的·OH清除率随质量浓度的增大而增大。在质量浓度为 10 mg/mL时,VC和麦胚蛋白水解物的清除率分别为99.0%和81.2%,麦胚蛋白水解物对·OH的清除能力略低于VC。
3 结 论
本研究以脱脂麦胚蛋白为原料,研究了水解脱脂麦胚蛋白的生产工艺,在pH8、温度50 ℃、加酶量(E/S)5.0%、底物质量分数4.0%的条件下,水解度达20.08%,为工业化生产提供了基础数据,同时对水解物的溶解度、吸水性、吸油性进行了分析,结果均高于麦胚蛋白,抗氧化实验证明水解后的麦胚蛋白具有较高的抗氧化性,对于工业化生产应用具有良好的前景。
[1] 刘婉, 张婷, 张艳贞, 等. 小麦胚芽蛋白的研究进展[J]. 生物技术通报, 2010(12): 12-15.
[2] 王尚玉, 李庆龙. 小麦胚芽的开发利用[J]. 武汉工业学院学报, 2004, 23(2): 28-31.
[3] 张洪微, 杨铭铎, 吴莹莹, 等. 黑龙江小麦麦胚多肽的制备及抗氧化功能研究Ⅱ.超滤法精制抗氧化麦胚多肽工艺条件的优化[J]. 食品科学, 2011, 32(14): 171-175.
[4] 刘玉德, 曹雁平. 生物蛋白肽的开发研究展望[J]. 食品科学, 2002, 23(8): 319-320.
[5] 殷微微, 任学坤, 郝为民, 等. 小麦胚芽蛋白酶解物体内抗氧化性评价[J]. 粮食与油脂, 2011(5): 23-25.
[6] GB 5009.6—2003 食品中脂肪的测定[S]. 北京: 中国标准出版社, 2003.
[7] GB 5009.5—2010 食品中蛋白质的测定[S]. 北京: 中国标准出版社, 2010.
[8] GB 5009.4—2010 食品中灰分的测定[S]. 北京: 中国标准出版社, 2010.
[9] 樊永华. 小麦胚芽油的提取及应用[J]. 食品工程, 2012(4): 11-13.
[10] 辛志宏, 吴守一, 马海乐. α-淀粉酶法制备小麦胚芽蛋白的研究[J].食品科技, 2003, 28(6): 11-12.
[11] 张丽萍, 毛晶晶, 刁静静, 等. 麦胚蛋白水解物抗氧化活性及其作用模式[J]. 中国粮油学报, 2012, 27(6): 14-19.
[12] 王一, 曾茂茂, 何志勇, 等. 不同来源蛋白酶水解对大豆分离蛋白分散性及溶解性的影响[J]. 食品工业科技, 2012, 33(17): 67-69; 72.
[13] 潘晶. 棉籽粕蛋白的制备及其性质研究[D]. 无锡: 江南大学, 2010.
[14] WANG Jianguo, WANG Yutang, LIU Xuebo, et al. Free radical scavenging and immunomodulatory activities of Ganoderma lucidum polysaccharides derivatives[J]. Carbohydrate Polymers, 2013, 91(1): 33-38.
[15] OYAIZ M. Studies on products of browning reactions: antioxidative activities of products of browning reaction prepared from glucosamine[J]. Japanese Journal of Nutrition, 1986, 44: 307-315.
[16] 静天玉, 赵晓瑜. 用终止剂改进超氧化物歧化酶邻苯三酚测活法[J].生物化学与生物物理进展, 1995, 22(l): 84-86.
[17] 鲁晓翔, 唐津忠. 紫背天葵中总黄酮的提取及其抗氧化性研究[J].食品科学, 2007, 28(4): 145-148.
[18] 朱科学, 周惠明, 朱振. 灭酶和脱脂预处理对麦胚分离蛋白理化性质和营养价值的影响[J]. 食品科学, 2008, 29(1): 31-35.
[19] 吴晓红, 刘经纬, 郑月明, 等. 红松种子水溶性蛋白吸水性、吸油性及溶解性的研究[J]. 食品工业科技, 2010, 31(9): 140-143.
[20] 侯瑶. 大豆浓缩蛋白和分离蛋白限制酶解及功能性变化[D]. 哈尔滨: 东北农业大学, 2008.
[21] RAMACHANDRAN G X, CHANDRASEKHARAN R. Interchain hydrogen bonds via bound water molecules in the collagen triple helix[J]. Biopolymers, 1968, 6(11): 1649-1658.
[22] DOYLE B B, BENDIT E G. Infrared spectroscopy of collagen and collagen-like polypeptides[J]. Biopolymers, 1975, 14(5): 937-957.
[23] 姚亚平, 曹炜, 陈卫军, 等. 不同品种荞麦提取物抗氧化作用的研究[J].食品科学, 2006, 27(11): 49-52.
[24] 殷微微, 任学坤, 赵永焕. 麦胚蛋白酶解物清除自由基及抗氧化作用的研究[J]. 食品工业, 2010, 31(3): 4-6.
[25] 严善春, 初众. 洋虫成虫脱脂蛋白酶解液的抗氧化作用[J]. 昆虫学报, 2008, 51(8): 804-809.
Hydrolysis and Antioxidant Activity of Defatted Wheat Germ Protein
CHEN Mei-ling, HU Yan, HAN Yong, XING Yue, PAN Chong-shuang, GAO Ang, CHEN Ye*
(College of Food Engineering and Biotechnology, Tianjin University of Science and Technology, Tianjin 300457, China)
The enzymatic hydrolysis of defatted wheat germ protein using alkaline protease was optimized based on degree of hydrolysis (DH). When the hydrolysis was carried out at 50 ℃ with an initial pH of 8 at an enzyme dose of 5.0% and a substrate concentration of 4.0%, a DH value up to 20.08% was achieved and the hydrolysate showed 48.59%, 13.77 and 9.86 g/100 g for solubility, hygroscopicity and oil absorption, respectively. Thermal analysis indicated that the hydrolysate was thermally stable at a temperature below 200 ℃, and its structure was analyzed as well by infrared spectroscopy. MALDI-TOF-TOF mass spectrometry data showed that the molecular weights of its major components were below 2 000 D. Meanwhile, this hydrolysate exhibited a strong antioxidant activity in vitro.
wheat germ protein; alkaline protease; hydrolysis; antioxidant activity
TS209
A
1002-6630(2014)22-0109-06
10.7506/spkx1002-6630-201422020
2014-06-04
陈美玲(1988—),女,硕士,研究方向为农产品加工及贮藏工程。E-mail:meiling_ch@163.com
*通信作者:陈野(1968—),男,教授,博士,研究方向为农产品加工及贮藏工程。E-mail:chenye@tust.edu.cn

