水杨酸处理对冷藏杏果实细胞超微结构的影响
朱 璇,侯媛媛,贾 燕,赵亚婷,马 玄
(1.新疆农业大学食品科学与药学学院,新疆 乌鲁木齐 830052;2.新疆果品加工与保鲜工程技术研究中心,新疆 乌鲁木齐 830052;3.天津科技大学食品工程与生物技术学院,天津 300457)
水杨酸处理对冷藏杏果实细胞超微结构的影响
朱 璇1,2,侯媛媛1,贾 燕3,赵亚婷1,马 玄1
(1.新疆农业大学食品科学与药学学院,新疆 乌鲁木齐 830052;2.新疆果品加工与保鲜工程技术研究中心,新疆 乌鲁木齐 830052;3.天津科技大学食品工程与生物技术学院,天津 300457)
以新疆塞买提杏为试验材料,研究了0 ℃冷藏条件下0.01 g/L的水杨酸(salicylic acid,SA)处理对杏果实不同贮藏时期超微结构的影响,以蒸馏水处理的杏果实作为对照。结果表明,在冷藏初期,SA处理杏果实和对照杏果实的细胞排列整齐,细胞壁及各细胞器结构完整,二者细胞超微结构无明显差异。从冷藏第28天开始,杏果实细胞超微结构发生明显变化,出现细胞器变形或降解,细胞间隙大,细胞内含物减少,细胞空腔化等现象。与对照杏果实相比,SA处理能在一定程度上减轻低温对杏果实细胞壁、叶绿体、线粒体等的破坏,维持细胞器和膜系统的完整性,从而提高杏果实冷藏期间的抗冷性。
水杨酸;杏;冷藏;超微结构
杏(Prunus armeniacal)属蔷薇科,李属,呼吸跃变型果实。新疆是我国杏的最大产地,据统计,2012年杏果实产量为160.7万 t,是疆内水果总量的26.72%[1]。赛买提杏是新疆南疆地区杏果中栽种,后熟期短,采后常温下几天内果实变软、品质、风味迅速下降并出现腐烂[2]。低温贮藏可以降低杏果实的呼吸代谢,延缓后熟衰老,抑制微生物生长,从而达到延长贮藏期的目的[3]。但杏果实对低温环境敏感,在低温条件下贮藏较长的时间易引起冷害。冷害会导致果蔬抗病性和耐藏性下降,降低产品质量,造成食用品质劣变和腐烂,极大地限制了低温技术的应用。因此,如何增强杏果采后对低温的耐受性,控制冷害的发生,已成为杏贮运产业中亟待解决的问题。
近年来,已有大量研究表明甜柿[4]、油桃[5]、梅果[6]、树莓[7]、黄瓜[8]、蟠桃[9]等果实的后熟衰老及耐贮性与其超微结构的变化有着密切的关系,但有关超微结构与果实冷害关系的报道甚少。目前,有关低温贮藏对果蔬超微结构影响的研究主要集中在枇杷[10]、桃[11]等果实上,而针对杏果实冷藏期间细胞超微结构变化的研究还未见相关报道。
水杨酸(salicylic acid,SA)是一种广泛存在的植物内源小分子酚类化合物,其参与植物体内多种重要的生理生化过程,它的生理作用广泛表现在对植物生长、发育、成熟和衰老等生理过程的调控以及抗病、抗热、抗冷、抗盐、抗旱等抗逆反应的诱导过程中[12]。SA已被广泛应用于增强采后果蔬贮藏的抗冷性[13-15],但已有的研究主要集中于SA处理对果实冷害的控制效果和果实品质的影响,而从细胞超微结构角度进行研究的报道较少。本实验研究了SA处理对采后杏果实冷藏期间超微结构的影响,探讨了杏果实细胞超微结构与果实冷害的关系,一方面为杏果实贮藏期间冷害的防治提供新思路,另一方面可以为SA增强采后果实低温耐受性提供理论依据。
1 材料与方法
1.1 材料与试剂
“塞买提”杏于2013年6月采自库车县乌恰镇杏果园;柠檬酸铅 北京达济科仪科技有限公司;丙酮(分析纯) 天津永晟精细化工有限公司。
1.2 仪器与设备
DHG-9123A型电热恒温鼓风干燥箱 上海一恒科技有限公司;UC6超薄切片机 德国徕卡(Leica)仪器有限公司;JEOLM-1230型透射电镜 日本电子株式会社;醋酸双氧铀 上海谱振生物科技有限公司。
1.3 方法
1.3.1 原料处理
“塞买提”杏果实采收后12 h内运回新疆农业大学果蔬采后生理研究室,剔除伤、病果,选择大小、果色均匀、成熟度相近的杏果实进行处理。在预实验的基础上,筛选出SA对杏果实冷害控制最佳的作用质量浓度为0.01 g/L。然后将杏果实用0.01 g/L的SA以减压方式处理(将杏果实浸入到溶液中抽气,至压力降到0.05 MPa时保持2 min,然后放入空气,让果实在常压下继续浸泡8 min,取出自然晾干),处理后的杏果实置于温度为0 ℃、90%~95%相对湿度的冷库贮藏,以蒸馏水处理的杏果实作为对照,每处理用果10 kg,重复3 次。
1.3.2 电镜样品制备
从采收当天开始取样作为原始样,入库第7天取一次样,第28天取一次样,冷藏第49天取一次样,共取样4 次。每次取样的部位保持一致。用双面刀片将果皮下2 mm左右果肉切成1 mm×1 mm×2 mm大小的块,用体积分数为2.5%戊二醛(0.1 mol/L磷酸缓冲液配制,pH 7.2)在4 ℃条件下前固定14 h。磷酸缓冲液(pH 7.2)冲洗后,用体积分数为1%饿酸(0.1 mol/L磷酸缓冲液配制,pH 7.2)4 ℃条件下后固定2 h,用磷酸缓冲再次冲洗。用体积分数30%、50%、70%、80%、90%、95%乙醇和纯丙酮梯度脱水,丙酮过度。环氧树脂Epon-812渗透包埋,30 ℃温箱聚合12 h 后,60 ℃聚合48 h。用UC6超薄切片机切成60 nm的薄片,再经醋酸双氧铀及柠檬酸铅染色,JEOLM-1230型透射电镜观察拍照。
2 结果与分析
2.1 杏果实采收当天透射电镜观察

CW.细胞壁;M.线粒体;ML.中胶层;Chl.叶绿体;V.液泡;OD.嗜锇颗粒;N.细胞核;CC.细胞内含物;ER.内质网。A.细胞整体结构,细胞壁、细胞核、叶绿体、线粒体、内质网等细胞器清晰可见,结构完整(×12 000);B.细胞壁、中胶层、液泡等结构完整,线粒体丰富(×12 000);C.细胞大液泡化,细胞质及其内含物紧贴细胞壁(×6 000);D.叶绿体基质片层和基粒片层结构完整,嗜锇颗粒明显(×30 000)。
通过透射电镜观察采收时杏果实细胞的超微结构,如图1所示。采收当天杏果实细胞结构正常,排列整齐,各细胞器完好,质膜清晰;细胞壁结构完整,中胶层电子密度较高,初生壁紧贴中胶层两边;细胞明显液泡化,液泡占细胞体积的90%以上,液泡的膜结构完整;细胞质被挤压成一薄层紧贴细胞壁,内含大量结构完整、嵴发达的线粒体;叶绿体结构完整,基质片层与基粒片层紧密相连,整个叶绿体内部呈现一个完整的膜系统结构,嗜锇颗粒分散其中,双层膜结构完整;个别细胞内容物丰富,细胞核清晰可见,核仁明显,粗面内质网及核糖体游离在细胞质中。
2.2 杏果实冷藏第7天透射电镜观察


图2 冷藏第7天杏果实超微结构Fig.2 Ultrastructure of apricot fruits after 7 days of cold storage
透射电镜观察表明,杏果实在冷藏的第7天时细胞间隙略有增大,大多数细胞器基本无损,排列有序,与采收时细胞结构无明显差异。杏果实细胞叶绿体完整,部分细胞内少数叶绿体膜开始产生小泡,线粒体数量多,液泡完整,细胞质内含物紧贴细胞壁,细胞壁结构整齐,未发现降解;细胞质中有丰富的大小囊泡,液泡单层膜和细胞质膜还未受损。由图2可知,杏果实冷藏的第7天,SA处理组和对照组果实细胞超微结构均未出现异常,且处理组与对照组之间没有明显差别。
2.3 杏果实冷藏第28天透射电镜观察
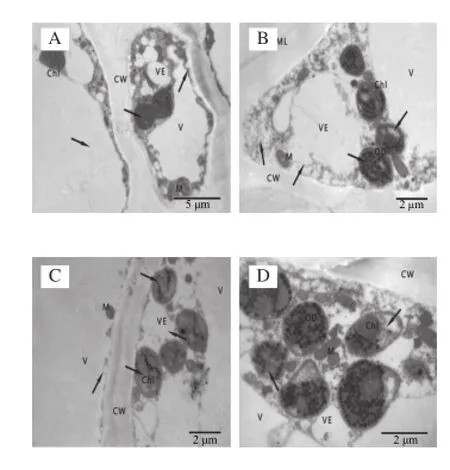

图3 冷藏第28天杏果实超微结构Fig.3 Ultrastructure of apricot fruits after 28 days of cold storage
杏果实在冷藏第28天细胞超微结构发生明显变化。SA处理的杏果实细胞排列整齐,细胞壁厚度均匀,细胞壁中胶层略有降解,细胞内囊泡增多并膨胀;大多数叶绿体开始趋于圆形,基粒片层和基质片层结构模糊,出现空泡现象,叶绿体双层膜结构模糊或消失,嗜锇颗粒数目增多;线粒体数量较多,个别线粒体内出现小泡,内脊结构模糊,数量减少,液泡结构完整。而对照杏果实细胞间隙较大,细胞壁弯曲变形,细胞质膜皱缩,细胞质明显减少,细胞器排列混乱,囊泡化较严重;叶绿体双层膜结构破坏,有明显的空泡化现象,基质片层和基粒片层结构消失;线粒体结构模糊且数量减少,内部呈小泡化;液泡膜折皱,胞间层开始分解,形成絮状空隙。由此可知,采后冷藏28 d对照杏果实细胞已经出现冷害迹象,各细胞器结构明显破坏,而SA处理的杏果实仍能较好维持细胞结构的完整。
2.4 杏果实冷藏第49天透射电镜观察
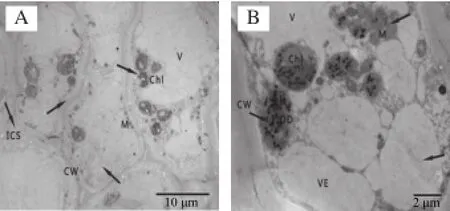
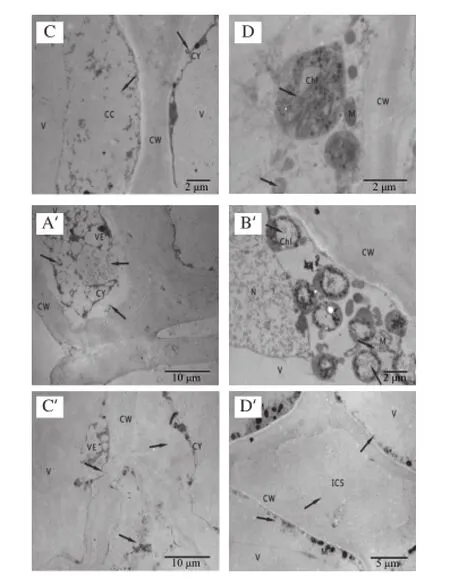
图4 冷藏第49天杏果实超微结构Fig.4 Ultrastructure of apricot fruits after 49 days of cold storage
到冷藏后期,SA处理组和对照组杏果实细胞超微结构均发生不同程度的变化。对照组杏果实细胞已严重破坏,细胞壁严重弯曲变形并呈絮状,有的已经解体;细胞内容物减少,质壁分离严重,囊泡明显增多,聚集在细胞壁一侧,中胶层降解消失;细胞间隙进一步增大,大量细胞器降解,液泡及细胞器内含物与原生质互溶,叶绿体和线粒体出现严重空腔现象,双层膜结构消失。SA处理的杏果实细胞也已经变形,细胞壁弯曲,细胞质明显减少,且出现质壁分离现象,细胞质膜折皱,细胞内区域化破坏,浑浊不清,细胞器排列紊乱,胞内出现絮状沉淀物质堆积。细胞内囊泡膨胀,叶绿体、线粒体等细胞器仍清晰可见,个别已经变形、解体,细胞器双层膜模糊或消失。但与对照杏果实相比细胞损伤程度较轻。
3 结 论
细胞是生物体最基本的结构和功能单位。超微结构的变化是果实发育成熟及衰老过程的重要特征[16-17],也可以反映果实的生理状态。在低温贮藏条件下,能引起植物生理代谢变化的同时,组织细胞的超微结构也会发生一系列相应变化,这些变化会导致组织细胞功能衰弱甚至丧失,进一步加速了细胞衰老与解体[18-19]。简令成等[20-21]指出冷害会引起植物组织各类细胞器结构的变化,其破坏程度取决于植物品种的抗寒性。
电镜观察结果表明,刚采收及冷藏前期的杏果实细胞壁厚度均匀,中胶层明显;叶绿体、线粒体、液泡、细胞核等细胞器结构完整;细胞质膜完好,没有破裂现象的发生。冷藏的第28天,对照杏果实中胶层逐渐降解消失,细胞壁轻微变形,质壁分离,叶绿体趋于圆形并开始膨大,嗜锇颗粒数目增多,体积变大。随着贮藏时间的延长,杏果实细胞及其超微结构严重破坏,细胞发生质壁分离,细胞壁弯曲变形甚至解体,细胞膜结构遭到破坏,叶绿体、线粒体等细胞器发生变形或解体,液泡及细胞器内含物与原生质互溶,细胞空腔化,这与牛先前等[22]对枇杷和郑丽梅等[23]对黄瓜幼苗的研究结果相似。与对照杏果实相比,SA处理杏果实能较好的维持细胞超微结构的完整性,显著减轻杏果实细胞的损伤程度。与电镜观察的微观结果对应,在宏观表现上,本实验结果表明,贮藏28 d后,对照杏果实果面呈现大面积水浸斑,硬度增加,出汁率下降,果肉褐变等明显的冷害症状伴[24];而SA处理果实推迟7 d发生冷害,且冷害症状较对照果实轻,这与在冷藏的中期和后期的电镜观察结果相吻合。
植物冷害的自由基伤害学说指出,冷敏植物遭受冷胁迫后,活性氧自由基大量积累,导致活性氧代谢平衡失调,就会引起膜脂的不饱和键发生过氧化作用,细胞膜系统受到伤害是早期的冷害症状之一,最终加剧果实冷害的发生[25]。侯媛媛等[26]的研究表明,SA处理可减轻杏果实的冷害程度与SA能防止杏果实冷藏期间过高的氧化伤害,维持杏果实活性氧代谢平衡密切相关。本研究认为,SA处理能有效减轻杏果实冷藏期间质膜的伤害程度,与SA能防止杏果实冷藏期间过高的氧化伤害,维持杏果实活性氧代谢平衡是密切相关的。
综上所述,杏果实冷藏期间细胞壁及各类细胞器的破坏可能是果实发生冷害的微观表现。电镜观察表明,SA处理能较好的维持杏果实细胞壁、叶绿体、线粒体、液泡等细胞结构的完整性,这与SA能减轻杏果实冷藏期间冷害的发生、延长杏果实贮藏时间密切相关。
[1] 新疆维吾尔自治区统计局. 新疆统计年鉴[M]. 北京: 中国统计出版社, 2012: 338.
[2] 刘路, 张谦, 赵晓梅. 不同处理对赛买提杏贮藏保鲜效果的影响[J].食品工业, 2010(2): 32-34.
[3] 胡花丽, 李鹏霞, 梁丽松, 等. 不同贮藏温度及成熟度对杏果实品质的影响[J]. 食品与发酵工业, 2009, 35(1): 182-185.
[4] 胡芳, 马书尚, 张继澍, 等. 1-甲基环丙烯对“富有”甜柿采后主要生理指标及细胞超微结构的影响[J]. 园艺学报, 2009, 36(4): 487-492.
[5] 孙芳娟, 韩明玉, 赵彩萍, 等. 不同采收成熟度油桃贮藏效果及果肉细胞超微结构观察[J]. 果树学报, 2009, 26(4): 450-455.
[6] 陆胜民, 席玙芳. 采后处理对梅果细胞超微结构的影响[J]. 食品科学, 2001, 22(6): 62-65.
[7] 谢娟. 红树莓果实生长发育规律及超微结构研究[D]. 哈尔滨: 东北农业大学, 2011.
[8] 王志坤, 秦智伟, 李艳秋, 等. 黄瓜果实衰老过程中果皮超微结构的变化[J]. 园艺学报, 2007, 34(4): 889-894.
[9] 李银, 张辉, 骆建敏, 等. 蟠桃果实发育成熟过程中果肉细胞超微结构的变化[J]. 新疆农业科学, 2011, 48(6): 1006-1010.
[10] 郑国华, 张贺英. 不同低温胁迫下早钟6号枇杷幼果细胞超微结构的变化[J]. 福建农林大学学报: 自然科学版, 2008, 37(5): 473-476.
[11] 段玉权, 冯双庆, 赵玉梅, 等. 1-甲基环丙烯处理对冷藏桃果肉细胞超微结构的影响[J]. 中国农业科学, 2004, 37(12): 2039-2042.
[12] MOHAMMADREZA A, MORTEZA S. Impact of salicylic acid on post harvest physiology of horticultural crops[J]. Trends in Food Science and Technology, 2010(21): 502-509.
[13] AGHDAM S M, ASGHARI R M, MORADBEyGI H, et al. Effect of postharvest salicylic acid treatment on reducing chilling injury in tomato fruit[J]. Romanian Biotechnological Letters, 2012, 17(4): 7466-7473.
[14] CAO Shifeng, HU Zhichao, ZHENG yonghua, et al. Synergistic effect of heat treatment and salicylic acid on alleviating internal browning in cold-stored peach fruit[J]. Postharvest Biology and Technology, 2010, 58(2): 93-97.
[15] SAyyARI M, BABALAR M, KALANTARI S, et al. Effect of salicylic acid treatment on reducing chilling injury in stored pomegranates[J]. Postharvest Biology and Technology, 2009, 53(3): 152-154.
[16] 任亚梅, 刘兴华, 徐春雅, 等. 不同处理对猕猴桃采后生理和细胞超微结构的影响[J]. 农业工程学报, 2008, 24(7): 217-221.
[17] 张大鹏, 李氓, 王毅. 葡萄果实发育过程中果肉细胞超微结构的观察[J]. 植物学报, 1997, 39(5): 389-396.
[18] 杜艳, 喻方圆, 甘习华, 等. 低温胁迫下两种七叶树苗木超微结构的比较[J]. 南京林业大学学报, 2007, 31(3): 111-114.
[19] POMEROy M K, ANDREWS C J. Ultrastructural changes in shoot apex cells of winter wheat seedlings during ice encasement[J]. Canadian Journal of Botany, 1978, 56: 786-794.
[20] 简令成. 植物抗寒机理研究的新进展[J]. 植物学通报, 1992, 9(3): 17-22.
[21] 简令成, 李积宏, 李本湘, 等. 杨树顶芽细胞内质网与其他膜系统的结构联系及其在休眠过程中的变化[J]. 植物学报, 2000, 42(8): 803-810.
[22] 牛先前, 郑国华, 林秀香, 等. 冰核细菌对低温胁迫下枇杷幼果中果肉超微结构的影响[J]. 中国生态农业学报, 2011, 19(2): 388-393.
[23] 郑丽梅, 司龙亭, 韩贵超. 低温处理对不同耐寒性黄瓜幼苗叶片超微结构的影响[J]. 西北农业学报, 2009, 18(4): 276-279.
[24] 袁洁, 朱璇, 逄焕明, 等. 外源水杨酸处理对采后杏果实抗冷性的影响[J]. 食品工业科技, 2013, 34(22): 349-351.
[25] MITTLER R. Oxidative stress, antioxidants and stress tolerance[J]. Trends in Plant Science, 2002, 7(9): 405-410.
[26] 侯媛媛, 朱璇, 王英, 等. 水杨酸处理对杏果实冷害及活性氧代谢的影响[J]. 食品科学, 2014, 35(4): 1-5.
Effect of Salicylic Acid Treatment on Cell Ultrastructure of Apricot Fruit during Cold Storage
ZHU Xuan1,2, HOU Yuan-yuan1, JIA Yan3, ZHAO Ya-ting1, MA Xuan1
(1. College of Food Science and Pharmacy, Xinjiang Agricultural University, Ürümqi 830052, China; 2. Xinjiang Engineering Technology Research Center of Fruit Processing and Preservation, Ürümqi 830052, China; 3. College of Food Engineering and Biotechnology, Tianjin University of Science and Technology, Tianjin 300457, China)
Saimaiti apricot fruits from Xinjiang, China were treated with 0.01 g/L salicylic acid (SA) and then stored at 0 ℃to explore the change of cell ultrastructure during different cold storage periods, and distilled water was used as control treatment. The results showed that the cell ultrastructure of apricot fruits from the salicylic acid treatment and control groups had no significant difference in neat rows or the integrity of cell wall structure and cell organelles based on cell arrangement. The ultrastructure of apricot fruits changed obviously after the 28thday, which suggested that cell organelles was deformed or dissolved. Meanwhile, enlarged intercellular gap junctions, decreased cell contents, and empty cell cavity were observed. Compared with the control, the improvement of cold resistance in apricot fruits by SA treatment was closely related to the alleviated damage of cell wall, chloroplast and mitochondria, and the integrality maintenance of cell organelles and membrane system.
salicylic acid; apricot fruit; cold storage; ultrastructure
TS255.3
A
1002-6630(2014)14-0193-05
10.7506/spkx1002-6630-201414038
2014-01-03
国家自然科学基金地区科学基金项目(31260408);公益性行业(农业)科研专项(201303075)
朱璇(1971—),女,副教授,博士,研究方向为果蔬贮藏与保鲜。E-mail:13999877961@126.com
——可作为磷酸盐库再利用!

