内生真菌拟茎点霉B3产漆酶分批发酵动力学
周 骏,梅艳珍,杨 腾,康 莉,戴志东,戴传超,*
(1.南京师范大学生命科学学院,江苏省微生物与功能基因组学重点实验室,江苏省微生物资源产业化工程技术研究中心,江苏 南京 210023;2.尚德生物科技有限公司,江苏 丹阳 212300)
内生真菌拟茎点霉B3产漆酶分批发酵动力学
周 骏1,梅艳珍1,杨 腾1,康 莉1,戴志东2,戴传超1,*
(1.南京师范大学生命科学学院,江苏省微生物与功能基因组学重点实验室,江苏省微生物资源产业化工程技术研究中心,江苏 南京 210023;2.尚德生物科技有限公司,江苏 丹阳 212300)
通过建立内生真菌拟茎点霉(Phomopsis liquidambari)B3产漆酶分批发酵动力学模型,发现B3菌漆酶生成与菌体生长呈现部分生长偶联型。应用MATLAB软件将实验数据与符合B3菌菌体生长的Logistic模型、漆酶生成的Luedeking-Piret模型和基质消耗的Luedeking-Piret-Like模型进行非线性拟合,求得最优参数估计值和发酵动力学模型。分析动力学模型的拟合曲线,发现模型的曲线与实验值能较好地拟合。验证实验表明模型计算值与实验值的偏差大部分都低于10%,说明该动力学模型能很好地描述B3菌的实际发酵情况。
内生真菌;拟茎点霉;漆酶;分批发酵;动力学模型
漆酶(laccase,EC 1.10.3.2)属于分布范围广泛的蓝色多铜氧化酶家族[1],它能够催化许多不同的底物,比如酚类和苯胺类化合物[2-3],其活性部位含有4 个铜离子,通过铜离子的协同作用氧化底物,并催化氧还原成水[4]。由于漆酶具有较高非特异性氧化能力、无需辅酶因子可直接利用氧作为电子受体等特点[5],使其被广泛应用于食品、纺织、造纸等许多工业生产领域[6]。例如在食品工业,漆酶可以用于食品工业废水的生物修复、饮料(葡萄酒、啤酒和果汁)加工、抗坏血酸测定、甜菜果胶凝胶化、烘烤,以及作为生物传感器改善食品感官参数等。漆酶可以在不需要高投入的情况下,提高生产率、改善食物产品的质量,并且具有技术温和的优势[7-8]。
前期研究发现内生真菌拟茎点霉B3有产漆酶的功能[9-11]。为了扩大发酵规模、获得更大的漆酶产量,对这个重要的非线性生物过程建立发酵动力学模型成为必然。发酵动力学模型能够对微生物过程进行预测和控制,非常有助于减少一个生物过程从经验探讨到扩大规模生产失败的风险。因此,建立发酵动力学模型及对其进行实验验证通常作为离开实验室进行试点扩大,转变为商业生产之前的必要步骤[12]。
本实验旨在研究B3菌发酵过程中菌体生长、漆酶生成和基质消耗的内在规律,建立B3菌发酵产漆酶的动力学模型,并评价该模型对B3菌发酵产漆酶的拟合度,为进一步放大实验和工业化生产提供参考。
1 材料与方法
1.1 菌种
内生真菌拟茎点霉(Phomopsis liquidambari)B3为实验室保藏菌株,分离自大戟科重阳木(Bischofia polycarpa)茎内皮[13]。
1.2 试剂与仪器
2,2’-连氮基-双-(3-乙基苯并二氢噻唑啉-6-磺酸)(2,2’-azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS) 西格玛奥德里奇(上海)贸易有限公司;其他相关试剂均为分析纯,购自国药集团化学试剂有限公司。
UV-6000分光光度计 上海元析仪器有限公司;AL104电子天平 梅特勒托利多仪器(上海)有限公司;SHZ-D(Ⅲ)循环水式真空泵 巩义市英峪予华仪器厂;GZX-9030MBE电热鼓风干燥箱 上海博迅实业有限公司医疗设备厂;QHZ-123B组合式全温度振荡培养箱 太仓市华美生化仪器厂;PB-10 pH计 赛多利斯科学仪器有限公司。
1.3 培养基
斜面培养基(PDA培养基,pH 7.0):马铃薯提取物200 g/L、葡萄糖20 g/L、琼脂20 g/L。
种子培养基(PDB培养基,pH 7.0):马铃薯提取物200 g/L、葡萄糖20 g/L。
摇瓶发酵培养基(自然pH值):NaNO33.0 g/L、K2HPO41.0 g/L、MgSO40.5 g/L、KCl 0.5 g/L、FeSO40.01 g/L、蔗糖2.0 g/L、CuSO4·5H2O 0.002 g/L、对羟基苯甲酸(C7H6O3)0.25 g/L。
1.4 方法
1.4.1 种子培养
将斜面培养基中保藏的B3菌接入种子培养基中活化,种子液在28 ℃、180 r/min的摇床中振荡培养48 h。
1.4.2 发酵培养
从摇瓶培养的种子液中取5 mL接种到装有100 mL发酵培养基的250 mL三角瓶中,在28 ℃、180 r/min的条件下进行发酵培养。
1.5 测定方法
每隔12 h进行损毁性取样,真空抽滤发酵培养基,菌丝体用于生物量的测定,滤液用于漆酶的活性检测和还原糖含量测定。所有发酵过程都进行3 个重复,测定结果以平均值表示。
1.5.1 生物量测定
干质量减量法:抽滤后的菌丝体,用烘箱100 ℃烘干至恒质量进行测定。
1.5.2 漆酶酶活力测定
5 mL反应混合物中包含1 mL粗酶液,测定5 mmol/L ABTS在0.2 mol/L磷酸钠缓冲液(pH 5.5)中氧化1 min吸光度A420nm的变化。每分钟氧化1 μmol ABTS所消耗的酶量定义为1个酶活力单位(U)。计算酶活力所用的摩尔消光系数ε为3.6×104L/(mol·cm)[14]。
1.5.3 蔗糖质量浓度测定
用蒽酮-硫酸法测定[15]。
2 结果与分析
2.1 内生真菌拟茎点霉B3发酵产漆酶曲线
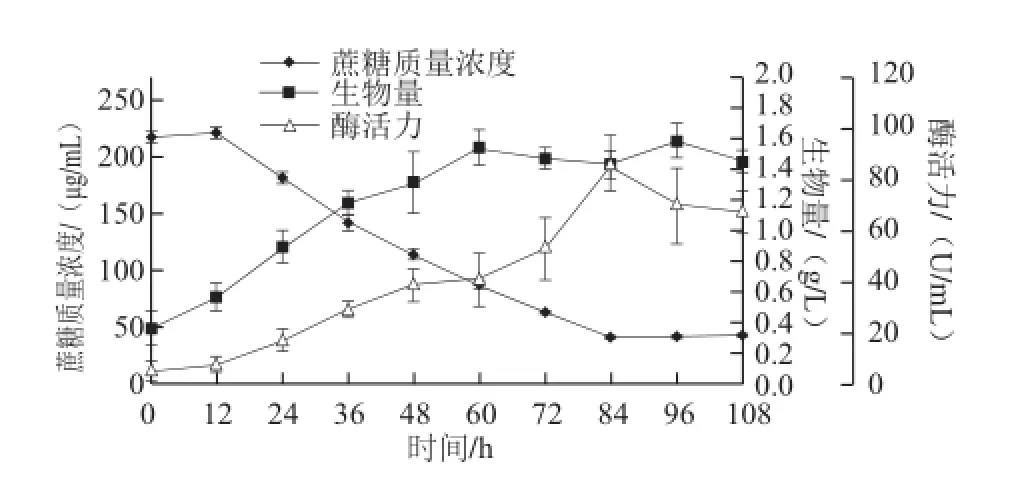
图1 内生真菌拟茎点霉B3发酵曲线Fig.1 Fermentation curves of Phomopsis liquidambari B3
在内生真菌拟茎点霉B3的发酵过程中,取样测定其生物量、漆酶酶活力和蔗糖质量浓度,绘制其发酵曲线,如图1所示。,菌体利用发酵培养基发酵产漆酶,经过短暂的延滞期之后,菌体进入指数生长阶段,与此同时,漆酶开始产生,并且产量不断增大。60 h之后,B3菌生长进入平稳期。在84 h左右,漆酶酶活力达到最高(86.4 U/mL),随后开始下降。蔗糖质量浓度由最初的217.24 μg/mL下降到41.10 μg/mL,它的消耗主要用于菌体生长、代谢活动的维持和漆酶的生成,随着菌体生长和漆酶产生而不断减少。由此可以看出,漆酶的生成与B3菌的生长有着很强的线性关系,这种关系属于部分生长偶联型。
2.2 内生真菌拟茎点霉B3发酵动力学模型的建立
微生物过程的数学模型可以用两种不同的机制表达:结构模型和非结构模型。结构模型会把细胞的结构、功能和成分这些基本的方面考虑进去。相反,非结构模型只用生物量来评价生物系统[16]。实验发现非结构模型更便于从菌体生长、漆酶生成和基质消耗方面描述发酵过程的特征。
2.2.1 菌体生长动力学模型
通常用来描述菌体生长的非结构模型主要有Monod动力学模型、Logistic方程和Haldane模型[17]。我们先前的实验数据显示Monod动力学模型并不适用于B3菌的发酵过程,而Logistic方程则被广泛地应用于单一基质的菌体生长模型,通过不依赖于基质浓度的S形曲线,简单计算得到具有生物学和几何意义的发酵动力学参数[18]。B3菌生物量达到最大值后会有一个极限,Logistic方程很好地描述了这样的生长动力学:

式中:dX/dt为菌体的生长速率/(g/(L·h));X为生物量/(g/L);t为发酵时间/h;μm为菌体生长速率最大时的比生长速率(h-1);Xm为最大生物量/(g/L)。
当t=0时,X=X0,对公式(1)积分,得到公式(2):
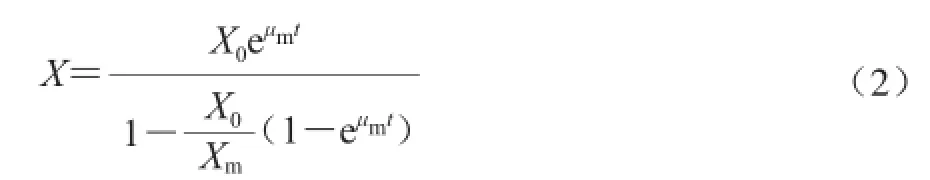
式中:X0为初始生物量/(g/L)。
2.2.2 漆酶生成动力学模型
漆酶生成动力学建立在Luedeking-Piret方程的基础上,该模型通常用来描述产物生成速率和细胞生长速率之间的关系[19]。产物的形成速率取决于线性方程中的即时生物量X和菌体生长速率dX/dt[20],如公式(3)所示:

式中:dP/dt为产物漆酶的生成速率/(U/mL·h);P为漆酶的酶活力/(U/mL);α为生长相关常数,β为非生长相关常数。根据方程,微生物生长和产物生成之间的关系被分为3类:当α≠0、β=0时,产物生成同菌体生长偶联;当α≠0、β≠0时,产物生成同菌体生长部分偶联;当α=0、β≠0时,产物生成与菌体生长无关[21]。根据实验结果和图1显示,漆酶的生成和B3菌的生长属于部分偶联型,对公式(3)积分,得到公式(4):

2.2.3 基质消耗动力学模型
在B3菌发酵产漆酶过程中,基质蔗糖主要用于B3菌的生长、代谢产物的生成以及细胞正常代谢活动的维持。因此,基质消耗动力学可以由Luedeking-Piret-Like方程表示:

式中:dS/dt为基质蔗糖的消耗速率/(μg/(mL·h));S为基质浓度/(μg/mL);λ即1/YX/S,YX/S为菌体得率系数;γ即MS,为菌体细胞维持系数。对公式(5)积分得到公式(6):
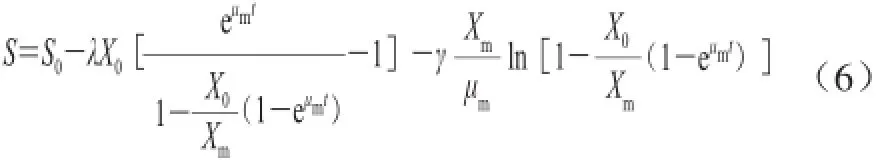
式中:S0为初始基质质量浓度/(μg/mL)。
2.3 发酵动力学模型参数求解
2.3.1 菌体生长动力学模型
利用最小二乘法调用MATLAB 7.13中的nlinfit函数迭代求解内生真菌拟茎点霉B3菌体生长动力学模型的相关参数值(表1),将测得的B3菌生物量实验值与菌体生长动力学模型公式(2)非线性拟合,得到图2。将μm=0.060 8、Xm=1.59、X0=0.355 4分别代入公式(1)、(2)得到公式(7)、(8):


表1 内生真菌拟茎点霉B3发酵动力学模型参数估计值Table 1 Estimated parameters of the fermentation kinetic model of Phomopsis liquidambariB3

图2 内生真菌拟茎点霉B3生长动力学模型与实验值的拟合Fig.2 Growth kinetic model and experimental data fitting of Phomopsis liquidambari B3
由图2可知,生长动力学模型与实验值有较好的拟合。尤其是60 h之前,实验值与模型曲线几乎一致,在60 h后,菌体生长受到菌体浓度的抑制,B3菌的生长进入平稳期,所测生物量的实验值出现微小的波动,与生长动力学模型曲线有所偏差。
2.3.2 漆酶生成动力学模型
利用最小二乘法调用MATLAB 7.13中的nlinfit函数迭代求解内生真菌拟茎点霉B3漆酶生成动力学模型的相关参数值(表1),将所测得的B3菌产漆酶酶活力实验值与漆酶生成动力学模型公式(4)非线性拟合,得到图3。将μm=0.060 8,Xm=1.59、X0=0.355 4、α= 25.352 5、β=0.271 0分别代入公式(3)、(4)得到公式(9)、(10):


图3 内生真菌拟茎点霉B3漆酶生成动力学模型与实验值的拟合Fig.3 Kinetic model of laccase production and experimental data fitting of Phomopsis liquidambari B3
由图3可知,漆酶生成动力学模型曲线与漆酶酶活力的实验值拟合情况较好。在菌体生长进入稳定期之前,漆酶酶活力与模型曲线几乎保持一致,当菌体生长受到抑制后,B3产漆酶的能力也受到影响,在84 h达到产漆酶最大值之后,B3菌产漆酶能力开始下降,末期的漆酶酶活力实验值明显低于模型计算值。
2.3.3 基质消耗动力学模型
利用最小二乘法调用MATLAB 7.13中的nlinfit函数迭代求解内生真菌拟茎点霉B3基质消耗动力学模型的相关参数值(表1),将测得发酵中的蔗糖含量实验值与基质消耗动力学模型公式(6)非线性拟合,得到图4。将μm=0.060 8、Xm=1.59、X0=0.355 4、λ=104.750 3、γ= -0.483 2、S0=240.518 8分别代入公式(5)、(6)得到公式(11)、(12):

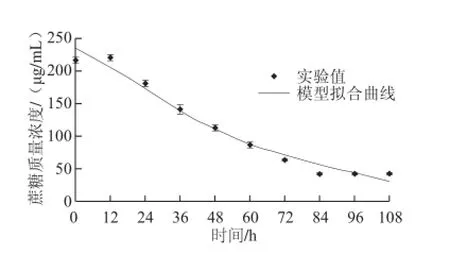
图4 内生真菌拟茎点霉B3基质消耗动力学模型与实验值的拟合Fig.4 Kinetic model of substrate consumption and experimental data fitting of Phomopsis liquidambari B3
由图4可知,基质消耗动力学模型曲线很好地描述了蔗糖在发酵过程中的消耗情况,只是与发酵实验末期的实验值有所偏差,可能与菌体生长受到抑制以及产漆酶能力下降有关。
2.4 模型的验证
为了验证B3菌菌体生长、产物漆酶生成和基质蔗糖消耗动力学模型的可靠性,将通过模型求出来的计算值与表2中给出的另一批发酵实验数据作比较。可以明显看出,大部分实验值与计算值之间的偏差都低于10%,生物量、漆酶酶活力和基质质量浓度的平均偏差分别为5.34%、7.91%和7.69%,这意味着这些模型能很好地描述B3发酵产漆酶的过程。

表2 内生真菌拟茎点霉B3发酵实验值与模型计算值比较Table 2 Comparison between experimental values and model calculation of Phomopsis liquidambari B3
3 结 论
本实验中B3的漆酶生成和菌体的生长属于部分生长偶联型,根据B3菌在发酵过程中所测得的菌体生长、漆酶生成和基质消耗的实验数据,利用MATLAB软件进行非线性拟合,建立发酵动力学的模型,可以表述为:菌体生长动力学模型:;漆酶生成动力学模型:+7.087 0ln(0.776 5+0.223 5e0.0608t)-9.010 3;基质消耗动力学模型:12.636 3ln(0.776 5+0.223 5e0.0608t)。
比较模型计算值与验证实验值,发现偏差大部分都低于10%,平均偏差分别为5.34%、7.91%和7.69%,说明该发酵动力学模型能很好地反映B3菌菌体生长、漆酶生成和基质消耗的变化规律,对于B3菌发酵产漆酶及其工业生产的放大具有参考价值。
[1] CAMARERO S, PARDO I, CAÑAS A I, et al. Engineering platforms for directed evolution of laccase from Pycnoporus cinnabarinus[J]. Applied and Environmental Microbiology, 2012, 78(5): 1370-1384.
[2] JEON J R, CHANG Y S. Laccase-mediated oxidation of small organics: bifunctional roles for versatile applications[J]. Trends in Biotechnology, 2013, 31(6): 335-341.
[3] DI FUSCO M, TORTOLINI C, DERIU D, et al. Laccase-based biosensor for the determination of polyphenol index in wine[J]. Talanta, 2010, 81(1): 235-240.
[4] RODGERS C J, BLANFORD C F, GIDDENS S R, et al. Designer laccases: a vogue for high-potential fungal enzymes?[J]. Trends in Biotechnology, 2010, 28(2): 63-72.
[5] TELKE A A, GHODAKE G S, KALYANI D C, et al. Biochemical characteristics of a textile dye degrading extracellular laccase from a Bacillus sp. ADR[J]. Bioresource Technology, 2011, 102(2): 1752-1756.
[6] RODRÍGUEZ COUTO S, TOCA HERRERA J L. Industrial and biotechnological applications of laccases: a review[J]. Biotechnology Advances, 2006, 24(5): 500-513.
[7] MINUSSI R C, PASTORE G M, DURAN N. Potential applications of laccase in the food industry[J]. Trends in Food Science and Technology, 2002, 13(6): 205-216.
[8] OSMA J F, TOCA-HERRERA J L, RODRÍGUEZ-COUTO S. Uses of laccases in the food industry[J]. Enzyme Research, 2010, doi:10.4061/2010/149748.
[9] DAI Chuanchao, CHEN Yan, TIAN Linshuang, et al. Correlation between invasion by endophytic fungus Phomopsis sp. and enzyme production[J]. African Journal of Agricultural Res earch, 2010, 5(11): 1324-1330.
[10] 史央, 戴传超, 陆玲, 等. 大戟科 4 种药用植物内生真菌3 种胞外酶活性的比较[J]. 植物资源与环境学报, 2002, 11(2): 17-20.
[11] 史央, 戴传超, 吴耀春, 等. 植物内生真菌强化还田秸杆降解的研究[J].环境科学学报, 2004, 24(1): 144-149.
[12] KONG Q, HE G Q, CHEN F, et al. Studies on a kinetic model for butyric acid bioproduction by Clostridium butyricum[J]. Letters in Applied Microbiology, 2006, 43(1): 71-77.
[13] CHEN Yan, PENG Yao, DAI Chuanchao, et al. Biodegradation of 4-hydroxybenzoic acid by Phomopsis liquidambari[J]. Applied Soil Ecology, 2011, 51: 102-110.
[14] CHEN Yan, XIE Xingguang, REN Chenggang, et al. Degradation of N-heterocyclic indole by a novel endophytic fungus Phomopsis liquidambari[J]. Bioresource Technology, 2013, 129: 568-574.
[15] 张惟杰. 糖复合物生化研究技术[M]. 杭州: 浙江大学出版社, 1994: 12-13.
[16] GERNAEY K V, LANTZ A E, TUFVESSON P, et al. Application of mechanistic models to fermentation and biocatalysis for nextgeneration processes[J]. Trends in Biotechnology, 2010, 28(7): 346-354.
[17] BANKAR S B, SINGHAL R S. Fermentation kinetics makeover in poly-ε-lysine biosynthesis by Streptomyces noursei NRRL 5126[J]. Journal of Biochemical Technology, 2012, 3(4): 312-316.
[18] MAHAJAN P M, GOKHALE S V, LELE S S. Production of nattokinase using Bacillus natto NRRL 3666: media optimization, scale up, and kinetic modeling[J]. Food Science and Biotechnology, 2010, 19(6): 1593-1603.
[19] 张志东, 王玮, 茆军, 等. 低温淀粉酶发酵动力学模型的研究[J]. 食品科学, 2009, 30(3): 137-140.
[20] 詹喜, 姜峰, 殷赟, 等. 生防菌枯草芽孢杆菌 BS-Z 的分批发酵动力学初探[J]. 食品科学, 2007, 28(5): 223-227.
[21] YANG Jinshui, RASA E, TANTAYOTAI P, et al. Mathematical model of Chlorella minutissima UTEX2341 growth and lipid production under photoheterotrophic fermentation conditions[J]. Bioresource Technology, 2011, 102(3): 3077-3082.
Kinetics of Laccase Production by Batch Fermentation of Endophytic Fungus Phomopsis liquidambari B3
ZHOU Jun1, MEI Yan-zhen1, YANG Teng1, KANG Li1, DAI Zhi-dong2, DAI Chuan-chao1,*
(1. Jiangsu Engineering and Technology Research Center for Industrialization of Microbial Resources, Jiangsu Key Laboratory for Microbes and Functional Genomics, College of Life Sciences, Nanjing Normal University, Nanjing 210023, China; 2. Shangde Biotechnology Company, Danyang 212300, China)
The aim of this study was to establish a kinetic model of laccase production by batch fermentation of the endophytic fungus Phomopsis liquidambari B3. The experimental results showed that the production of laccase was partially associated with the growth of P. liquidambari B3. The experimental data were nonlinearly fitted to the Logistic equation describing cell growth, the Luedeking-Piret equation indicating laccase production and the Luedeking-Piret-Like equation revealing substrate consumption using MATLAB software, and the optimal parameters and the fermentation kinetic model were established. Validation experiments revealed the errors between the calculated and experimental values were less than 10%, indicating that the kinetic model can describe the actual fermentation process of P. liquidambari B3.
endophytic fungus; Phomopsis liquidambari B3; laccase; batch fermentation; kinetic model
Q815
A
1002-6630(2014)15-0183-05
10.7506/spkx1002-6630-201415037
2013-07-29
江苏省社会发展项目(BE2010708);江苏省高校科研成果产业化推进工程项目(JHB2012-16);
南京市科委工程中心创新能力提升项目(201105058)
周骏(1990—),男,硕士研究生,研究方向为微生物生态与环境工程。E-mail:raul1990713@163.com
*通信作者:戴传超(1970—),男,教授,博士,研究方向为植物圈微生物资源与生态功能。E-mail:daichuanchao@njnu.edu.cn

